名校
解题方法
1 . CO2减排能有效降低温室效应,同时,CO2也是一种重要的资源,因此CO2捕集与转化技术研究备受关注。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为_______ 。若反应①为慢反应(活化能高),下列图中能体现上述能量变化的是_______ 。
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
①离子液体聚合物捕集CO2的反应为_______ (填“吸热”或“放热”)反应。
②离子液体聚合物捕集CO2的有利条件是_______ 。
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。_______ (填“正”或“负”)。
(4)B极的电极反应为_______ 。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为
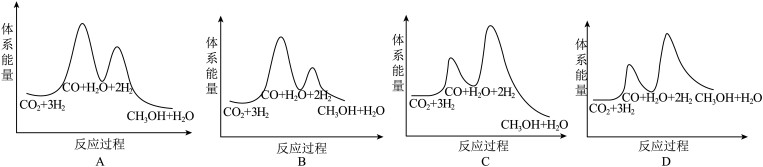
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
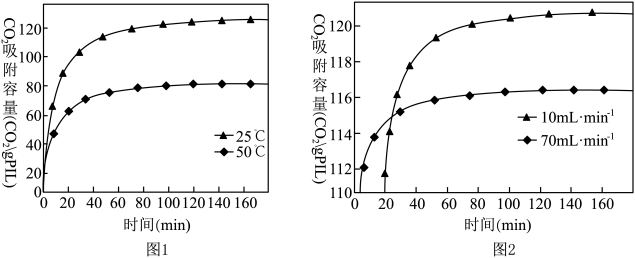
①离子液体聚合物捕集CO2的反应为
②离子液体聚合物捕集CO2的有利条件是
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。
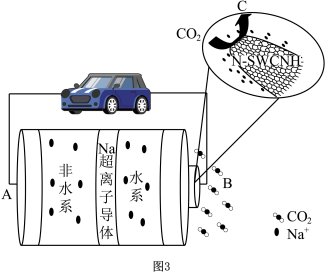
(4)B极的电极反应为
您最近一年使用:0次
名校
解题方法
2 . I.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
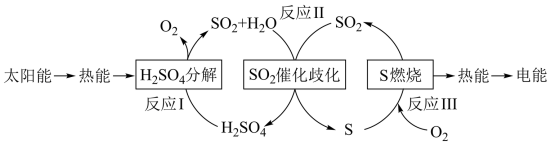
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2___________ p 1(填“>”或“<”),得出该结论的理由是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.________
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是___________ 。
(注:1mmol•L-1=10-3mol•L-1)
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
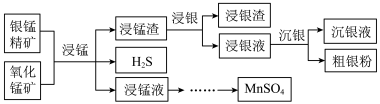
已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:_______
□Fe3+ + Ag2S + □ ___________ □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S
(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是
| A | B | C | D | |
| c(I2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.11 |
| c(H2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.44 |
| c(HI)/mmol•L-1 | 1.00 | 1.56 | 4.00 | 1.56 |
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:
□Fe3+ + Ag2S + □ ___________
 □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:
您最近一年使用:0次
名校
3 . 二甲醚 被誉为“21世纪的清洁燃料”,工业上可以通过合成气(主要成分是
被誉为“21世纪的清洁燃料”,工业上可以通过合成气(主要成分是 和
和 )或者
)或者 制得。
制得。
Ⅰ.由合成气制备二甲醚的主要原理如下:
①
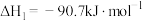
②
③
回答下列问题:
(1)反应 的
的
_____  。
。
(2)下列措施中,能提高(1)中 产率的有
产率的有_____ (填字母)。
A.使用过量的 B.升高温度 C.增大压强
B.升高温度 C.增大压强
(3)一定温度下,将 和
和 通入
通入 恒容密闭容器中,发生反应③,
恒容密闭容器中,发生反应③, 后达到化学平衡,平衡后测得
后达到化学平衡,平衡后测得 的物质的量为
的物质的量为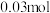 ,则
,则 内
内
_____ , 的转化率为
的转化率为_____ 。
(4)利用乙酸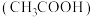 蒸汽催化重整可以得到合成气(
蒸汽催化重整可以得到合成气( 和
和 )。发生的反应为:
)。发生的反应为:  Ⅰ
Ⅰ
同时有副反应发生,主要的副反应为: Ⅱ
Ⅱ
利用合成气合成甲烷,发生反应的热化学方程式为:
请回答:利用 和
和 计算
计算 时,还需要利用
时,还需要利用_____ 反应的 。
。
Ⅱ. 分子间脱水制二甲醚
分子间脱水制二甲醚
 。在
。在 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。 时刻反应达平衡后,该温度下该反应的平衡常数
时刻反应达平衡后,该温度下该反应的平衡常数
_____ 。
(6)相同条件下,若改变起始浓度,某时刻各组分浓度依次为 、
、 ,此时
,此时
_____  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 被誉为“21世纪的清洁燃料”,工业上可以通过合成气(主要成分是
被誉为“21世纪的清洁燃料”,工业上可以通过合成气(主要成分是 和
和 )或者
)或者 制得。
制得。Ⅰ.由合成气制备二甲醚的主要原理如下:
①

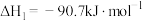
②

③

回答下列问题:
(1)反应
 的
的
 。
。(2)下列措施中,能提高(1)中
 产率的有
产率的有A.使用过量的
 B.升高温度 C.增大压强
B.升高温度 C.增大压强(3)一定温度下,将
 和
和 通入
通入 恒容密闭容器中,发生反应③,
恒容密闭容器中,发生反应③, 后达到化学平衡,平衡后测得
后达到化学平衡,平衡后测得 的物质的量为
的物质的量为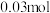 ,则
,则 内
内
 的转化率为
的转化率为(4)利用乙酸
 蒸汽催化重整可以得到合成气(
蒸汽催化重整可以得到合成气( 和
和 )。发生的反应为:
)。发生的反应为:  Ⅰ
Ⅰ同时有副反应发生,主要的副反应为:
 Ⅱ
Ⅱ利用合成气合成甲烷,发生反应的热化学方程式为:

请回答:利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。Ⅱ.
 分子间脱水制二甲醚
分子间脱水制二甲醚 。在
。在 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
 时刻反应达平衡后,该温度下该反应的平衡常数
时刻反应达平衡后,该温度下该反应的平衡常数
(6)相同条件下,若改变起始浓度,某时刻各组分浓度依次为
 、
、 ,此时
,此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
解题方法
4 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是_____(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。
已知:
计算可得: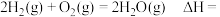
_____ 
若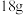 水蒸气转化为液态水放出
水蒸气转化为液态水放出 的热量,则反应
的热量,则反应 的反应热为
的反应热为_____ , 的燃烧热为
的燃烧热为_____
已知
②根据上述数据, 和
和 本身具有的能量最低的是
本身具有的能量最低的是_____
③ 的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出
的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式_____
(1)下列反应中,属于吸热反应的是_____(填字母)。
A. 与水反应 与水反应 | B.甲烷的燃烧反应 |
C. 与盐酸反应 与盐酸反应 | D.锌与盐酸反应 |
①通过化学键的键能计算。
已知:
| 化学键种类 |  |  |  |  |  |
键能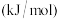 | 436 | 498 | 463.4 | 432 | 366 |

若
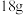 水蒸气转化为液态水放出
水蒸气转化为液态水放出 的热量,则反应
的热量,则反应 的反应热为
的反应热为 的燃烧热为
的燃烧热为已知
②根据上述数据,
 和
和 本身具有的能量最低的是
本身具有的能量最低的是③
 的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出
的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式
您最近一年使用:0次
名校
解题方法
5 . 化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)下列反应中属于吸热反应的是___________ (填“序号”)。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
(2)如图所示装置可以说明有化学能转化为电能的实验现象为___________ ,正极的电极反应为___________ 。

(3)已知:2mol氢气与足量氧气充分燃烧生成液态水时放出572kJ热量。
①表示H2燃烧热的热化学方程式为:___________
②若H-H键、O=O键和H-O键的键能分别为E1、E2和E3,反应2H2(g)+O2(g)=2H2O(g) ΔH ,则ΔH =___________ (用含E1、E2、E3的式子表示),且ΔH ___________ (填“大于”“小于”或“等于”)-572kJ/mol。
(4)FeS2焙烧产生的SO2可用于制硫酸。
已知25°C、101kPa时,2SO2(g)+O2(g)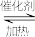 2SO3(g) ΔH1=-197kJ/mol
2SO3(g) ΔH1=-197kJ/mol
H2O(g)=H2O(l) ΔH2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545kJ/mol;
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是___________ 。
(5)完全燃烧一定质量的无水乙醇,放出的热量为a,已知为了完全吸收生成的二氧化碳,消耗50mL 8mol/L的氢氧化钠溶液,则1mol无水乙醇燃烧放出的热量Q可能是________
___________ a≤ Q≤ ___________ a
(1)下列反应中属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
(2)如图所示装置可以说明有化学能转化为电能的实验现象为

(3)已知:2mol氢气与足量氧气充分燃烧生成液态水时放出572kJ热量。
①表示H2燃烧热的热化学方程式为:
②若H-H键、O=O键和H-O键的键能分别为E1、E2和E3,反应2H2(g)+O2(g)=2H2O(g) ΔH ,则ΔH =
(4)FeS2焙烧产生的SO2可用于制硫酸。
已知25°C、101kPa时,2SO2(g)+O2(g)
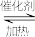 2SO3(g) ΔH1=-197kJ/mol
2SO3(g) ΔH1=-197kJ/molH2O(g)=H2O(l) ΔH2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545kJ/mol;
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是
(5)完全燃烧一定质量的无水乙醇,放出的热量为a,已知为了完全吸收生成的二氧化碳,消耗50mL 8mol/L的氢氧化钠溶液,则1mol无水乙醇燃烧放出的热量Q可能是
___________ a≤ Q≤ ___________ a
您最近一年使用:0次
名校
6 . 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产生活中有着重要作用。
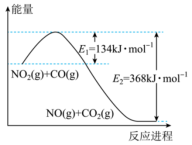
(1)根据能量变化示意图,写出NO2和CO反应的热化学方程式___________ 。
(2)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g) + 3O2 (g) = 2N2 (g)+ 6H2O(g) ΔH1= -akJ/mol ①
N2(g) + O2(g) = 2NO(g) ΔH2= -bkJ/mol ②
若1mol NH3还原NO至N2,则该反应过程中的反应热 ΔH3 =___________ kJ/mol (用含 a、b 的式子表示)。
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g) + 3H2(g) 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
①该反应的平衡常数表达式:K=___________
②一定温度下,在2L密闭容器中充入1mol N2和3mol H2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的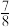 ,则N2的转化率α(N2) =
,则N2的转化率α(N2) =___________ ,以NH3 表示该过程的反应速率v(NH3)= ___________ 。
③下列选项不能证明合成氨反应达到化学平衡状态的是___________ 。
A. N2、H2和NH3的浓度不再变化
B. 单位时间内消耗n mol N2同时消耗3nmol H2
C. 1 mol氮氮三键断裂同时6molN-H键断裂
D. 恒容时容器内总压强不随时间而变化
E. 恒容时混合气体的密度保持不变
F. 混合气体的平均相对分子质量不再改变
(4)对反应N2O4(g) 2NO2(g) ΔH>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g) ΔH>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是___________ 。

a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用降温的方法
(1)根据能量变化示意图,写出NO2和CO反应的热化学方程式

(2)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g) + 3O2 (g) = 2N2 (g)+ 6H2O(g) ΔH1= -akJ/mol ①
N2(g) + O2(g) = 2NO(g) ΔH2= -bkJ/mol ②
若1mol NH3还原NO至N2,则该反应过程中的反应热 ΔH3 =
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g) + 3H2(g)
 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,①该反应的平衡常数表达式:K=
②一定温度下,在2L密闭容器中充入1mol N2和3mol H2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的
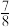 ,则N2的转化率α(N2) =
,则N2的转化率α(N2) =③下列选项不能证明合成氨反应达到化学平衡状态的是
A. N2、H2和NH3的浓度不再变化
B. 单位时间内消耗n mol N2同时消耗3nmol H2
C. 1 mol氮氮三键断裂同时6molN-H键断裂
D. 恒容时容器内总压强不随时间而变化
E. 恒容时混合气体的密度保持不变
F. 混合气体的平均相对分子质量不再改变
(4)对反应N2O4(g)
 2NO2(g) ΔH>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g) ΔH>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用降温的方法
您最近一年使用:0次
名校
7 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
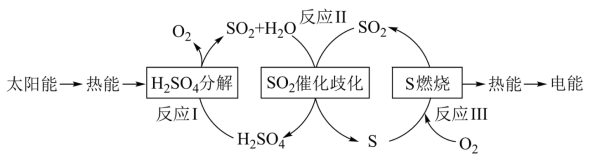
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的化学方程式:___________ ,该步反应的ΔH2=___________ kJ·mol-1。
(2)对反应Ⅱ,在某一投料比时,一定压强 (p1)下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

H2SO4在平衡体系中物质的量分数随温度的升高而下降,原因是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+____=____+____+2I-,__________
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的化学方程式:
(2)对反应Ⅱ,在某一投料比时,一定压强 (p1)下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

H2SO4在平衡体系中物质的量分数随温度的升高而下降,原因是
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+____=____+____+2I-,
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI与0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI与0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
名校
8 . 氮元素单质及其化合物在工农业生产生活中有着重要作用。
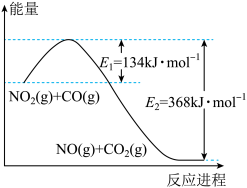
(1)根据下图,NO2和CO反应生成NO和CO2的ΔH =___________ kJ•mol-1。
(2)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:

 ①
①

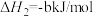 ②
②
若1mol NH3还原NO至N2,则该反应过程中的反应热ΔH3___________  (用含a、b的式子表示)。
(用含a、b的式子表示)。
(3)在固定体积的密闭容器中,进行如下化学反应:N2 (g)+3H2 (g) 2NH3 (g)
2NH3 (g)  ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K ___________
②试判断K1___________ K2 (填写“>”“=”或“<”)
③一定温度下,在2L密闭容器中充入1mol N2和3mol H2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率α(N2)=___________ ,以NH3表示该过程的反应速率v(NH3)=___________ 。
(1)根据下图,NO2和CO反应生成NO和CO2的ΔH =

(2)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:

 ①
①
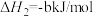 ②
②若1mol NH3还原NO至N2,则该反应过程中的反应热ΔH3
 (用含a、b的式子表示)。
(用含a、b的式子表示)。(3)在固定体积的密闭容器中,进行如下化学反应:N2 (g)+3H2 (g)
 2NH3 (g)
2NH3 (g)  ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1 106 106 | K1 | K2 |
②试判断K1
③一定温度下,在2L密闭容器中充入1mol N2和3mol H2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率α(N2)=
您最近一年使用:0次
名校
9 . 氮及其化合物在实际生活中有重要应用价值。请回答下列问题:
Ⅰ.工业上由氮气可以制得硝酸,流程如下图所示:

(1)反应1的化学方程式是___________ 。
(2)为分析反应3,在800℃时,向容积为1 L的密闭容器中充入0.010 mol NO和0.005 mol ,反应过程中c(NO)随时间变化如图所示。
,反应过程中c(NO)随时间变化如图所示。

①2 min内,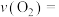
___________  。
。
②写出该反应的化学平衡常数表达式
___________ 。
(3)已知:
i.
ii.
写出 和
和 生成NO的热化学方程式
生成NO的热化学方程式___________
Ⅱ.在容积为1.00 L的密闭容器中,通入一定量的 ,100℃时,各物质浓度随时间变化如下图所示。
,100℃时,各物质浓度随时间变化如下图所示。

(4)写出反应的化学方程式___________ ,升高温度,混合气体的颜色变深,此反应正反应是___________ 反应(填“放热”或“吸热”)。
(5)下列叙述中,能说明该反应达到化学平衡状态的是___________ (填字母序号)。
a. 的生成速率与
的生成速率与 的分解速率相等
的分解速率相等
b.单位时间内消耗a mol ,同时生成2a mol
,同时生成2a mol 
c.容器内的压强不再变化
d.容器内气体的密度不再变化
e.容器内气体平均摩尔质量不再变化
f.容器内气体颜色不再变化
Ⅰ.工业上由氮气可以制得硝酸,流程如下图所示:

(1)反应1的化学方程式是
(2)为分析反应3,在800℃时,向容积为1 L的密闭容器中充入0.010 mol NO和0.005 mol
 ,反应过程中c(NO)随时间变化如图所示。
,反应过程中c(NO)随时间变化如图所示。
①2 min内,
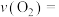
 。
。②写出该反应的化学平衡常数表达式

(3)已知:
i.

ii.

写出
 和
和 生成NO的热化学方程式
生成NO的热化学方程式Ⅱ.在容积为1.00 L的密闭容器中,通入一定量的
 ,100℃时,各物质浓度随时间变化如下图所示。
,100℃时,各物质浓度随时间变化如下图所示。
(4)写出反应的化学方程式
(5)下列叙述中,能说明该反应达到化学平衡状态的是
a.
 的生成速率与
的生成速率与 的分解速率相等
的分解速率相等b.单位时间内消耗a mol
 ,同时生成2a mol
,同时生成2a mol 
c.容器内的压强不再变化
d.容器内气体的密度不再变化
e.容器内气体平均摩尔质量不再变化
f.容器内气体颜色不再变化
您最近一年使用:0次
名校
解题方法
10 . 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)知25℃和101KPa时,液态甲醇( )的燃烧热
)的燃烧热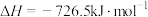 。请写出表示甲醇燃烧热的热化学方程式
。请写出表示甲醇燃烧热的热化学方程式___________ 。
(2) 资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:
反应Ⅰ: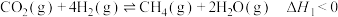
反应Ⅱ: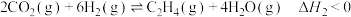
①将反应后气体通入___________ (填试剂名称),可证明反应Ⅱ发生。
②计算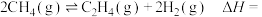
___________ (用 和
和 表示)
表示)
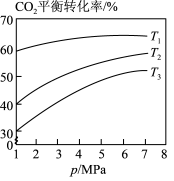
③相同投料比时,体系内 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为___________ 。
(3)镍氢催化剂活性因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
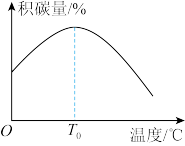
积碳反应:
消碳反应:
其他条件相同时,催化剂表面积碳量与温度的关系如图所示, ℃之后,温度升高积碳量减小的主要原因
℃之后,温度升高积碳量减小的主要原因___________ 。
(1)知25℃和101KPa时,液态甲醇(
 )的燃烧热
)的燃烧热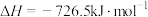 。请写出表示甲醇燃烧热的热化学方程式
。请写出表示甲醇燃烧热的热化学方程式(2)
 资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:反应Ⅰ:
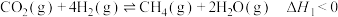
反应Ⅱ:
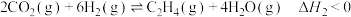
①将反应后气体通入
②计算
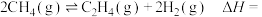
 和
和 表示)
表示)③相同投料比时,体系内
 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
(3)镍氢催化剂活性因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:

积碳反应:

消碳反应:

其他条件相同时,催化剂表面积碳量与温度的关系如图所示,
 ℃之后,温度升高积碳量减小的主要原因
℃之后,温度升高积碳量减小的主要原因
您最近一年使用:0次



