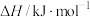1 . 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
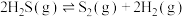
 kJ⋅mol
kJ⋅mol
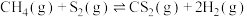
 kJ⋅mol
kJ⋅mol
计算反应③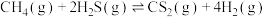 的
的
_______ kJ⋅mol ;反应③能够自发的条件是
;反应③能够自发的条件是_______ 。
(2)在1000℃时,反应①的 kJ⋅mol
kJ⋅mol ,反应③的
,反应③的 kJ⋅mol
kJ⋅mol 。已知
。已知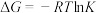 (R为常数,T为温度,K为平衡常数),据此分析反应③处理
(R为常数,T为温度,K为平衡常数),据此分析反应③处理 的工艺方法的优点是
的工艺方法的优点是_______ 。
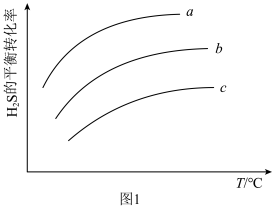
(3)在不同温度、反应压强为100 kPa,进料比 分别为a、b、c的条件下,反应③
分别为a、b、c的条件下,反应③ 平衡转化率如图1所示,则a、b、c由大到小的顺序为
平衡转化率如图1所示,则a、b、c由大到小的顺序为_______ ;温度越高,反应③ 平衡转化率越大的原因是
平衡转化率越大的原因是_______ 。
(4)在T℃、pkPa条件下,将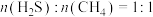 的混合气进行反应③,同时发生副反应
的混合气进行反应③,同时发生副反应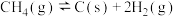 ,达到平衡时,
,达到平衡时, 的转化率为80%,
的转化率为80%, 的转化率为90%,则反应③的
的转化率为90%,则反应③的
_______ 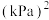 (列出计算式)。
(列出计算式)。
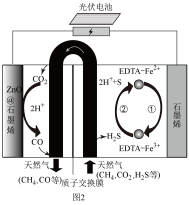
(5)我国科学家设计了一种 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其示意图如图2所示,则阳极区发生的总反应为
的高效去除,其示意图如图2所示,则阳极区发生的总反应为_______ 。
(1)已知下列反应的热化学方程式:
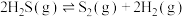
 kJ⋅mol
kJ⋅mol
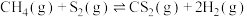
 kJ⋅mol
kJ⋅mol
计算反应③
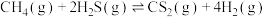 的
的
 ;反应③能够自发的条件是
;反应③能够自发的条件是(2)在1000℃时,反应①的
 kJ⋅mol
kJ⋅mol ,反应③的
,反应③的 kJ⋅mol
kJ⋅mol 。已知
。已知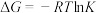 (R为常数,T为温度,K为平衡常数),据此分析反应③处理
(R为常数,T为温度,K为平衡常数),据此分析反应③处理 的工艺方法的优点是
的工艺方法的优点是(3)在不同温度、反应压强为100 kPa,进料比
 分别为a、b、c的条件下,反应③
分别为a、b、c的条件下,反应③ 平衡转化率如图1所示,则a、b、c由大到小的顺序为
平衡转化率如图1所示,则a、b、c由大到小的顺序为 平衡转化率越大的原因是
平衡转化率越大的原因是
(4)在T℃、pkPa条件下,将
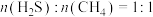 的混合气进行反应③,同时发生副反应
的混合气进行反应③,同时发生副反应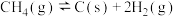 ,达到平衡时,
,达到平衡时, 的转化率为80%,
的转化率为80%, 的转化率为90%,则反应③的
的转化率为90%,则反应③的
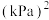 (列出计算式)。
(列出计算式)。(5)我国科学家设计了一种
 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其示意图如图2所示,则阳极区发生的总反应为
的高效去除,其示意图如图2所示,则阳极区发生的总反应为
您最近一年使用:0次
解题方法
2 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
I.CO2在Pb催化剂作用下,通过电催化还原为CO、HCOOH等物质被认为是一种具有前景的利用CO2的方式。
(1)Pb催化剂中引入Bi能够提高它的选择性。Bi的价电子排布式为6s26p3,其在元素周期表中的位置为___________ 。
(2)在Pb催化剂表面,CO2转化为CO和HCOOH是通过两种平行的反应途径进行的。CO2还原生成CO、HCOOH的关键中间体分别为*COOH、HCOO*。Pb催化剂催化CO2转化为CO和HCOOH的反应历程如图所示。(*表示吸附在催化剂表面)
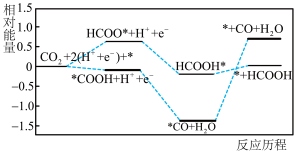
①写出CO2在酸性介质中电催化还原为HCOOH的电极反应式___________ 。
②产物的选择性是由催化剂对两种关键中间体的结合强度决定的。在Pb催化剂表面更利于生成___________
II.CH4与CO2重整是CO2再利用的研究热点之一,该重整反应体系主要涉及以下反应:
反应①:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1
2CO(g)+2H2(g) ΔH1
反应②:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
反应③:2CO(g) CO2(g)+C(s) ΔH3=-172.5kJ·mol-1
CO2(g)+C(s) ΔH3=-172.5kJ·mol-1
(3)已知25℃时,CH4、CO和H2的燃烧热分别为890 kJ·mol-1、283kJ·mol-1和285.8kJ·mol-1则ΔH1=___________ 。
(4)1.01×105 Pa下,将n(CO2):n(CH4)=1:1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图所示。
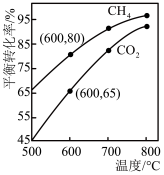
①800℃时CO2的平衡转化率远大于600℃时CO2的平衡转化率,其原因是___________ 。
②CH4的还原能力(R)可用于衡量CO2的转化效率,R=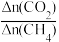 (平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=
(平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=___________ ;随温度的升高,R变化趋势为___________ (填“增大”、“减小”、“先减小后增大”)。
I.CO2在Pb催化剂作用下,通过电催化还原为CO、HCOOH等物质被认为是一种具有前景的利用CO2的方式。
(1)Pb催化剂中引入Bi能够提高它的选择性。Bi的价电子排布式为6s26p3,其在元素周期表中的位置为
(2)在Pb催化剂表面,CO2转化为CO和HCOOH是通过两种平行的反应途径进行的。CO2还原生成CO、HCOOH的关键中间体分别为*COOH、HCOO*。Pb催化剂催化CO2转化为CO和HCOOH的反应历程如图所示。(*表示吸附在催化剂表面)

①写出CO2在酸性介质中电催化还原为HCOOH的电极反应式
②产物的选择性是由催化剂对两种关键中间体的结合强度决定的。在Pb催化剂表面更利于生成
II.CH4与CO2重整是CO2再利用的研究热点之一,该重整反应体系主要涉及以下反应:
反应①:CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1
2CO(g)+2H2(g) ΔH1反应②:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1反应③:2CO(g)
 CO2(g)+C(s) ΔH3=-172.5kJ·mol-1
CO2(g)+C(s) ΔH3=-172.5kJ·mol-1(3)已知25℃时,CH4、CO和H2的燃烧热分别为890 kJ·mol-1、283kJ·mol-1和285.8kJ·mol-1则ΔH1=
(4)1.01×105 Pa下,将n(CO2):n(CH4)=1:1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图所示。

①800℃时CO2的平衡转化率远大于600℃时CO2的平衡转化率,其原因是
②CH4的还原能力(R)可用于衡量CO2的转化效率,R=
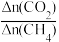 (平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=
(平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=
您最近一年使用:0次
2023-04-04更新
|
755次组卷
|
3卷引用:湖北省圆创2023届高三3月联合测评化学试题
名校
解题方法
3 . 汽车尾气中含有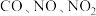 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:
①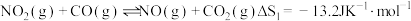
②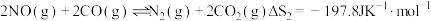
③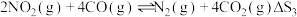
(1)已知 ,(忽略
,(忽略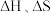 随温度的影响),则
随温度的影响),则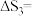
_________ 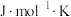 。
。
(2)反应①的平衡常数 的关系如图1:
的关系如图1:
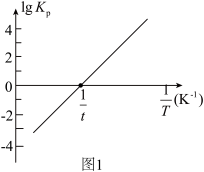
反应①为___________ (填“吸热”或“放热”)反应;温度为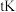 下,向恒容密闭容器中加入
下,向恒容密闭容器中加入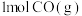 和
和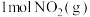 (若只发生反应①),测得起始压强为
(若只发生反应①),测得起始压强为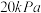 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为___________ ; 的分压为
的分压为___________  。
。
(3)向体积均为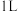 的容器中加入
的容器中加入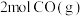 和
和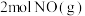 (若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
(若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
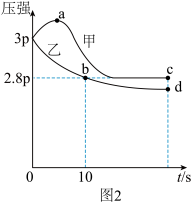
①甲容器中,开始压强增大的原因是___________
②c点的逆反应速率大于b点的逆反应速率的原因是___________
③c点对应的平衡常数___________ d点对应的平衡常数(填“大于”、“小于”或“等于”)。
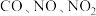 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:①
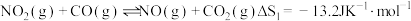
②
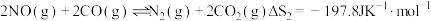
③
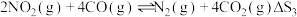
(1)已知
 ,(忽略
,(忽略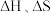 随温度的影响),则
随温度的影响),则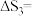
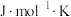 。
。(2)反应①的平衡常数
 的关系如图1:
的关系如图1:
反应①为
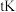 下,向恒容密闭容器中加入
下,向恒容密闭容器中加入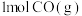 和
和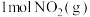 (若只发生反应①),测得起始压强为
(若只发生反应①),测得起始压强为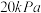 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为 的分压为
的分压为 。
。(3)向体积均为
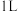 的容器中加入
的容器中加入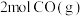 和
和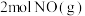 (若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
(若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
①甲容器中,开始压强增大的原因是
②c点的逆反应速率大于b点的逆反应速率的原因是
③c点对应的平衡常数
您最近一年使用:0次
2023-03-31更新
|
540次组卷
|
2卷引用:湖北省十一校2023届高三第二次联考化学试题
4 . 根据所学的化学反应原理知识回答下列问题。
(1)已知关于铁的氧化物存在下列三个热化学方程式:

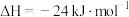 ①
①
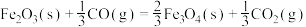
 ②
②

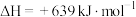 ③
③
则CO还原FeO的热化学方程式为 △H=
△H=_______ kJ∙mol−1。
(2)下表所列数据是反应
 在不同温度下的化学平衡常数(K)。
在不同温度下的化学平衡常数(K)。
①此反应_______ 自发(填“高温”、“低温”或“不能”)。
②某温度下,将2mol CO和6mol 充入2L的密闭容器中,充分反应后,达到平衡时测得
充入2L的密闭容器中,充分反应后,达到平衡时测得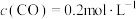 ,此时的温度是
,此时的温度是_______ 。
③要提高CO的转化率,可以采取的措施是_______ 。
A.升温 B.恒容充入CO C.恒容充入 D.恒压充入惰性气体 E.分离出甲醇
D.恒压充入惰性气体 E.分离出甲醇
(3)毒重石的主要成分为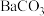 (含
(含 、
、 、
、 等杂质),实验室利用毒重石制备
等杂质),实验室利用毒重石制备 的流程如图:
的流程如图:

已知: ,
,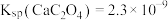 。
。
加入 调
调 可除去
可除去_______ (填离子符号),滤渣Ⅱ中含_______ (填化学式)。加入 时应避免过量,原因是
时应避免过量,原因是_______ 。
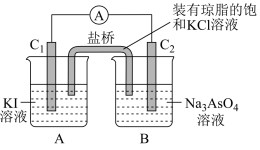
(4)已知 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)。开始时:
均为石墨电极)。开始时: 棒上电极反应为
棒上电极反应为_______ ,当电流表_______ 时,反应达到化学平衡状态。
(1)已知关于铁的氧化物存在下列三个热化学方程式:

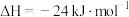 ①
①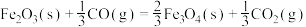
 ②
②
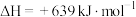 ③
③则CO还原FeO的热化学方程式为
 △H=
△H=(2)下表所列数据是反应

 在不同温度下的化学平衡常数(K)。
在不同温度下的化学平衡常数(K)。| 温度/℃ | 250 | 300 | 350 |
| 平衡常数(K) | 2.04 | 0.27 | 0.012 |
②某温度下,将2mol CO和6mol
 充入2L的密闭容器中,充分反应后,达到平衡时测得
充入2L的密闭容器中,充分反应后,达到平衡时测得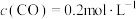 ,此时的温度是
,此时的温度是③要提高CO的转化率,可以采取的措施是
A.升温 B.恒容充入CO C.恒容充入
 D.恒压充入惰性气体 E.分离出甲醇
D.恒压充入惰性气体 E.分离出甲醇(3)毒重石的主要成分为
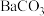 (含
(含 、
、 、
、 等杂质),实验室利用毒重石制备
等杂质),实验室利用毒重石制备 的流程如图:
的流程如图:
已知:
 ,
,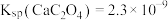 。
。 |  |  | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
 调
调 可除去
可除去 时应避免过量,原因是
时应避免过量,原因是(4)已知
 是可逆反应,设计如图装置(
是可逆反应,设计如图装置(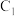 、
、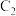 均为石墨电极)。开始时:
均为石墨电极)。开始时: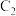 棒上电极反应为
棒上电极反应为
您最近一年使用:0次
名校
解题方法
5 . 化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)下列变化过程,属于放热反应的是_______ (填写序号)。
①浓H2SO4稀释 ②酸碱中和反应 ③食物因氧化而腐败
④固体NaOH溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原CO2
(2)标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,写出表示甲烷燃烧的热化学方程式_______ 。
(3)已知:C(石墨,s)+ O2(g)=CO2(g) ΔH1=-a kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH2=-b kJ·mol-1
O2(g)=H2O(l) ΔH2=-b kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1
写出C(石墨,s)与H2(g)反应生成CH4(g)的热化学方程式_______ 。
(4)某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
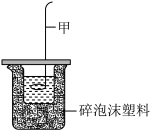
I.实验步骤:
①量取50mL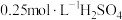 溶液,倒入小烧杯中,测量温度;
溶液,倒入小烧杯中,测量温度;
②量取50mL NaOH溶液,测量温度;
NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
II.实验数据如下:
请回答下列问题:
①仪器甲的名称为_______ ,进行该实验还缺少的仪器为_______ (填仪器名称)。仪器甲不能用铁制材料的原因是_______ 。
②设实验所用的酸、碱溶液的密度均为 ,且酸、碱中和后的溶液的比热容
,且酸、碱中和后的溶液的比热容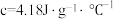 。计算该实验中生成 1mol 水时的反应热
。计算该实验中生成 1mol 水时的反应热
_______  (保留一位小数)
(保留一位小数)
③若改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与(1)中实验相比,所放出的热量_______ (填写“相等”或“不相等”);若用50mL0.50mol•L-1CH3COOH溶液代替盐酸进行(1)中实验,测得反应前后温度的变化值_______ (填写“偏大”、“偏小”或“不变”)。
(1)下列变化过程,属于放热反应的是
①浓H2SO4稀释 ②酸碱中和反应 ③食物因氧化而腐败
④固体NaOH溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原CO2
(2)标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,写出表示甲烷燃烧的热化学方程式
(3)已知:C(石墨,s)+ O2(g)=CO2(g) ΔH1=-a kJ·mol-1
H2(g)+
 O2(g)=H2O(l) ΔH2=-b kJ·mol-1
O2(g)=H2O(l) ΔH2=-b kJ·mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1
写出C(石墨,s)与H2(g)反应生成CH4(g)的热化学方程式
(4)某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。

I.实验步骤:
①量取50mL
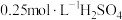 溶液,倒入小烧杯中,测量温度;
溶液,倒入小烧杯中,测量温度;②量取50mL
 NaOH溶液,测量温度;
NaOH溶液,测量温度;③将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
II.实验数据如下:
| 实验序号 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | ||
 溶液 溶液 | NaOH溶液 | 平均值 | ||
| 1 | 25.0 | 25.2 | 28.5 | |
| 2 | 24.9 | 25.1 | 28.4 | |
| 3 | 25.5 | 26.5 | 31.8 | |
①仪器甲的名称为
②设实验所用的酸、碱溶液的密度均为
 ,且酸、碱中和后的溶液的比热容
,且酸、碱中和后的溶液的比热容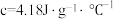 。计算该实验中生成 1mol 水时的反应热
。计算该实验中生成 1mol 水时的反应热
 (保留一位小数)
(保留一位小数)③若改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与(1)中实验相比,所放出的热量
您最近一年使用:0次
2023-03-19更新
|
429次组卷
|
2卷引用:湖北省武汉市武钢三中2022-2023学年高一下学期3月月考化学试题
名校
解题方法
6 .  的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少
的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少 的排放。回答下列问题:
的排放。回答下列问题:
(1) 还原法:
还原法:
已知: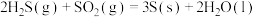
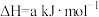 ;
; 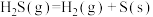
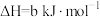 。
。
则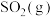 和
和 反应生成
反应生成 和
和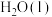 的热化学方程式为
的热化学方程式为_______ 。
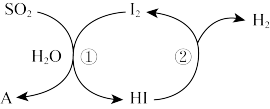
(2)碘循环法的循环过程如图所示,反应①的化学方程式为_______ ,在整个循环系统中做催化剂的物质是_______ (填化学式)。
(3)钠碱循环法:用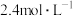 的
的 溶液吸收尾气中的
溶液吸收尾气中的 。
。
①上述 溶液中:
溶液中: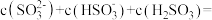
_______  ;
;
_______ 。
②室温下,当溶液的pH约为6时, 溶液吸收
溶液吸收 能力显著下降,此时溶液中
能力显著下降,此时溶液中 的浓度是
的浓度是 ,则此时溶液中各离子浓度由大到小的顺序为
,则此时溶液中各离子浓度由大到小的顺序为_______ 。
(4)氨石灰水法:
第一步:用过量的浓氨水吸收 ,并在空气中氧化;
,并在空气中氧化;
第二步:加入澄清石灰水。
已知:室温下,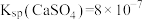 ,
,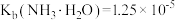 ,则室温下,第二步反应:
,则室温下,第二步反应: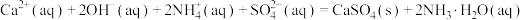 的平衡常数
的平衡常数
_______ 。
 的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少
的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少 的排放。回答下列问题:
的排放。回答下列问题:(1)
 还原法:
还原法:已知:
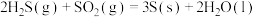
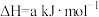 ;
; 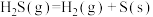
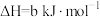 。
。则
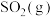 和
和 反应生成
反应生成 和
和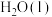 的热化学方程式为
的热化学方程式为(2)碘循环法的循环过程如图所示,反应①的化学方程式为

(3)钠碱循环法:用
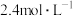 的
的 溶液吸收尾气中的
溶液吸收尾气中的 。
。①上述
 溶液中:
溶液中: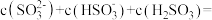
 ;
;
②室温下,当溶液的pH约为6时,
 溶液吸收
溶液吸收 能力显著下降,此时溶液中
能力显著下降,此时溶液中 的浓度是
的浓度是 ,则此时溶液中各离子浓度由大到小的顺序为
,则此时溶液中各离子浓度由大到小的顺序为(4)氨石灰水法:
第一步:用过量的浓氨水吸收
 ,并在空气中氧化;
,并在空气中氧化;第二步:加入澄清石灰水。
已知:室温下,
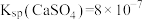 ,
,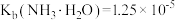 ,则室温下,第二步反应:
,则室温下,第二步反应: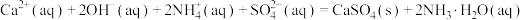 的平衡常数
的平衡常数
您最近一年使用:0次
2023-01-15更新
|
141次组卷
|
4卷引用:湖北省恩施土家族苗族自治州巴东县2022-2023学年高二下学期6月月考化学试题
名校
解题方法
7 . 工业上合成氨工艺流程一般分三步:第一步为原料气的制备,将天然气等原料制成含氢和氮的粗原料气;第二步为净化,主要包括变换过程、脱硫脱碳过程以及气体精制过程;第三步为氨合成,将纯净的氢氮混合气压缩,增大压强,在催化剂的作用下合成氨。
(1)“一次转化”过程中 气体与水蒸气反应转化为CO和
气体与水蒸气反应转化为CO和 混合气体,已知几种物质的燃烧热如表所示:
混合气体,已知几种物质的燃烧热如表所示:
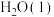 的汽化热为
的汽化热为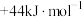 ,则“一次转化”过程中生成CO的热化学方程式为
,则“一次转化”过程中生成CO的热化学方程式为______ 。
(2)“二步净化”过程中,原料 、
、 需要经过铜氨液处理净化,除去其中的CO,其反应为:
需要经过铜氨液处理净化,除去其中的CO,其反应为:
 ,铜氨液吸收CO适宜的生产条件是
,铜氨液吸收CO适宜的生产条件是______ (填字母)。
a.低温高压 b.高温高压 c.高温低压 d.低温低压
(3)第三步为氨合成,生产流程示意图如下。已知:
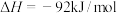
①上述流程中有利于提高原料利用率的措施有______ (请写出两点);
②有利于提高单位时间内氨的产率的措施有______ (请写出两点)。
(4)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,向1L密闭容器中充入1mol 和3mol
和3mol ,不同温度(
,不同温度( )、不同压强下,达平衡时混合物中
)、不同压强下,达平衡时混合物中 的物质的量分数的变化情况。
的物质的量分数的变化情况。
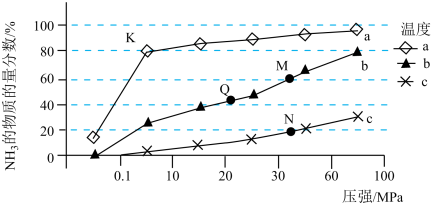
①曲线a对应的温度是______ ;
②M、N、Q点平衡常数的大小关系是______ ;K点的平衡常数为______ ;
③K点达平衡后再向容器中充入1mol 和2mol
和2mol ,平衡将
,平衡将______ (填“正向移动”、“逆向移动”或“不移动”)。
(1)“一次转化”过程中
 气体与水蒸气反应转化为CO和
气体与水蒸气反应转化为CO和 混合气体,已知几种物质的燃烧热如表所示:
混合气体,已知几种物质的燃烧热如表所示:物质 |
|
|
|
|
燃烧热 | -285.5 | -890.3 | -283 | -393.5 |
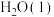 的汽化热为
的汽化热为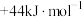 ,则“一次转化”过程中生成CO的热化学方程式为
,则“一次转化”过程中生成CO的热化学方程式为(2)“二步净化”过程中,原料
 、
、 需要经过铜氨液处理净化,除去其中的CO,其反应为:
需要经过铜氨液处理净化,除去其中的CO,其反应为:
 ,铜氨液吸收CO适宜的生产条件是
,铜氨液吸收CO适宜的生产条件是a.低温高压 b.高温高压 c.高温低压 d.低温低压
(3)第三步为氨合成,生产流程示意图如下。已知:

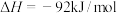

①上述流程中有利于提高原料利用率的措施有
②有利于提高单位时间内氨的产率的措施有
(4)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,向1L密闭容器中充入1mol
 和3mol
和3mol ,不同温度(
,不同温度(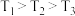 )、不同压强下,达平衡时混合物中
)、不同压强下,达平衡时混合物中 的物质的量分数的变化情况。
的物质的量分数的变化情况。
①曲线a对应的温度是
②M、N、Q点平衡常数的大小关系是
③K点达平衡后再向容器中充入1mol
 和2mol
和2mol ,平衡将
,平衡将
您最近一年使用:0次
2023-01-13更新
|
284次组卷
|
2卷引用:湖北省孝感市重点高中教科研协作体2023-2024学年高二上学期开学考试化学试题
名校
解题方法
8 . 诺贝尔化学奖获得者GeorgeA.Olah提出了“甲醇经济”的概念,他建议用甲醇来代替目前广泛使用的化石燃料。工业上用天然气为原料,分为两个阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH=-90.67 kJ·mol-1
CH3OH(g) ΔH=-90.67 kJ·mol-1
回答下列问题:
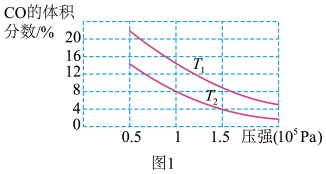
(1)制备合成气反应中,平衡混合物中CO的体积分数与压强的关系如图1所示,判断T1和T2的大小关系:T1_______ T2(填“<”或“=”),理由是_______ 。
(2)工业生产中为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为_______ 。
(3)在体积不变的密闭容器中投入0.5 mol CO和1 mol H2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
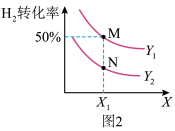
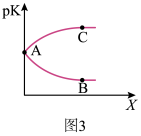
①图2中X代表_______ (填“温度”或“压强”)。图3中正确表示该反应的平衡常数的负对数pK(pK=-lgK)与X的关系的曲线_______ (填“AC”或“AB”)。
②若图2中M点对应的容器体积为5 L,此时容器的压强为b kPa,则N点的压强平衡常数Kp为_______ 。
(4)为节约化石能源,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成甲醇和水蒸气的热化学方程式为_______ 。
②研究表明在二氧化碳合成甲醇的原料气中加入CO可以降低CO2与H2反应的活化能。在200~360℃、9MPa时,合成气初始组成H2、CO、CO2物质的量之比为7:2:1的条件下研究甲醇的合成反应(如图所示)。
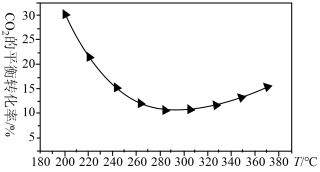
CO2的平衡转化率随温度的升高先减小后增大,请分析可能的原因_______ 。
(i)制备合成气:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1(ii)合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.67 kJ·mol-1
CH3OH(g) ΔH=-90.67 kJ·mol-1回答下列问题:
(1)制备合成气反应中,平衡混合物中CO的体积分数与压强的关系如图1所示,判断T1和T2的大小关系:T1

(2)工业生产中为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为(3)在体积不变的密闭容器中投入0.5 mol CO和1 mol H2,不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
①图2中X代表

②若图2中M点对应的容器体积为5 L,此时容器的压强为b kPa,则N点的压强平衡常数Kp为
(4)为节约化石能源,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成甲醇和水蒸气的热化学方程式为
②研究表明在二氧化碳合成甲醇的原料气中加入CO可以降低CO2与H2反应的活化能。在200~360℃、9MPa时,合成气初始组成H2、CO、CO2物质的量之比为7:2:1的条件下研究甲醇的合成反应(如图所示)。

CO2的平衡转化率随温度的升高先减小后增大,请分析可能的原因
您最近一年使用:0次
2023-01-12更新
|
137次组卷
|
3卷引用:湖北省部分重点中学2023届高三上学期第二次联考化学试题
解题方法
9 . 氮的氧化物、硫的氧化物是主要的大气污染物,对这些有害气体的治理及合理利用显得尤为重要。回答下列问题:
I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:
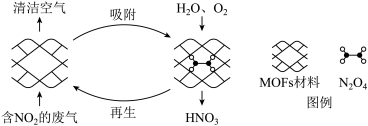
已知: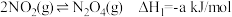

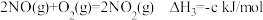
(1)请从温度和压强两个角度分析利于NO2吸附的条件_______ 。
(2)①当10 g材料吸附NO2到质量不再发生变化时,下列_______ 也能说明吸附反应已达到极限。
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=_______  。
。
(3)由N2O4转化生成HNO3的热化学反应方程式_______ 。
Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。
(4)利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.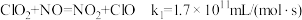
b.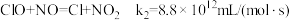
c.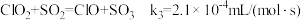
d.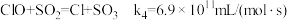
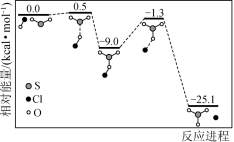
①反应d的历程如下图所示。该历程中最大活化能E正=_______ kJ/mol。
②保持其他条件不变,随着 的增加,SO2脱除效率的逐渐增加的原因是
的增加,SO2脱除效率的逐渐增加的原因是_______ 。
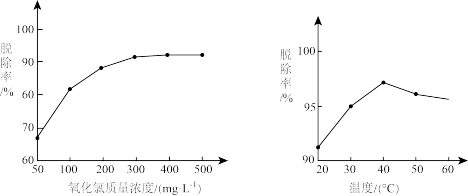
(5)利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是_______ 。
I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:

已知:

(1)请从温度和压强两个角度分析利于NO2吸附的条件
(2)①当10 g材料吸附NO2到质量不再发生变化时,下列
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=
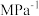 。
。(3)由N2O4转化生成HNO3的热化学反应方程式
Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。
(4)利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.
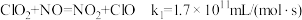
b.
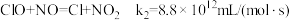
c.
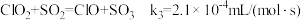
d.
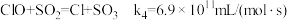
①反应d的历程如下图所示。该历程中最大活化能E正=

②保持其他条件不变,随着
 的增加,SO2脱除效率的逐渐增加的原因是
的增加,SO2脱除效率的逐渐增加的原因是(5)利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是

您最近一年使用:0次
2022-12-14更新
|
148次组卷
|
2卷引用:湖北省部分学校2022-2023学年高三上学期12月联考化学试题
解题方法
10 . 回答下列问题
(1)工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_______
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为_______ ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是_______ 。
(3)NaHSO3溶液显酸性的原因是_______ (用化学用语和必要的文字说明)。
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为_______ 。
(5)下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_______ (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液 c.加入少量醋酸钠晶体
(6)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。图中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______ 。
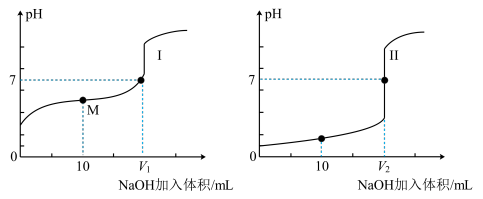
(1)工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为
(3)NaHSO3溶液显酸性的原因是
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为
(5)下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是
a.滴加少量浓盐酸 b.微热溶液 c.加入少量醋酸钠晶体
(6)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。图中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是

您最近一年使用:0次