1 . 2030年实现“碳达峰”,2060年达到“碳中和”的承诺,体现了我国的大国风范。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
二氧化碳加氢制甲醇涉及的反应可表示为:
①

②
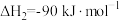
③
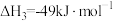
(1)根据上述反应求:④ 的
的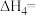
___________  。
。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
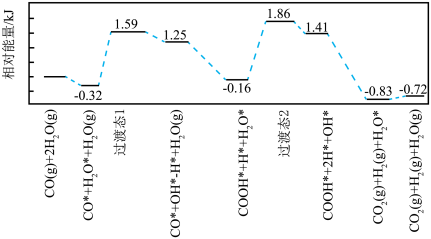
写出该历程中决速步骤的化学方程式:________ 。
(3)一体积可变的密闭容器中,在保持a MPa下,按照 投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
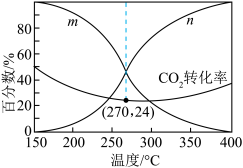
①图中m曲线代表的物质为________ 。
②下列说法正确的是________ (填标号)。
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,270℃时反应①的分压平衡常数为
,270℃时反应①的分压平衡常数为________ (保留2位有效数字)。
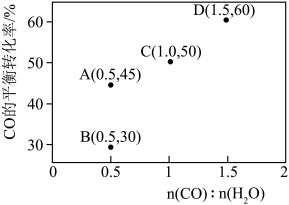
(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应 ,其速率方程为
,其速率方程为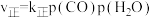 ,
,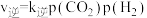 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 分别为速率常数,p为气体的分压。已知降低温度时,
分别为速率常数,p为气体的分压。已知降低温度时, 增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是
增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是________ ,在C点所示投料比下,当CO转化率达到40%时,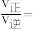
________ 。
二氧化碳加氢制甲醇涉及的反应可表示为:
①


②

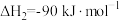
③

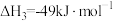
(1)根据上述反应求:④
 的
的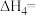
 。
。(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

写出该历程中决速步骤的化学方程式:
(3)一体积可变的密闭容器中,在保持a MPa下,按照
 投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
①图中m曲线代表的物质为
②下列说法正确的是
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,270℃时反应①的分压平衡常数为
,270℃时反应①的分压平衡常数为(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应
 ,其速率方程为
,其速率方程为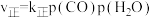 ,
,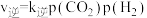 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 分别为速率常数,p为气体的分压。已知降低温度时,
分别为速率常数,p为气体的分压。已知降低温度时, 增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是
增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是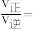

您最近一年使用:0次
2023-06-29更新
|
389次组卷
|
2卷引用:湖北省咸宁市2022-2023学年高二下学期期末考试化学试题
2 . 石油化工、煤气化等行业废气普遍含有 ,需要回收处理并加以利用。回答下列问题:
,需要回收处理并加以利用。回答下列问题:
已知:反应Ⅰ: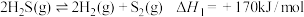
反应II: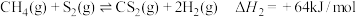
反应Ⅲ: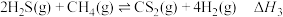
(1)
___________ 。
(2)在总压强为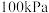 条件下,
条件下,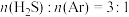 的混合气在不同温度下发生反应I,反应相同时间后测得
的混合气在不同温度下发生反应I,反应相同时间后测得 的体积分数及
的体积分数及 在不同温度下的平衡体积分数如下图所示:
在不同温度下的平衡体积分数如下图所示:

①从平衡移动的角度判断,通入Ar稀释的目的是___________ 。
②图中表示平衡状态的曲线为___________ (填“a”或“b”)。某温度下,平衡时 的体积分数为20%,则该反应的平衡常数
的体积分数为20%,则该反应的平衡常数
___________  。
。
(3)按体积比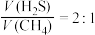 投料,压强恒定,在不同温度下反应相同时间后测得
投料,压强恒定,在不同温度下反应相同时间后测得 和
和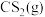 的体积分数如下表:
的体积分数如下表:
试解释在950~1150℃内(其他条件不变),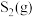 的体积分数随温度升高先增大后减小的原因是
的体积分数随温度升高先增大后减小的原因是___________ 。
(4) 可用于处理工业废水中的重金属离子(如:
可用于处理工业废水中的重金属离子(如: 、
、 、
、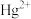 等)
等)
已知反应IV: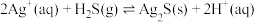
①温度为T时,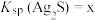 ,则
,则 饱和溶液中
饱和溶液中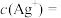
___________ 。
②下列关于反应IV及相关物质的说法正确的是___________ 。
A.纯银器表面生成 属于电化学腐蚀
属于电化学腐蚀
B.将 从反应IV体系中及时分离出去有利于该反应平衡右移
从反应IV体系中及时分离出去有利于该反应平衡右移
C.适当增大压强有利于反应IV平衡右移
D.反应IV能够自发进行说明该反应
 ,需要回收处理并加以利用。回答下列问题:
,需要回收处理并加以利用。回答下列问题:已知:反应Ⅰ:
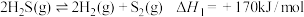
反应II:
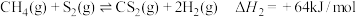
反应Ⅲ:
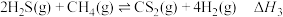
(1)

(2)在总压强为
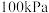 条件下,
条件下,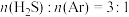 的混合气在不同温度下发生反应I,反应相同时间后测得
的混合气在不同温度下发生反应I,反应相同时间后测得 的体积分数及
的体积分数及 在不同温度下的平衡体积分数如下图所示:
在不同温度下的平衡体积分数如下图所示:
①从平衡移动的角度判断,通入Ar稀释的目的是
②图中表示平衡状态的曲线为
 的体积分数为20%,则该反应的平衡常数
的体积分数为20%,则该反应的平衡常数
 。
。(3)按体积比
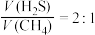 投料,压强恒定,在不同温度下反应相同时间后测得
投料,压强恒定,在不同温度下反应相同时间后测得 和
和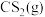 的体积分数如下表:
的体积分数如下表:| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
 的体积分数/% 的体积分数/% | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
 的体积分数/% 的体积分数/% | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
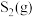 的体积分数随温度升高先增大后减小的原因是
的体积分数随温度升高先增大后减小的原因是(4)
 可用于处理工业废水中的重金属离子(如:
可用于处理工业废水中的重金属离子(如: 、
、 、
、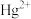 等)
等)已知反应IV:
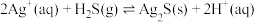
①温度为T时,
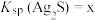 ,则
,则 饱和溶液中
饱和溶液中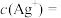
②下列关于反应IV及相关物质的说法正确的是
A.纯银器表面生成
 属于电化学腐蚀
属于电化学腐蚀B.将
 从反应IV体系中及时分离出去有利于该反应平衡右移
从反应IV体系中及时分离出去有利于该反应平衡右移C.适当增大压强有利于反应IV平衡右移
D.反应IV能够自发进行说明该反应

您最近一年使用:0次
3 . 低碳烯烃是基础有机化工原料,工业上可利用合成气直接或间接制取。主要反应方程式如下。
间接制取低碳烯烃:CO(g)+2H2(g) CH3OH(l) △H1=-116kJ•mol-1
CH3OH(l) △H1=-116kJ•mol-1
2CH3OH(l) C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
直接制取低碳烯烃:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H3
C2H4(g)+2H2O(g) △H3
回答下列问题:
(1)已知H2O(g) H2O(l) △H=-44kJ•mol-1,则△H3=
H2O(l) △H=-44kJ•mol-1,则△H3=______ kJ/mol。
(2)将N2、CO和H2以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图1所示,则P1______ P2(填“>”“<”或“=”),M点的正反应速率______ N点的逆反应速率(填“>”“<”或“=”)。在500K,压强为P1的条件下,该反应的Kp=______ (列出计算式)。
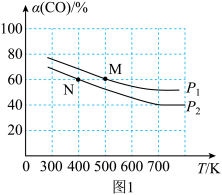
(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,n(CO):n(H2)为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性=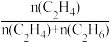 ×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是______ 。
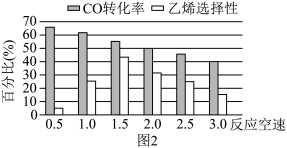
(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒越小,催化效果越好,其理由是______ 。
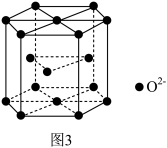
(5)Ga2O3是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值为NA,则Ga2O3晶体的摩尔体积Vm=______ m3/mol。
间接制取低碳烯烃:CO(g)+2H2(g)
 CH3OH(l) △H1=-116kJ•mol-1
CH3OH(l) △H1=-116kJ•mol-12CH3OH(l)
 C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
C2H4(g)+2H2O(l) △H2=-35kJ•mol-1直接制取低碳烯烃:2CO(g)+4H2(g)
 C2H4(g)+2H2O(g) △H3
C2H4(g)+2H2O(g) △H3回答下列问题:
(1)已知H2O(g)
 H2O(l) △H=-44kJ•mol-1,则△H3=
H2O(l) △H=-44kJ•mol-1,则△H3=(2)将N2、CO和H2以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图1所示,则P1

(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,n(CO):n(H2)为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性=
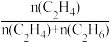 ×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒越小,催化效果越好,其理由是
(5)Ga2O3是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值为NA,则Ga2O3晶体的摩尔体积Vm=

您最近一年使用:0次
解题方法
4 . 党的二十大报告中指出:积极稳妥推进碳达峰碳中和,立足我国能源资源禀赋,坚持先立后破,有计划分步骤实施碳达峰行动。因此CO2的捕集和利用成了研究的重点。
(1)一种从空气中捕获CO2的转化原理如图所示。
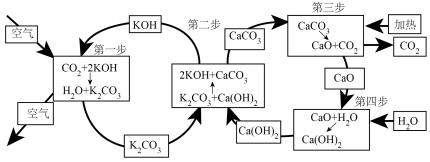
已知图中涉及的四步反应中,△H1=-193.7kJ•mol-1、△H3=+179.2kJ•mol-1、△H4=-64.5kJ•mol-1,则△H2=_____ kJ•mol-1。(四步反应中相同物质的状态相同)
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。T1℃时,在体积为10L的恒温恒容的密闭容器中充入等物质的量的CH4(g)和CO2(g),同时进行反应:
I.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
II.CO(g)+3H2(g) CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
体系中各组分的物质的量随时间的变化如图所示,H2O(g)的物质的量变化情况如曲线D所示。
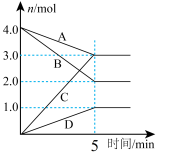
①图中表示两种组分的是曲线_____ (填标号),曲线B表示的物质为_____ (填化学式)。
②CH4-CO2催化重整的目的主要是获得更多的合成气(CO和H2),则反应I更适宜的条件是_____ (填标号)。
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
③T1℃时,用CH4表示从开始到5min时的平均反应速率v(CH4)=_____ mol•L-1•min-1。反应I的平衡常数K=_____ 。
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图3所示。a极为_____ (填“阴极”或“阳极”),写出b极上参加反应的CO2和H2O(物质的量比1:1)发生的电极反应:_____ 。

(1)一种从空气中捕获CO2的转化原理如图所示。

已知图中涉及的四步反应中,△H1=-193.7kJ•mol-1、△H3=+179.2kJ•mol-1、△H4=-64.5kJ•mol-1,则△H2=
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。T1℃时,在体积为10L的恒温恒容的密闭容器中充入等物质的量的CH4(g)和CO2(g),同时进行反应:
I.CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
2CO(g)+2H2(g) △H=+246.9kJ•mol-1;II.CO(g)+3H2(g)
 CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
CH4(g)+H2O(g) △H=-205.7kJ•mol-1。体系中各组分的物质的量随时间的变化如图所示,H2O(g)的物质的量变化情况如曲线D所示。

①图中表示两种组分的是曲线
②CH4-CO2催化重整的目的主要是获得更多的合成气(CO和H2),则反应I更适宜的条件是
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
③T1℃时,用CH4表示从开始到5min时的平均反应速率v(CH4)=
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图3所示。a极为

您最近一年使用:0次
2023-05-25更新
|
52次组卷
|
2卷引用:湖北省孝感市部分学校2022-2023学年高二下学期5月联考化学试题
解题方法
5 . 氨的用途十分广泛,是现代工业、农业生产最基础的化工原料之一。
I.以氨为原料可生产尿素:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
①2NH3(g)+CO2(g) NH2COONH4(l) ΔH1=−117kJ·mol−1
NH2COONH4(l) ΔH1=−117kJ·mol−1
②NH2COONH4(l) CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
(1)生产尿素的决速步骤是第二步,可判断活化能较小的是_______ (填“①”或“②”)。
(2)总反应的ΔH=_______ 。
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
(3)上述反应在常温下_______ (填“能”或“不能”)自发进行。
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______(填标号)。
(5)科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入6mol N2和10mol H2,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
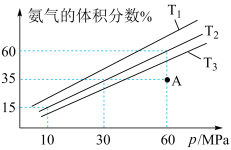
①T1、T2、T3由小到大的顺序为_______ 。
②在T2、60MPa条件下,平衡时N2的转化率为_______ %;平衡常数Kp=_______ (保留两位有效数字)。(用平衡分压代替平衡浓度,分压=总压x物质的量分数)
I.以氨为原料可生产尿素:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:①2NH3(g)+CO2(g)
 NH2COONH4(l) ΔH1=−117kJ·mol−1
NH2COONH4(l) ΔH1=−117kJ·mol−1②NH2COONH4(l)
 CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1(1)生产尿素的决速步骤是第二步,可判断活化能较小的是
(2)总反应的ΔH=
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1(3)上述反应在常温下
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______(填标号)。
| A.容器内气体的平均摩尔质量不变 | B.N2的体积分数不变 |
| C.混合气体的颜色不再改变 | D.3v正(NH3)=2v逆(H2) |

①T1、T2、T3由小到大的顺序为
②在T2、60MPa条件下,平衡时N2的转化率为
您最近一年使用:0次
解题方法
6 .  的资源化利用有利于碳中和目标的实现。回答下列问题:
的资源化利用有利于碳中和目标的实现。回答下列问题:
(1)将 催化加氢转化为
催化加氢转化为 是资源化利用的途径之一,适当温度下,在催化剂存在的
是资源化利用的途径之一,适当温度下,在催化剂存在的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:
ⅰ.
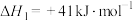

ⅱ.
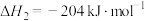

ⅲ.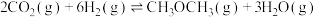


①
___________  ,
,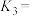
___________ (用含 、
、 的式子表示)。
的式子表示)。
②将1mol 、3mol
、3mol  充入2L的刚性容器中,测得反应进行到10min时,
充入2L的刚性容器中,测得反应进行到10min时, 的转化率与催化剂(X、Y、Z)、温度(T)间关系如图所示:
的转化率与催化剂(X、Y、Z)、温度(T)间关系如图所示:
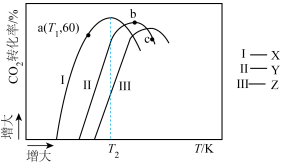
则三种催化剂条件下的反应中, 温度下活化能最小的是
温度下活化能最小的是___________ (填“Ⅰ”、“Ⅱ”、“Ⅲ”),a点对应反应的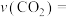
________  ;转化率
;转化率 的原因可能是
的原因可能是_______ (填选项字母)。
A.b点平衡后升温平衡逆向移动
B.温度过高导致催化剂Y催化活性降低,c点时反应还没有达到平衡
C.b点不是平衡态c点是平衡态
(2) 与
与 也可用于制备甲醇:
也可用于制备甲醇: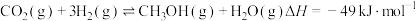 。TK时,向压强为9MPa的恒压容器中充入3mol
。TK时,向压强为9MPa的恒压容器中充入3mol  和7mol
和7mol  ,达到平衡时,
,达到平衡时, 的体积分数为
的体积分数为 。
。
①写出能提高 产率的两种方法:
产率的两种方法:___________ 。
② 和
和 的平衡转化率之比为
的平衡转化率之比为___________ ;TK时,该反应的平衡常数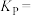
___________ 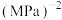 (以分压表示,分压=总压×气体物质的量分数,保留两位有效数字)。
(以分压表示,分压=总压×气体物质的量分数,保留两位有效数字)。
 的资源化利用有利于碳中和目标的实现。回答下列问题:
的资源化利用有利于碳中和目标的实现。回答下列问题:(1)将
 催化加氢转化为
催化加氢转化为 是资源化利用的途径之一,适当温度下,在催化剂存在的
是资源化利用的途径之一,适当温度下,在催化剂存在的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:ⅰ.

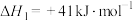

ⅱ.

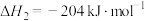

ⅲ.
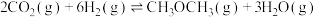


①

 ,
,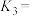
 、
、 的式子表示)。
的式子表示)。②将1mol
 、3mol
、3mol  充入2L的刚性容器中,测得反应进行到10min时,
充入2L的刚性容器中,测得反应进行到10min时, 的转化率与催化剂(X、Y、Z)、温度(T)间关系如图所示:
的转化率与催化剂(X、Y、Z)、温度(T)间关系如图所示:
则三种催化剂条件下的反应中,
 温度下活化能最小的是
温度下活化能最小的是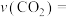
 ;转化率
;转化率 的原因可能是
的原因可能是A.b点平衡后升温平衡逆向移动
B.温度过高导致催化剂Y催化活性降低,c点时反应还没有达到平衡
C.b点不是平衡态c点是平衡态
(2)
 与
与 也可用于制备甲醇:
也可用于制备甲醇: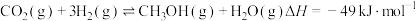 。TK时,向压强为9MPa的恒压容器中充入3mol
。TK时,向压强为9MPa的恒压容器中充入3mol  和7mol
和7mol  ,达到平衡时,
,达到平衡时, 的体积分数为
的体积分数为 。
。①写出能提高
 产率的两种方法:
产率的两种方法:②
 和
和 的平衡转化率之比为
的平衡转化率之比为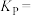
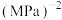 (以分压表示,分压=总压×气体物质的量分数,保留两位有效数字)。
(以分压表示,分压=总压×气体物质的量分数,保留两位有效数字)。
您最近一年使用:0次
2023·全国·模拟预测
7 . 油气开采、石油化工、煤化工等行业产生的废气普遍含有硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①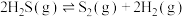
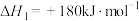
②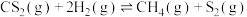
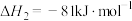
则反应③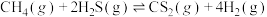 的
的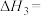
___________  :下列叙述中能说明反应③达到平衡状态的是
:下列叙述中能说明反应③达到平衡状态的是___________ (填字母)。
A.断裂2molC—H的同时生成1molC=S B.恒容条件下,体系压强不再变化
C.恒容条件下,气体的密度不再变化 D.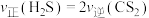
(2)对于上述反应①,在不同温度、压强为100kPa、进料 的物质的量分数为0.1%~20%(其余为Ar)的条件下,
的物质的量分数为0.1%~20%(其余为Ar)的条件下, 的平衡转化率如图1所示。
的平衡转化率如图1所示。 、
、 和
和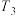 的大小关系为
的大小关系为___________ ; 的物质的量分数越大,
的物质的量分数越大, 的平衡转化率越小的原因是
的平衡转化率越小的原因是___________ 。
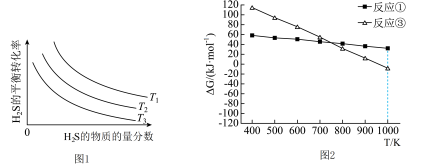
(3)上述反应①和③的 随温度的变化如图2所示,已知
随温度的变化如图2所示,已知 (R为常数,T为温度,K为平衡常数),则在1000K时,反应的自发趋势:①
(R为常数,T为温度,K为平衡常数),则在1000K时,反应的自发趋势:①___________ ③(选填“>”“<”或“=”)。在1000K、100kPa条件下, 的混合气发生反应,达到平衡时
的混合气发生反应,达到平衡时 ,
, 接近于0,其原因是
接近于0,其原因是___________ 。
(4)在1000K、100kPa条件下,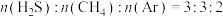 的混合气发生反应,上述反应③达到平衡时,
的混合气发生反应,上述反应③达到平衡时, 的分压与
的分压与 的分压相同。则反应③的
的分压相同。则反应③的
___________ 。
(1)已知下列反应的热化学方程式:
①
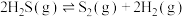
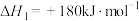
②
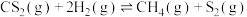
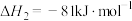
则反应③
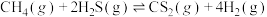 的
的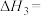
 :下列叙述中能说明反应③达到平衡状态的是
:下列叙述中能说明反应③达到平衡状态的是A.断裂2molC—H的同时生成1molC=S B.恒容条件下,体系压强不再变化
C.恒容条件下,气体的密度不再变化 D.
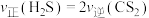
(2)对于上述反应①,在不同温度、压强为100kPa、进料
 的物质的量分数为0.1%~20%(其余为Ar)的条件下,
的物质的量分数为0.1%~20%(其余为Ar)的条件下, 的平衡转化率如图1所示。
的平衡转化率如图1所示。 、
、 和
和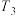 的大小关系为
的大小关系为 的物质的量分数越大,
的物质的量分数越大, 的平衡转化率越小的原因是
的平衡转化率越小的原因是
(3)上述反应①和③的
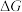 随温度的变化如图2所示,已知
随温度的变化如图2所示,已知 (R为常数,T为温度,K为平衡常数),则在1000K时,反应的自发趋势:①
(R为常数,T为温度,K为平衡常数),则在1000K时,反应的自发趋势:①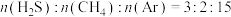 的混合气发生反应,达到平衡时
的混合气发生反应,达到平衡时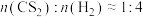 ,
, 接近于0,其原因是
接近于0,其原因是(4)在1000K、100kPa条件下,
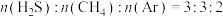 的混合气发生反应,上述反应③达到平衡时,
的混合气发生反应,上述反应③达到平衡时, 的分压与
的分压与 的分压相同。则反应③的
的分压相同。则反应③的
您最近一年使用:0次
2023-05-08更新
|
825次组卷
|
6卷引用:湖北省名校2023届高三下学期5月适应性考试化学试题
湖北省名校2023届高三下学期5月适应性考试化学试题(已下线)全国卷(老教材)理综化学预测卷福建省泉州第五中学2023届高三一模化学试题(已下线)T7-物质结构与性质(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
8 . 对 和
和 的高效利用不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。
的高效利用不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。 临氧耦合
临氧耦合 重整的反应有:
重整的反应有:
反应I:
反应II: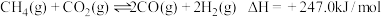
(1)写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:_______ 。
(2)在两个体积均为 的恒容密闭容器中,起始时按表中相应的量加入物质。在相同温度下进行反应II:
的恒容密闭容器中,起始时按表中相应的量加入物质。在相同温度下进行反应II: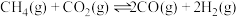 (不发生其他反应),
(不发生其他反应), 的平衡转化率如表所示。
的平衡转化率如表所示。
①下列条件能说明反应达到平衡状态的是_______ (填标号)。
A.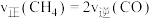
B.容器内各物质的浓度满足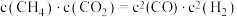
C.容器内混合气体的总压强不再变化
D.容器内混合气体的密度保持不变
②达到平衡时,容器X、Y内 的物质的量关系满足
的物质的量关系满足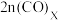
_______ 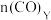 (填“>”,“<”或“=”)
(填“>”,“<”或“=”)
(3) 还可以通过催化加氢合成乙醇:
还可以通过催化加氢合成乙醇: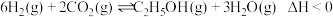 。设m为起始时的投料比,即
。设m为起始时的投料比,即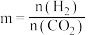 。通过实验得到下列图像:
。通过实验得到下列图像:
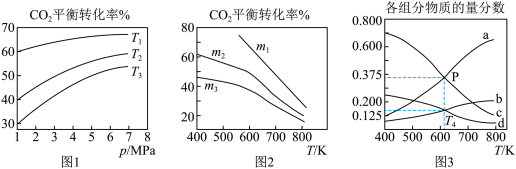
①若图1中m相同,则温度从高到低排序为_______ 。
②图2中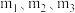 从大到小排序为
从大到小排序为_______ 。
③图3表示在总压为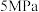 的恒压条件下,
的恒压条件下, 时,平衡状态各物质的物质的量分数与温度的关系,则d曲线表示的是
时,平衡状态各物质的物质的量分数与温度的关系,则d曲线表示的是_______ 的物质的量分数。
④由图3可得, 温度下,该反应压强平衡常数
温度下,该反应压强平衡常数 的计算式为
的计算式为_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,带入数据,不用计算)
 和
和 的高效利用不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。
的高效利用不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。 临氧耦合
临氧耦合 重整的反应有:
重整的反应有:反应I:

反应II:
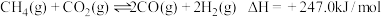
(1)写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式:(2)在两个体积均为
 的恒容密闭容器中,起始时按表中相应的量加入物质。在相同温度下进行反应II:
的恒容密闭容器中,起始时按表中相应的量加入物质。在相同温度下进行反应II: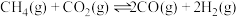 (不发生其他反应),
(不发生其他反应), 的平衡转化率如表所示。
的平衡转化率如表所示。| 容器 | 起始物质的量/ |  的平衡转化率 的平衡转化率 | |||
 |  |  |  | ||
| X | 0.1 | 0.1 | 0 | 0 | 50% |
| Y | 0.1 | 0.1 | 0.2 | 0.2 | — |
A.
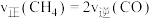
B.容器内各物质的浓度满足
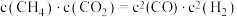
C.容器内混合气体的总压强不再变化
D.容器内混合气体的密度保持不变
②达到平衡时,容器X、Y内
 的物质的量关系满足
的物质的量关系满足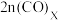
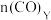 (填“>”,“<”或“=”)
(填“>”,“<”或“=”)(3)
 还可以通过催化加氢合成乙醇:
还可以通过催化加氢合成乙醇: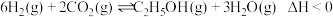 。设m为起始时的投料比,即
。设m为起始时的投料比,即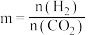 。通过实验得到下列图像:
。通过实验得到下列图像:
①若图1中m相同,则温度从高到低排序为
②图2中
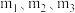 从大到小排序为
从大到小排序为③图3表示在总压为
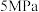 的恒压条件下,
的恒压条件下, 时,平衡状态各物质的物质的量分数与温度的关系,则d曲线表示的是
时,平衡状态各物质的物质的量分数与温度的关系,则d曲线表示的是④由图3可得,
 温度下,该反应压强平衡常数
温度下,该反应压强平衡常数 的计算式为
的计算式为
您最近一年使用:0次
2023-05-04更新
|
506次组卷
|
2卷引用:湖北省武汉市重点中学4G+联合体2022-2023学年高二上学期1月期末考试化学试题
9 . 烟气中的主要污染物是 、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
Ⅰ.烟气经 预处理后用
预处理后用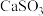 水悬浮液吸收,可减少烟气中
水悬浮液吸收,可减少烟气中 、NO的含量。
、NO的含量。
 氧化烟气中
氧化烟气中 、
、 ,的主要反应的热化学方程式为:
,的主要反应的热化学方程式为:
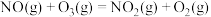
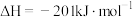
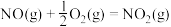
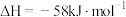
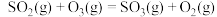
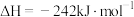
(1)反应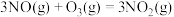 的
的
___________  。
。
(2)室温下,固定进入反应器的NO、 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中n(NO)、n(
的物质的量,反应一段时间后体系中n(NO)、n( )和n(
)和n( )随反应前n(
)随反应前n( ):n(NO)的变化见图:
):n(NO)的变化见图:
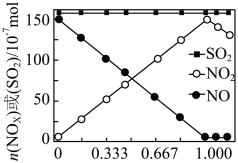
当n( ):n(NO)
):n(NO)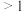 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是___________ ;增加n( ),
), 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是___________ 。
(3)当用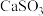 水悬浮液吸收经
水悬浮液吸收经 预处理的烟气时,清液(pH约为8)中
预处理的烟气时,清液(pH约为8)中 将
将 转化为
转化为 ,其离子方程式为
,其离子方程式为___________ 。
Ⅱ.NaClO溶液在不同温度下也可对烟气中的硫、硝脱除,一定时间内,其脱除率如下图所示。
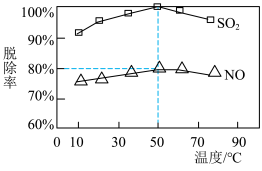
(4)烟气中 和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n(
和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n( ):n(
):n( )
)
___________ 。
Ⅲ.可利用CO为还原剂在催化剂作用下将NO脱除并转化为 和
和 。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
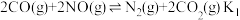

(5)下述情况能说明反应体系已达到平衡的是___________ 。
a.CO与NO转化率之比不再改变 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不变 d.v(CO):v( )
)
(6)若达到平衡时NO的转化率为80%, 的选择性为60%,则
的选择性为60%,则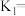
___________ 。( 的选择性
的选择性 )
)
 、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:Ⅰ.烟气经
 预处理后用
预处理后用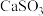 水悬浮液吸收,可减少烟气中
水悬浮液吸收,可减少烟气中 、NO的含量。
、NO的含量。 氧化烟气中
氧化烟气中 、
、 ,的主要反应的热化学方程式为:
,的主要反应的热化学方程式为: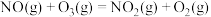
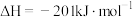
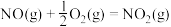
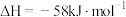
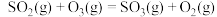
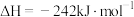
(1)反应
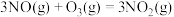 的
的
 。
。(2)室温下,固定进入反应器的NO、
 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中n(NO)、n(
的物质的量,反应一段时间后体系中n(NO)、n( )和n(
)和n( )随反应前n(
)随反应前n( ):n(NO)的变化见图:
):n(NO)的变化见图:
当n(
 ):n(NO)
):n(NO)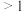 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是 ),
), 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是(3)当用
 水悬浮液吸收经
水悬浮液吸收经 预处理的烟气时,清液(pH约为8)中
预处理的烟气时,清液(pH约为8)中 将
将 转化为
转化为 ,其离子方程式为
,其离子方程式为Ⅱ.NaClO溶液在不同温度下也可对烟气中的硫、硝脱除,一定时间内,其脱除率如下图所示。

(4)烟气中
 和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n(
和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n( ):n(
):n( )
)
Ⅲ.可利用CO为还原剂在催化剂作用下将NO脱除并转化为
 和
和 。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下: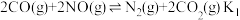

(5)下述情况能说明反应体系已达到平衡的是
a.CO与NO转化率之比不再改变 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不变 d.v(CO):v(
 )
)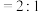
(6)若达到平衡时NO的转化率为80%,
 的选择性为60%,则
的选择性为60%,则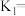
 的选择性
的选择性 )
)
您最近一年使用:0次
名校
10 . 甲烷在化学工业中应用广泛。回答下列问题:
(1) 捕集
捕集 合成
合成 涉及下列反应:
涉及下列反应:
Ⅰ.
 平衡常数
平衡常数
Ⅱ.
 平衡常数
平衡常数
①相关物质相对能量大小如图所示,则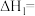
_______  ,升高温度,
,升高温度,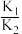
_______ (填“增大”或“减小”)。
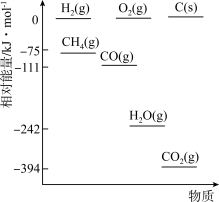
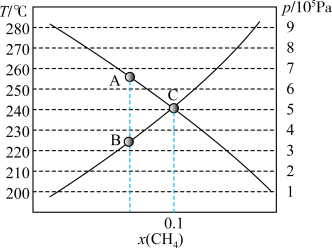
②起始物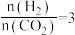 时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数
时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数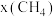 与压强p的变化关系、
与压强p的变化关系、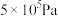 时
时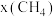 与温度T的变化关系如图所示,图中对应
与温度T的变化关系如图所示,图中对应 、
、 两点的速率:
两点的速率: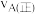
_______ 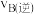 (填“大于”、“小于”或“等于”);若
(填“大于”、“小于”或“等于”);若 点
点 与
与 的分压相同,则
的分压相同,则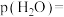
_______ 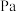 ,反应Ⅰ以物质的量分数表示的平衡常数
,反应Ⅰ以物质的量分数表示的平衡常数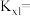
_______ 。
(2) 还原
还原 是实现“双碳”经济的有效途径之一。恒压、750℃时,
是实现“双碳”经济的有效途径之一。恒压、750℃时, 和
和 反应经如图流程(主要产物已标出)可实现
反应经如图流程(主要产物已标出)可实现 高效转化。
高效转化。
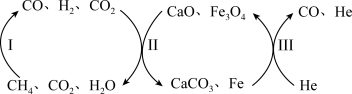
其中过程Ⅱ主要发生如下反应:
ⅰ.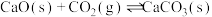
ⅱ.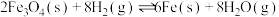
ⅲ.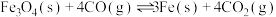
过程Ⅱ平衡后通入 ,反应ⅲ的化学平衡将
,反应ⅲ的化学平衡将_______ (填“正向移动”“逆向移动”或“不移动”),重新平衡时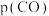
_______ (填“增大”、“减小”或“不变”)。
(1)
 捕集
捕集 合成
合成 涉及下列反应:
涉及下列反应:Ⅰ.

 平衡常数
平衡常数
Ⅱ.

 平衡常数
平衡常数
①相关物质相对能量大小如图所示,则
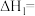
 ,升高温度,
,升高温度,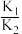

②起始物
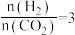 时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数
时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数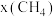 与压强p的变化关系、
与压强p的变化关系、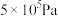 时
时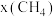 与温度T的变化关系如图所示,图中对应
与温度T的变化关系如图所示,图中对应 、
、 两点的速率:
两点的速率: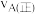
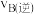 (填“大于”、“小于”或“等于”);若
(填“大于”、“小于”或“等于”);若 点
点 与
与 的分压相同,则
的分压相同,则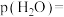
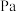 ,反应Ⅰ以物质的量分数表示的平衡常数
,反应Ⅰ以物质的量分数表示的平衡常数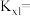

(2)
 还原
还原 是实现“双碳”经济的有效途径之一。恒压、750℃时,
是实现“双碳”经济的有效途径之一。恒压、750℃时, 和
和 反应经如图流程(主要产物已标出)可实现
反应经如图流程(主要产物已标出)可实现 高效转化。
高效转化。
其中过程Ⅱ主要发生如下反应:
ⅰ.
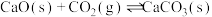
ⅱ.
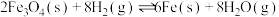
ⅲ.
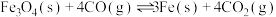
过程Ⅱ平衡后通入
 ,反应ⅲ的化学平衡将
,反应ⅲ的化学平衡将
您最近一年使用:0次
2023-04-30更新
|
432次组卷
|
2卷引用:湖北省襄阳市第五中学2023-2024学年高二上学期9月月考化学试题



