名校
解题方法
1 . C、N、S 的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2的重整用 CO2和 H2为原料可得到 CH4燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247kJ/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205kJ/mol
写出 CO2重整的热化学方程式:_____ 。
(2) “亚硫酸盐法”吸收烟中的 SO2
①将烟气通入 1.0mol/L 的 Na2SO3溶液,若此过程中溶液体积不变,则溶液的 pH 不断_____ (填“减小”“不变” 或“增大)。当溶液 pH 约为 6 时,吸收 SO2的能力显著下降,应更换吸收剂,此时溶液中 c(SO32-) =0.2mol/L, 则溶液中 c(HSO3-) =_____ 。
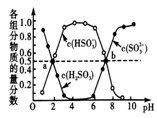
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液 pH 与各组分物质的量分数的变化关系如图: b 点时溶液 pH=7,则 n(NH4+):n(HSO3—)=______________ 。
(3)催化氧化法去除 NO。一定条件下,用 NH3 消除 NO 污染,其反应原理4NH3+6NO 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
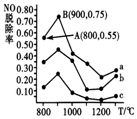
①曲线 a 中,NO 的起始浓度为6×10-4mg·m-3,从 A 点到 B 点经过0.8s,该时间段内 NO 的脱除速率为_____ mg·m-3·s-1。
②曲线 b 对应 NH3与 NO 的物质的量之比是_____ 。
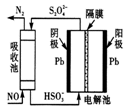
(4)间接电化学法除 NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)_____ 。吸收池中除去 NO 的原理_____ (用离子方程式表示)。
(1)CO2的重整用 CO2和 H2为原料可得到 CH4燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247kJ/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205kJ/mol
写出 CO2重整的热化学方程式:
(2) “亚硫酸盐法”吸收烟中的 SO2
①将烟气通入 1.0mol/L 的 Na2SO3溶液,若此过程中溶液体积不变,则溶液的 pH 不断
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液 pH 与各组分物质的量分数的变化关系如图: b 点时溶液 pH=7,则 n(NH4+):n(HSO3—)=

(3)催化氧化法去除 NO。一定条件下,用 NH3 消除 NO 污染,其反应原理4NH3+6NO
 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
①曲线 a 中,NO 的起始浓度为6×10-4mg·m-3,从 A 点到 B 点经过0.8s,该时间段内 NO 的脱除速率为
②曲线 b 对应 NH3与 NO 的物质的量之比是
(4)间接电化学法除 NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)

您最近一年使用:0次
2020-02-17更新
|
400次组卷
|
7卷引用:湖北省宜昌市西陵区夷陵中学2020届高三上学期理科综合训练(一)化学试题
名校
2 . 2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g) H2O(g) +CO(g) ΔH1 = +41.1 kJ•mol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJ•mol-1
CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0 kJ•mol-1
CH3OH(g) ΔH2=-90.0 kJ•mol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________ 。
(2)工业上一般在恒容 密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________ .
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
①该反应的化学平衡常数表达式为K=_____ 。
②由表中数据判断该反应的△H_____ 0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________ ℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________ .
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率( )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____ 。
②判断L1与L2的大小关系:L1_____ L2(填“<”,“=”或“>”),并简述理由:____________________ 。
(1)已知:CO2(g)+H2(g)
 H2O(g) +CO(g) ΔH1 = +41.1 kJ•mol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJ•mol-1CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.0 kJ•mol-1
CH3OH(g) ΔH2=-90.0 kJ•mol-1则CO2催化氢化合成甲醇的热化学方程式:
(2)工业上一般在
 CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=
②由表中数据判断该反应的△H
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为
(4)要提高CO的转化率,可以采取的措施是(填字母序号)
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率( )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。
①X表示的物理量是
②判断L1与L2的大小关系:L1
您最近一年使用:0次
2020-01-14更新
|
122次组卷
|
6卷引用:湖北省宜昌市部分示范高中教学协作体2019-2020学年高二上学期期末联考化学试题
3 . 火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为________________ 。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
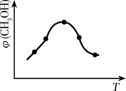
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后 ,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应热△H3_____ 0(填“>”、“<”或“=”),该反应的平衡常数表达式为_______________ 。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:
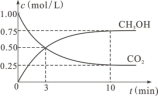
0~10 min内,氢气的平均反应速率为___________________ mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数____________ (填“增大”、“减小”或“不变”,下同),反应的平衡常数_____________________ 。
(3)脱硫。
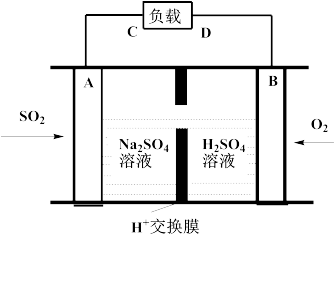
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:_________ 。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为_________ 。
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:

0~10 min内,氢气的平均反应速率为
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:

②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
您最近一年使用:0次
名校
解题方法
4 . (1)以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。相关反应的热化学方程式如下:CaSO4 (s)+CO (g)  CaO(s)+SO2 (g)+CO2 (g) △H1= +218.4kJ·mol-1(反应Ⅰ),CaSO4 (s) +4CO (g)
CaO(s)+SO2 (g)+CO2 (g) △H1= +218.4kJ·mol-1(反应Ⅰ),CaSO4 (s) +4CO (g)  CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ),结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式
CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ),结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式_______ 。
(2)NO2、SO2气体混合存在氧化物间的相互转化平衡:NO2(g)+SO2(g) SO3(g)+NO(g),某活动小组对此反应进行研究实验
SO3(g)+NO(g),某活动小组对此反应进行研究实验
(3)工业上用活性炭还原法处理NO,有关反应为:C(s) +2NO(g) N2(g) +CO2(g)。为了提高NO的转化率,下列的措施可行的是
N2(g) +CO2(g)。为了提高NO的转化率,下列的措施可行的是___ 。
A.再加入一定量的碳 B.增大压强 C.用碱液吸收气体 D.使用催化剂
 CaO(s)+SO2 (g)+CO2 (g) △H1= +218.4kJ·mol-1(反应Ⅰ),CaSO4 (s) +4CO (g)
CaO(s)+SO2 (g)+CO2 (g) △H1= +218.4kJ·mol-1(反应Ⅰ),CaSO4 (s) +4CO (g)  CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ),结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式
CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ),结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式(2)NO2、SO2气体混合存在氧化物间的相互转化平衡:NO2(g)+SO2(g)
 SO3(g)+NO(g),某活动小组对此反应进行研究实验
SO3(g)+NO(g),某活动小组对此反应进行研究实验| 实验内容 | 实验现象 | 结论 | |
① | 将充有NO2、SO2气体的密闭烧瓶放入热水中 | 气体红棕色加深,一段时间后颜色不再变化 | △H |
② | 在针筒中抽入5mL NO2和5mL SO2气体,封闭针筒前端,充分反应后,将活塞迅速推至5mL处 | 气体红棕色加深并保持不变 | 平衡 |
③ | 在充有NO2、SO2混合气体的恒容容器中,达平衡后继续通入SO2气体 | 平衡向右移动,SO2的转化率 |
(3)工业上用活性炭还原法处理NO,有关反应为:C(s) +2NO(g)
 N2(g) +CO2(g)。为了提高NO的转化率,下列的措施可行的是
N2(g) +CO2(g)。为了提高NO的转化率,下列的措施可行的是A.再加入一定量的碳 B.增大压强 C.用碱液吸收气体 D.使用催化剂
您最近一年使用:0次
5 . 甲醇是一种重要的可再生能源.
(1)利用二氧化碳合成甲醇来替代汽油。
已知:2CH3OH(l) +3O2(g)=4H2O(l)+2CO2(g) △H=—1453.0 kJ/mol,2H2(g) + O2(g)=2H2O(l) △H=—571.6 kJ/mol
计算CO2(g)+3H2(g) =CH3OH(l)+ H2O(l)的反应热△H=___________ kJ/mol。
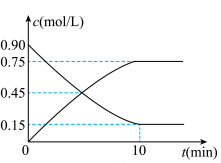
(2)下图是反应CO(g)+2H2(g) CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=
CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=______________ .
(3)在一恒容的密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)⇌CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.
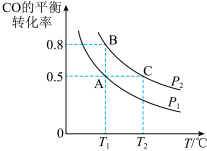
①能判断该反应达到化学平衡状态的是_____ (填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较平衡常数KA、KB、KC的大小:____________
(4)在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是________ (填“T1”或“T2” 或“T3”);

(5)电化学在我们的生产生活中占有越来越重要的地位。
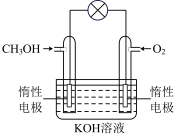
①燃料电池是一种绿色环保、高效的化学电源。图为甲醇燃料电池,则负极反应式为_____________ 。
②用甲醇燃料电池电解300mL饱和食盐水(惰性电极),则电解的离子方程式为____________________ ,电解一段时间后,当溶液的pH值为13时,消耗O2的质量为_______ g。(忽略溶液体积变化)
(1)利用二氧化碳合成甲醇来替代汽油。
已知:2CH3OH(l) +3O2(g)=4H2O(l)+2CO2(g) △H=—1453.0 kJ/mol,2H2(g) + O2(g)=2H2O(l) △H=—571.6 kJ/mol
计算CO2(g)+3H2(g) =CH3OH(l)+ H2O(l)的反应热△H=
(2)下图是反应CO(g)+2H2(g)
 CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=
CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=
(3)在一恒容的密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)⇌CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.

①能判断该反应达到化学平衡状态的是
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较平衡常数KA、KB、KC的大小:
(4)在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是

(5)电化学在我们的生产生活中占有越来越重要的地位。

①燃料电池是一种绿色环保、高效的化学电源。图为甲醇燃料电池,则负极反应式为
②用甲醇燃料电池电解300mL饱和食盐水(惰性电极),则电解的离子方程式为
您最近一年使用:0次
解题方法
6 . 氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
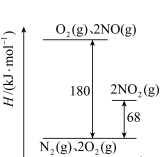
I.(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 mol NO2的能量变化)。1 mol NO氧化为NO2的焓变△H=___________ kJ/mol。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g) N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___________ (填“a”或“b”);反应2NO(g)+O2(g) 2NO2(g)的K=
2NO2(g)的K=___________ 。
(3)已知反应2NO(g)+O2(g) 2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
第一步:NO+NO=N2O2快速平衡
第二步:N2O2+O2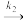 2NO2慢反应
2NO2慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),ν(逆)=k-1c(N2O2)。下列叙述正确的是___________ (填字母)。
A.第一步反应的平衡常数K=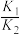
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
Ⅱ.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。工业上可利用反应2C12(g)+NH3(g) NHCl2(l)+HCl(g)制备二氯胺。
NHCl2(l)+HCl(g)制备二氯胺。
(1)二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式______________________ 。
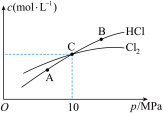
(2)在恒温条件下,将2 mol Cl2和1 mol NH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___________ 点(填“A”“B”或“C”);计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数。)
I.(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 mol NO2的能量变化)。1 mol NO氧化为NO2的焓变△H=

(2)某温度下,反应的平衡常数如下:
a.2NO2(g)
 N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016b.2NO(g)
 N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030分解反应趋势较大的反应是
 2NO2(g)的K=
2NO2(g)的K=(3)已知反应2NO(g)+O2(g)
 2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:第一步:NO+NO=N2O2快速平衡
第二步:N2O2+O2
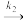 2NO2慢反应
2NO2慢反应其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),ν(逆)=k-1c(N2O2)。下列叙述正确的是
A.第一步反应的平衡常数K=
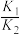
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
Ⅱ.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。工业上可利用反应2C12(g)+NH3(g)
 NHCl2(l)+HCl(g)制备二氯胺。
NHCl2(l)+HCl(g)制备二氯胺。(1)二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式
(2)在恒温条件下,将2 mol Cl2和1 mol NH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是

您最近一年使用:0次
解题方法
7 . 温室效应是由于大气里温室气体(二氧化碳、甲烷等)含量增大而形成的。回答下列问题:
(1)利用CO2可以制取甲醇,有关化学反应如下:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g ) ΔH1=-178 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
已知反应①中相关的化学键键能数据如下:
由此计算断开1 mol C O需要吸收
O需要吸收____________ kJ的能量。
(2)甲烷燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:通入a气体的电极是原电池的______ 极(填“正”或“负”),其电极反应式为______ 。

(3)如图是用甲烷燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,则b处通入的是____ (填“CH4”或“O2”),电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为_____ mol,消耗标准状况下CH4______ mL.

(1)利用CO2可以制取甲醇,有关化学反应如下:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g ) ΔH1=-178 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
已知反应①中相关的化学键键能数据如下:
| 化学键 | C—C | C—H | H—H | C—O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 463 |
由此计算断开1 mol C
 O需要吸收
O需要吸收(2)甲烷燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:通入a气体的电极是原电池的

(3)如图是用甲烷燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,则b处通入的是

您最近一年使用:0次
8 . 氮元素有多种氧化物。请回答下列问题:
(1)已知:H2的燃烧热ΔH为-285.8kJ·mol-1。
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(1) ΔH=-44kJ·mol-1
则4H2(g) + 2NO2(g) = 4H2O(g) + N2(g) ΔH=__________ 。
(2)一定温度下,向2L恒容密闭容器中充入0.40mol N2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
①0-40s内,v(NO2)=________ mol·L-1·s-1。
②升高温度时,气体颜色加深,则上述反应是________ (填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=________ mol·L-1。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)________ (填“>”“=”或“<”)0.60mol·L-1。
(3)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O5的装置。写出阳极区生成N2O5的电极反应式(注意 阳极区为无水环境,HNO3亦无法电离):________________________ 。

(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐。该反应的离子方程式是____________________ 。
(1)已知:H2的燃烧热ΔH为-285.8kJ·mol-1。
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(1) ΔH=-44kJ·mol-1
则4H2(g) + 2NO2(g) = 4H2O(g) + N2(g) ΔH=
(2)一定温度下,向2L恒容密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)
 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/(mol·L-1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
②升高温度时,气体颜色加深,则上述反应是
③该温度下反应的化学平衡常数K=
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)
(3)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O5的装置。写出阳极区生成N2O5的电极反应式(

(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐。该反应的离子方程式是
您最近一年使用:0次
解题方法
9 . (1)已知:①甲烷的燃烧热为 ΔH=—890.3 kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=—517.6 kJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH=—566kJ/mol
甲烷在一定条件下与CO2反应制备合成气(CO、H2),能实现变废为宝,减少CO2的排放,该反应的热化学方程式为_____________________________________________
(2)燃料电池是应用广泛的新型电池,分析下列燃料电池示意图,按要求书写出电极反应式

①正极的电极反应式____________________________________________ ;
②电解质溶液的pH_____________ (填“增大”、“减小”或“不变”);
③当电路中转移0.4mol电子时,理论上消耗标准状况下O2的体积为__________ L。
②2H2(g)+O2(g)=2H2O(l) ΔH=—517.6 kJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH=—566kJ/mol
甲烷在一定条件下与CO2反应制备合成气(CO、H2),能实现变废为宝,减少CO2的排放,该反应的热化学方程式为
(2)燃料电池是应用广泛的新型电池,分析下列燃料电池示意图,按要求书写出电极反应式

①正极的电极反应式
②电解质溶液的pH
③当电路中转移0.4mol电子时,理论上消耗标准状况下O2的体积为
您最近一年使用:0次
名校
解题方法
10 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH=−41 kJ·mol−1
H2(g)+CO2(g) ΔH=−41 kJ·mol−1
②C(s)+2H2(g) CH4(g) ΔH=−73 kJ·mol−1
CH4(g) ΔH=−73 kJ·mol−1
③2CO(g) C(s)+CO2(g) ΔH=−171 kJ·mol−1
C(s)+CO2(g) ΔH=−171 kJ·mol−1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:__________________ 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①反应的化学方程式为:___________________________ 。
②从反应开始到平衡,氢气的平均反应速率v(H2)=_____________ mol/(L∙min)。
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) H2(g)+CO2(g)中CO的平衡转化率随
H2(g)+CO2(g)中CO的平衡转化率随 及温度变化关系如图所示:[p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
及温度变化关系如图所示:[p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
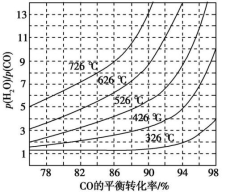
上述反应的逆反应方向是_____________ 反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=______________ ,提高 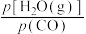 ,则Kp
,则Kp_____________ (填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、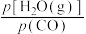 =3~5,采用此条件的原因可能是
=3~5,采用此条件的原因可能是___________ 。
(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH=−41 kJ·mol−1
H2(g)+CO2(g) ΔH=−41 kJ·mol−1②C(s)+2H2(g)
 CH4(g) ΔH=−73 kJ·mol−1
CH4(g) ΔH=−73 kJ·mol−1③2CO(g)
 C(s)+CO2(g) ΔH=−171 kJ·mol−1
C(s)+CO2(g) ΔH=−171 kJ·mol−1写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①反应的化学方程式为:
②从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)
 H2(g)+CO2(g)中CO的平衡转化率随
H2(g)+CO2(g)中CO的平衡转化率随 及温度变化关系如图所示:[p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
及温度变化关系如图所示:[p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
上述反应的逆反应方向是
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=
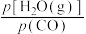 ,则Kp
,则Kp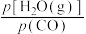 =3~5,采用此条件的原因可能是
=3~5,采用此条件的原因可能是
您最近一年使用:0次



