解题方法
1 . 能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
请根据以上信息可知,1mol氢气在足量的氯气着燃烧生成氯化氢气体放出热量___________ 。
(2)天然气是一种重要的情节能源和化工原料,其主要成分为CH4。以CH4、空气、KOH溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________ 。
(3)工业上有一种方法是用 CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2+3H2 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
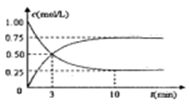
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________ ;H2的转换率α(H2)=___________ 。
②若反应CO2+3H2 CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.V(CO2)=0.15mol·L-1·min-1B.V(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为___________ (填字母)。
(4)海水化学资源的利用具有非常广阔的前景。从海水中提取溴的工业流程如图:

①流程④中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO32-=□BrO3-+□Br-+□CO2↑______
②以上五个过程中涉及氧化还原反应的有___________ 个。
③步骤③中已获得游离态的溴,步骤④又将之转变成化合态的溴,其目的是___________ 。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
(2)天然气是一种重要的情节能源和化工原料,其主要成分为CH4。以CH4、空气、KOH溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为
(3)工业上有一种方法是用 CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2+3H2
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②若反应CO2+3H2
 CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:A.V(CO2)=0.15mol·L-1·min-1B.V(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为
(4)海水化学资源的利用具有非常广阔的前景。从海水中提取溴的工业流程如图:

①流程④中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO32-=□BrO3-+□Br-+□CO2↑
②以上五个过程中涉及氧化还原反应的有
③步骤③中已获得游离态的溴,步骤④又将之转变成化合态的溴,其目的是
您最近一年使用:0次
名校
2 . 铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
试计算,X=_____ ,K1、K2与K3之间的关系为K1=__________ 。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____ (填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
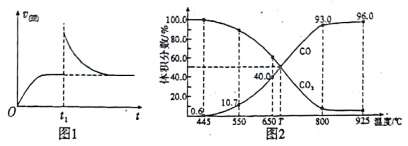
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是_________ 。
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____ (填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____ 。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如下图所示( 导电壳内部为纳米零价铁)。
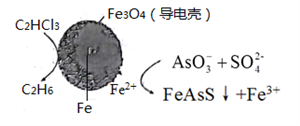
在除污过程中,纳米零价铁中的Fe为原电池的______ 极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________ 。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
| 反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) 2Fe(s)+3CO(g) | +489 | K1 |
ii. Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) 2Fe(s)+3CO2(g) | X | K2 |
iii. C(s)+CO2(g)  2CO(g) 2CO(g) | +172 | K3 |
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度

(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如下图所示( 导电壳内部为纳米零价铁)。

在除污过程中,纳米零价铁中的Fe为原电池的
您最近一年使用:0次
2018-05-29更新
|
762次组卷
|
4卷引用:【全国百强校】湖北省襄阳市第五中学2018届高三五月模拟考试(一)理综化学试题
3 . 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0 kJ·mol-1
H2O(g)=H2O(l) △H3=-44.0 kJ·mol-1
写出甲醇燃烧热的热化学方程式:___________________________________________________
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g) CO(g) +3H2(g)
CO(g) +3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则p1__________ p2(填“<”、“>”、“=”)
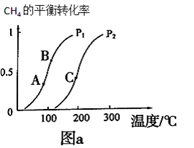
②A、B、C三点处对应平衡常数(KA、KB、KC) 的由大到小顺序为_______________ 。
③100℃时,将1molCH4和2molH2O通入容积为100L的反应室,反应达平衡的标志是:__________ 。
A.容器内气体密度恒定B.单位时间内消耗0.1mol CH4同时生成0.3molH2
C.容器的压强恒定D.3v正(CH4)=v逆(H2)
(3)某实验小组利用CH3OH (g)、O2(g)、KOH (aq) 设计成燃料电池,负极的电极反应式为:_____________________________ ,该电池工作时,溶液的pH将__________ (填“增大”“减小”“不变”)
(1)已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0 kJ·mol-1
H2O(g)=H2O(l) △H3=-44.0 kJ·mol-1
写出甲醇燃烧热的热化学方程式:
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)
 CO(g) +3H2(g)
CO(g) +3H2(g)①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则p1

②A、B、C三点处对应平衡常数(KA、KB、KC) 的由大到小顺序为
③100℃时,将1molCH4和2molH2O通入容积为100L的反应室,反应达平衡的标志是:
A.容器内气体密度恒定B.单位时间内消耗0.1mol CH4同时生成0.3molH2
C.容器的压强恒定D.3v正(CH4)=v逆(H2)
(3)某实验小组利用CH3OH (g)、O2(g)、KOH (aq) 设计成燃料电池,负极的电极反应式为:
您最近一年使用:0次
名校
解题方法
4 . “绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1) 已知: ①NO2+CO CO2+NO 该反应的平衡常数为K1(下同)
CO2+NO 该反应的平衡常数为K1(下同)
每1mol 下列物质分解为气态基态原子消耗能量分别为
②N2(g)+O2(g) 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式_______________________ 以及此热化学方程式的平衡常数K=________ (用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=
,则反应开始到平衡时CO的平均反应速率v(CO)=___________ 。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amo/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围__________ 。
(1) 已知: ①NO2+CO
 CO2+NO 该反应的平衡常数为K1(下同)
CO2+NO 该反应的平衡常数为K1(下同)每1mol 下列物质分解为气态基态原子消耗能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)
 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2③2NO(g) + O2(g)
 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3试写出NO与CO反应生成无污染物气体的热化学方程式
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO
 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=
,则反应开始到平衡时CO的平均反应速率v(CO)=若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amo/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围
您最近一年使用:0次
5 . 2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g); ΔH = -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); ΔH = -483.6KJ·moL-1
H2O (g)=H2O(l); ΔH = -44.0KJ·moL-1
(1)氢气燃烧热ΔH=__________ ;
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式______________ 。
(3)往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为________ ;反应达到平衡后,升高温度,此时平衡常数将____ (填“变大”、“不变”或“变小”)。
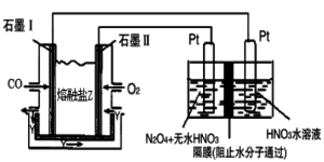
(4)从汽车尾气中分离出CO与O2、熔融盐Na2CO3组成的燃料电池,同时采用电解法制备N2O5,装置如图所示,其中Y为CO2。写出石墨I电极上发生反应的电极反应式_______________________________ 。在电解池中生成N2O5的电极反应式为__________________________________ 。
(5)在一定条件下,用NH3处理汽车尾气中的NO。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________ 。
2CO(g)+O2(g)=2CO2(g); ΔH = -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); ΔH = -483.6KJ·moL-1
H2O (g)=H2O(l); ΔH = -44.0KJ·moL-1
(1)氢气燃烧热ΔH=
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为
(4)从汽车尾气中分离出CO与O2、熔融盐Na2CO3组成的燃料电池,同时采用电解法制备N2O5,装置如图所示,其中Y为CO2。写出石墨I电极上发生反应的电极反应式

(5)在一定条件下,用NH3处理汽车尾气中的NO。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是
您最近一年使用:0次
6 . 乙二醛(OHC-CHO)是一种重要的精细化工产品。
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
① 已知:OHC-CHO(g)+2H2(g)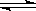 HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
2H2(g)+O2(g)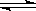 2H2O(g) ΔH=-484 kJ·mol-1 K2
2H2O(g) ΔH=-484 kJ·mol-1 K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)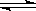 OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
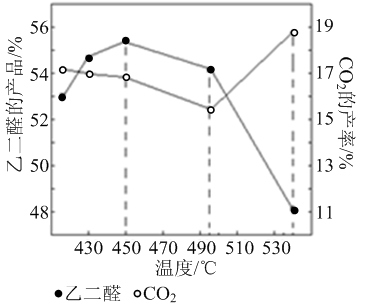
② 当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是 、
Ⅱ.乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。
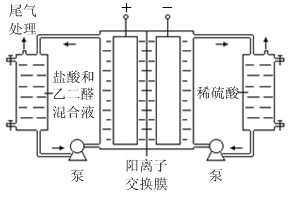
(3)阴极电极式为
(4)阳极液中盐酸的作用,除了产生氯气外,还有
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=
(设:法拉第常数为f C·mol-1;η= )
)
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
① 已知:OHC-CHO(g)+2H2(g)
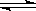 HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K12H2(g)+O2(g)
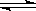 2H2O(g) ΔH=-484 kJ·mol-1 K2
2H2O(g) ΔH=-484 kJ·mol-1 K2乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)
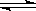 OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
② 当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是 、
Ⅱ.乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。

(3)阴极电极式为
(4)阳极液中盐酸的作用,除了产生氯气外,还有
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=
(设:法拉第常数为f C·mol-1;η=
 )
)
您最近一年使用:0次
7 . 为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:________________________ 。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=___________ kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=_______ 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________ 。
(5)氮氧化物进入水体可转化为 ,电化学降解法可用于治理水中
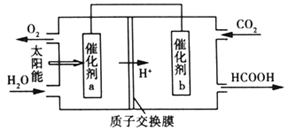
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
电源正极为_______ (填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的 为
为_________ g。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为

(5)氮氧化物进入水体可转化为
 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
电源正极为
 为
为
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
2卷引用:2014-2015学年湖北省襄阳市老河口高级中学高二下学期期末化学试卷
8 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g−1
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ∙mol−1
H2O(g)=H2O(l)△H=−44 kJ∙mol−1
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________ 。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(2)①该反应自发进行的条件是_________ (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是__________ 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H−H键断裂
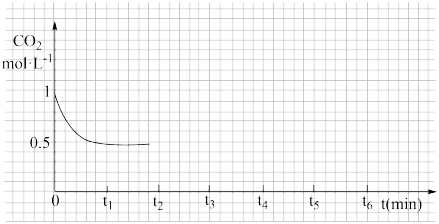
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化___________ 。
(3)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
① 达到平衡时,反应I、II对比:平衡常数K(I)_________ K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I)__________ c(II)。
②对反应I,前10min内的平均反应速率υ(CH3OH)=__________ ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1_________ T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________ 移动(填“正向”、“逆向”或“不”)。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g−1
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ∙mol−1
H2O(g)=H2O(l)△H=−44 kJ∙mol−1
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)
 CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l) (2)①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H−H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化

(3)改变温度,使反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率υ(CH3OH)=
您最近一年使用:0次
2016-12-09更新
|
0次组卷
|
5卷引用:2015-2016学年湖北省枣阳二中高二下学期期中考试化学试卷



