(过二硫酸铵)被用于蓄电池,也可用于照相工业中除去海波。
(过二硫酸铵)被用于蓄电池,也可用于照相工业中除去海波。 的制备原理为
的制备原理为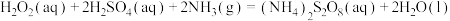 ,下列说法正确的是
,下列说法正确的是| A.该制备反应是熵增过程 | B. 具有强氧化性 具有强氧化性 |
| C.升高温度可提高产率 | D. 的热稳定性比 的热稳定性比 高 高 |
石英砂
 粗硅
粗硅 高纯硅
高纯硅下列说法错误的是
A.制备粗硅的反应方程式为 |
B.1molSi含Si-Si键的数目约为 |
C.原料气HCl和 应充分去除水和氧气 应充分去除水和氧气 |
D.生成 的反应为熵减过程 的反应为熵减过程 |
 甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:
甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:反应I:


反应Ⅱ:


回答下列问题:
(1)
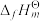 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成 该物质的焓变。反应I的反应热
该物质的焓变。反应I的反应热
| 物质 |  |  |  |  |
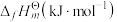 |  | 0 | 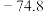 | 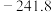 |
 和
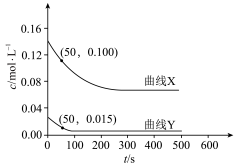
和 的混合气体充入密闭容器中,反应相同的时间,
的混合气体充入密闭容器中,反应相同的时间, 、
、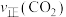 与温度的关系如下图所示,400℃之后
与温度的关系如下图所示,400℃之后 降低,但速率仍然增大可能的原因是
降低,但速率仍然增大可能的原因是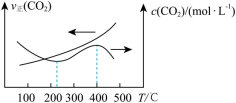
(3)向恒压密闭装置中充入
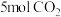 和
和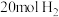 ,不同温度下同时发生反应I和反应Ⅱ,达到平衡时其中两种含碳物质的物质的量
,不同温度下同时发生反应I和反应Ⅱ,达到平衡时其中两种含碳物质的物质的量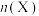 与温度T的关系如图所示。图中缺少
与温度T的关系如图所示。图中缺少 的选择性为
的选择性为 的选择性=
的选择性=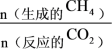 ×100%)
×100%)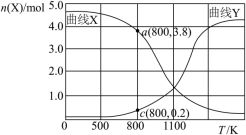
(4)在酸性条件下可采用电解法还原
 制
制 。阴极的电极反应式:
。阴极的电极反应式:
②
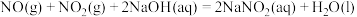
③
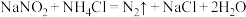
下列说法正确的是
A.常温下,NO与 混合能立即看到红棕色气体,说明该反应已达平衡 混合能立即看到红棕色气体,说明该反应已达平衡 |
B.反应②的 |
C.反应③消耗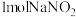 ,理论上会生成标准状况下约 ,理论上会生成标准状况下约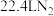 |
D.利用反应①、②、③可以同时处理 含量较高的废气和含 含量较高的废气和含 的废水 的废水 |
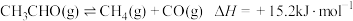 ,
,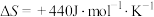 。容器内总压强
。容器内总压强 随反应时间t的变化如左下图所示。下列说法正确的是
随反应时间t的变化如左下图所示。下列说法正确的是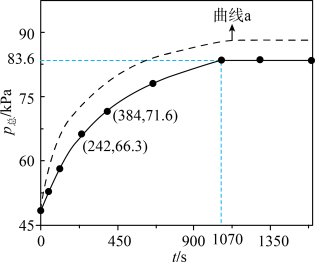
| A.该反应在常温下不能自发进行 |
B.242~384s,CH3CHO的平均消耗速率约为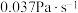 |
C.若添加催化剂, 随t的变化关系可能如曲线a所示 随t的变化关系可能如曲线a所示 |
D.若在891K下进行该反应(其他条件不变),t=1070s时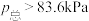 |
 ,含
,含 杂质)制备钛的工艺流程如下。
杂质)制备钛的工艺流程如下。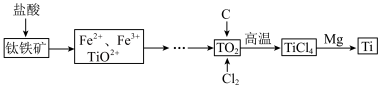
下列关于
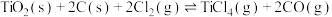 △H<0的说法正确的是
△H<0的说法正确的是| A.上述反应△S<0 |
B.上述反应平衡常数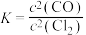 |
C.及时分离 可加快反应达到平衡状态 可加快反应达到平衡状态 |
D.上述反应中每生成1mol CO,转移电子的数目为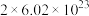 |
| A.Na2CS3能被氧化 | B.Na2CS3溶液显碱性 |
| C.该制备反应是熵减过程 | D.CS2的热稳定性比CO2的差 |

 ,下列说法正确的是
,下列说法正确的是| A.该反应在高温条件下可以自发进行 |
| B.向反应容器中加入催化剂,反应自发进行的临界温度会降低 |
| C.恒容条件下,通入He和Ar组成的混合气体,压强会增大,反应的速率会加快 |
D.恒容条件下,可通入过量的CO2气体来提高 转化率并增大生成物 转化率并增大生成物 的浓度 的浓度 |
9 . 阿根廷科学家MasVeronica等人利用Ni(Ⅱ)Al(Ⅲ)层状复合催化剂进行了乙醇水蒸气重整制氢的研究。其主要反应为
反应I.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H1=+173.3kJ/mol △S=+362.7J/(K•mol)
反应Ⅱ.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H2=+255.7kJ/mol
若在恒容密闭容器中发生上述反应。
(1)反应I在常温下
(2)对上述恒容密闭容器中的体系,下列说法正确的是
| A.增大H2O(g)的浓度,有利于提高C2H5OH平衡转化率 |
| B.一定温度下,增大C2H5OH的浓度可以提高C2H5OH的平衡转化率 |
| C.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| D.升高温度可以使反应I、Ⅱ的正反应速率加快,逆反应速率减小,平衡向正反应方向移动 |
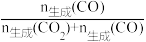 ×100%。
×100%。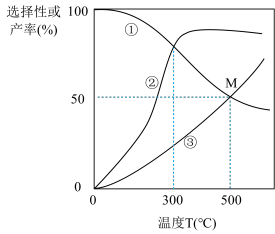
①图中曲线表示平衡时H2产率随温度变化的曲线是
②在密闭容器中,以投料比n(C2H5OH):n(H2O)=3:8通入混合气体,此时C2H5OH的转化率为66.67%,求交点M坐标为(500℃,50%)时反应Ⅱ的平衡常数Kp=
③一定能提高CO选择性的关键因素是
④请分析说明曲线②随温度变化的原因
(4)对乙醇水蒸气重整制氢反应I进行反应机理分析如下,“*”表示催化剂表面的活性中心,请补充完成基元反应iii。
i.C2H6O(g)+(*)→C2H6O*
ii.C2H6O*+(*)→CH4O*+CH2*
ⅲ.
iv.CH2*+2H2O(g)→CO2(g)+3H2(g)+(*)
反应I:
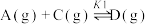

应Ⅱ:
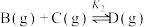

反应Ⅲ:
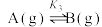

回答下列问题:
(1)①反应I、Ⅱ、Ⅲ的平衡常数
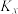 与温度T变化关系如图所示。据图判断,反应Ⅱ________自发进行;
与温度T变化关系如图所示。据图判断,反应Ⅱ________自发进行;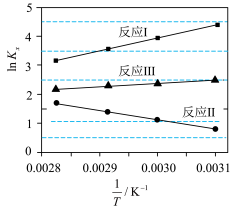
A.在任何温度下都不能 B.在任何温度下都能 C.在低温下能 D.在高温下能
②
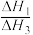 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1
(2)为研究上述反应体系的平衡关系,向VL某反应容器中加入a mol D(g),控制温度为353K,保持容积不变,测得D(g)的平衡转化率为b。该温度下已知反应Ⅲ的平衡常数
 ,则353K时平衡时,B(g)与D(g)物质的量浓度之比
,则353K时平衡时,B(g)与D(g)物质的量浓度之比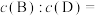
(3)为研究反应体系的动力学行为,向另一容器中加入一定量A(g)、B(g)、C(g)。控制温度为353K,A(g)、B(g)物质的量浓度c随反应时间t的变化如图2所示。代表B(g)变化曲线为