名校
解题方法
1 . (1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
其他条件不变时:探究温度对化学反应速率的影响,应选择实验_______ (填实验编号); 若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为_______ 和_______ 。
(2)研究表明,SO2催化氧化的反应速率方程为:v = k(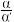 −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
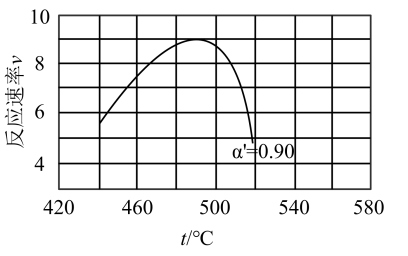
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是_______
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
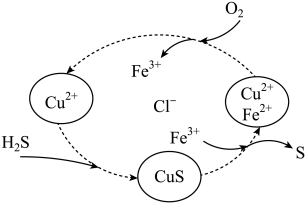
图2
①该循环过程中 Fe3+起的作用是:________ 写出该该反应的化学方程式_______
| 实验 编号 | 实验温 度/℃ | c(Na2S2O3) /(mol·L-1) | V(Na2S2O3) /mL | c(H2SO4) /(mol·L-1) | V(H2SO4) /mL | V(H2O) /mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
(2)研究表明,SO2催化氧化的反应速率方程为:v = k(
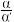 −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:

图2
①该循环过程中 Fe3+起的作用是:
您最近一年使用:0次
解题方法
2 . 四个体积相同的密闭容器中,在一定条件下发生反应:, ,反应开始时,反应速率最大的是
,反应开始时,反应速率最大的是
 ,反应开始时,反应速率最大的是
,反应开始时,反应速率最大的是| 容器 | 温度(℃) | N2(mol) | H2(mol) | 催化剂 |
| A | 500 | 2 | 6 | 有 |
| B | 500 | 1.5 | 4.5 | 无 |
| C | 450 | 1.5 | 4.5 | 无 |
| D | 450 | 2 | 6 | 无 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-13更新
|
66次组卷
|
2卷引用:福建省南安市第六中学2021-2022学年高一下学期4月阶段考试化学试题
名校
解题方法
3 . 下列四个体积相同的密闭容器中,在一定条件下发生反应:N2 + 3H2 2NH3,化学反应速率最快的是
2NH3,化学反应速率最快的是
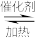 2NH3,化学反应速率最快的是
2NH3,化学反应速率最快的是| 容器 | 温度/℃ | N2/mol | H2/mol | 催化剂 |
| A | 500 | 1.5 | 4.5 | 有 |
| B | 500 | 1 | 3 | 无 |
| C | 450 | 1.5 | 4.5 | 无 |
| D | 450 | 1 | 3 | 无 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-25更新
|
96次组卷
|
4卷引用:福建省连城县第一中学2020-2021学年高二上学期第二次月考化学(学考科)试题
名校
解题方法
4 . 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是
 CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是
| A.过程Ⅰ、过程Ⅱ均为放热过程 |
| B.使用催化剂降低了水煤气变换反应的ΔH |
| C.该催化过程中:有极性键的断裂,极性键和非极性键的形成 |
| D.图示显示:起始时的2个H2O在反应过程中并未都参与了反应 |
您最近一年使用:0次
解题方法
5 . 对于反应:N2(g)+3H2(g) 2NH3(g)。当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):
2NH3(g)。当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):
 2NH3(g)。当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):
2NH3(g)。当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):| 编号 | 改变的条件 | 生成NH3的速率 |
| ① | 升高温度 | |
| ② | 恒容时充入N2 | |
| ③ | 使用催化剂 | |
| ④ | 压缩体积 |
您最近一年使用:0次
2020-12-20更新
|
240次组卷
|
2卷引用:福建省福州市福清市西山学校2020-2021学年高一下学期3月月考化学试题
名校
解题方法
6 . 资料显示:自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4溶液与0.01 mol/L H2C2O4溶液进行下列三组实验,一段时间后溶液均褪色(0.01 mol/L可以记做0.01M)。
下列说法不正确的是
实验① | 实验② | 实验③ |
1mL0.01M的KMnO4溶液和3mL0.01M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和3mL0.01M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和3mL0.01M的H2C2O4溶液混合 |
褪色 | 比实验①褪色快 | 比实验①褪色快 |
| A.实验①中发生氧化还原反应,H2C2O4是还原剂 |
| B.若用1mL0. 2M的H2C2O4做实验①,推测比实验①褪色快 |
| C.实验②褪色比实验①快,是因为MnSO4的催化作用加快了反应速率 |
| D.实验③褪色比实验①快,是因为Cl-起催化作用加快了反应速率 |
您最近一年使用:0次
2020-12-18更新
|
222次组卷
|
10卷引用:福建省泉州市泉港区第一中学2020届高三上学期第一次月考化学试题
福建省泉州市泉港区第一中学2020届高三上学期第一次月考化学试题黑龙江省牡丹江市第一高级中学2020届高三10月月考化学试题天津市耀华中学2019届高三下学期第一次模拟考试化学试题2020届高三化学知识点强化训练—影响化学反应速率的因素(已下线)《2020年新高考政策解读与配套资源》模拟试题12-2020年北京新高考化学模拟试题河北省石家庄市第二中学2019-2020学年高一下学期期末模拟考试化学试题(已下线)【浙江新东方】98江西省景德镇一中2020-2021学年高二下学期期末考试化学(2班)试题河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题(已下线)高二上期末考化学192
名校
解题方法
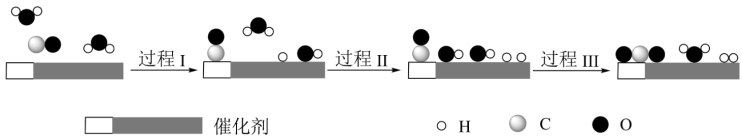
7 . 利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图。H+、O2、NO 等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是( )
等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是( )
 等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是( )
等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是( )
| A.反应①②③④均在正极发生 |
| B.单位时间内,三氯乙烯脱去amolCl时ne=amol |
C.④的电极反应式为NO +10H++8e-=NH +10H++8e-=NH +3H2O +3H2O |
| D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大 |
您最近一年使用:0次
2020-12-08更新
|
2241次组卷
|
34卷引用:福建省厦门市集美中学2023-2024学年高二上学期10月第一次月考化学试题
福建省厦门市集美中学2023-2024学年高二上学期10月第一次月考化学试题山东省菏泽市菏泽第一中学2020届高三下学期在线考试化学试题湖南省怀化市中方一中2020届高三下学期第一次模拟测试理综化学试题湖北省武汉市蔡甸区汉阳一中2020-2021学年高二上学期9月联考化学试题吉林省白城市洮南一中2021届高三上学期第三次月考化学试题福建省安溪一中、养正中学、惠安一中、泉州实验中学2020-2021学年高二上学期期中联考化学试题江苏省徐州一中、兴化中学2021届高三上学期第二次适应性考试化学试题福建省三明市2021届高三上学期期末质量检测化学试题广东省汕头市金山中学2021届高三下学期学科素养测试化学试题安徽省淮北市树人高级中学2020-2021学年高二上学期第四阶段考试化学试题山东省德州市2022届高三12月联合质量测评化学试题山东省2020年普通高中学业水平等级考试模拟试题【省级联考】山东省2020届新高考模拟统考化学试题河南省洛阳市2020届高三上学期期末模拟考试化学试题陕西省西安市周至县第五中学2020届高三第二次模拟考试化学试题黑龙江省哈尔滨市第三中学2020届高三下学期5月第一次模拟考试(全国II卷)理综化学试题北京市海淀区育英学校2020届高三三模化学试题北京市海淀区中央民族大学附属中学2020届高三考前热身化学试题北京市清华大学附属中学2020届高三三模试卷化学试题(已下线)第八单元 化学反应与能量测试题-2021年高考化学一轮复习名师精讲练鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 章末综合检测卷人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 章末综合检测卷(已下线)第21讲 电解池 金属的电化学腐蚀与防护 (精练)-2021年高考化学一轮复习讲练测(已下线)【南昌新东方】9.2020年11月江西南昌三中高三上学期期中化学江苏省盐城市阜宁中学2020-2021学年高二上学期期末考试化学试题广东省广州市三校联考2020-2021学年高二上学期期末考试化学试题(已下线)2021年高考化学押题预测卷(湖北卷)03(含考试版、答题卡、参考答案、全解全析)(已下线)第17讲 电解池 金属的腐蚀与防护(练)— 2022年高考化学一轮复习讲练测(新教材新高考)重庆市西南大学附中2021-2022学年高一下学期期中考试化学试题江苏省无锡市天一中学2021-2022学年高二下学期期中考试化学(强化班)试题第四章化学反应与电能甘肃省天水市清水县2022-2023学年高二上学期12月期中考试化学试题河南省南阳市2023-2024学年高二上学期期中考试化学试题
名校
8 . 根据化学反应速率或平衡理论,联系生产实际,下列说法错误的是
| A.供热公司为了节能减排,将煤块粉碎,让煤充分燃烧 |
| B.啤酒瓶开启后,马上泛起大量泡沫,可用勒夏特列原理解释 |
| C.使用高效催化剂是大大提高原料平衡转化率的有效方法 |
| D.将一氧化碳中毒者放入高压氧舱,增大氧气浓度,利用平衡移动原理缓解病情 |
您最近一年使用:0次
2020-12-06更新
|
267次组卷
|
7卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题
名校
9 . 研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述错误的是
| A.加快了反应的速率 | B.增大了反应的平衡常数 |
| C.改变了反应的历程 | D.降低了反应的活化能 |
您最近一年使用:0次
2020-11-17更新
|
208次组卷
|
4卷引用:福建省华安县第一中学2023-2024学年高二上学期12月月考化学试题
名校
10 . 甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如下。下列说法中不正确 的是
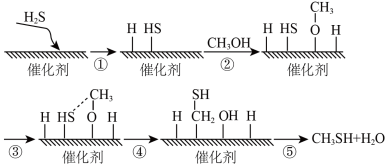

| A.过程①吸收能量 |
| B.过程④中,形成了O—H键和C—S键 |
| C.该催化剂可降低反应活化能从而有效提高反应物的平衡转化率 |
| D.硫化氢与甲醇合成甲硫醇的反应类型为取代反应 |
您最近一年使用:0次
2020-11-10更新
|
406次组卷
|
6卷引用:福建省平潭翰英中学2021-2022学年高三上学期第一次月考化学试题
福建省平潭翰英中学2021-2022学年高三上学期第一次月考化学试题江西省南昌市第二中学2021届高三上学期第四次考试化学试题(已下线)【南昌新东方】2. 2020 高三 南昌二中第三次考试 左佳鑫江西省上高二中2022届高三第二次月考化学试卷河北省张家口市宣化第一中学2021-2022学年高三上学期12月月考化学试题(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)