名校
解题方法
1 . 研究表明汽车尾气处理存在反应:N2O(g)+CO(g)=N2(g)+CO2(g),N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示。下列说法不正确 的是
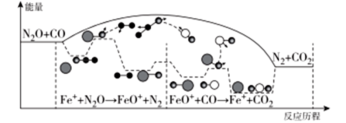

| A.升高温度,该反应的平衡常数减小 |
| B.Fe+不影响该反应的焓变 |
| C.FeO+属于有中间产物,故FeO+不能作为该反应的催化剂 |
| D.Fe++N2O→FeO++N2,FeO++CO→Fe++CO2两步反应,前者反应速率慢 |
您最近一年使用:0次
2021-12-09更新
|
217次组卷
|
2卷引用:福建省长汀县第一中学2021-2022学年高三上学期第三次月考化学试题
名校
解题方法
2 . 今年9月24日,中科院的科研人员在线发表成果宣布创制了一条利用二氧化碳和电能人工合成淀粉的路线(ASAP路线):通过光伏发电电解水产生氢气,然后通过催化剂利用氢气和二氧化碳生成甲醇,使用多种优选的酶逐步将甲醇最后转化为淀粉。1立方米生物反应器年产淀粉量相当于5亩土地玉米种植的淀粉产量。下列说法错误的是
| A.ASAP路线体现了光能—电能—化学能的转变 |
| B.催化剂可以提高氢气和二氧化碳的平衡转化率 |
| C.酶在合成路线中使各步化学反应更容易发生 |
| D.ASAP路线生产在未来的发展具有广阔前景 |
您最近一年使用:0次
2021-12-06更新
|
193次组卷
|
7卷引用:福建省福清西山学校2021-2022学年高二上学期12月月考化学试题
名校
解题方法
3 . 随着工业发展,空气污染也日益严重,其中NOx是主要污染源,最近科学家制备出了规整形貌的硫酸改性Fe2O3催化剂,该催化剂具有很好的NH3-SCR催化效果。研究表明,经过硫酸改性后的六方盘状Fe2O3催化活性和N2选择性都得到了极大的提升,催化流程如图所示。
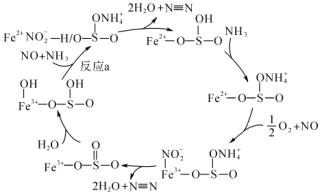
下列说法不正确的是

下列说法不正确的是
A.该反应的催化剂为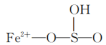 |
B.该过程可能发生的反应有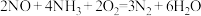 |
| C.反应a为化合反应 |
| D.硫酸改性后的六方盘状Fe2O3催化剂提高了NOx的去除率 |
您最近一年使用:0次
2021-11-19更新
|
183次组卷
|
3卷引用:福建省部分名校2021-2022学年高三上学期11月联合测评化学试题
名校
解题方法
4 . 常温下,向H2O2溶液中滴加少量Fe2(SO4)3溶液,反应原理如下图所示,下列说法不正确的是
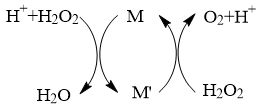

| A.该反应过程中,M是Fe3+, M’是Fe2+ |
B.该过程的总反应方程式为: 2H2O2 2H2O+O2↑ 2H2O+O2↑ |
| C.当反应中有1 mol O2生成时,转移电子数为2 mol |
| D.H2O2生产过程要严格避免混入Fe2+ |
您最近一年使用:0次
2021-11-17更新
|
332次组卷
|
3卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高一上学期第二次阶段考化学试题
名校
解题方法
5 . 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2 s内的平均反应速率υ(N2)=_______ 。
(2)达到平衡时NO的转化率为_______ 。
(3)若上述反应在密闭恒容容器中进行,判断该反应达到平衡的依据为_______(填字母)。
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
①表中t2=_______ ℃,c1=_______ mol·L−1,c2= _______ mol·L−1。
②三组实验中的浓度随时间的变化如下图所示:
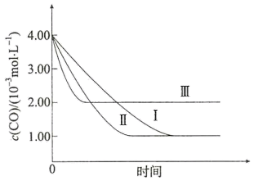
由曲线Ⅰ、Ⅱ可知,其它条件相同时,增大催化剂的比表面积,该化学反应的速率将_______ (填“增大”、“减小”或“无影响”)。由实验Ⅰ和Ⅲ可得出的结论是_______ 。
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L−1 | 1.00×10−3 | 4.50×10−4 | 2.50×10−4 | 1.50×10−4 | 1.00×10−4 | 1.00×10−4 |
| c(CO)/mol·L−1 | 3.60×10−3 | 3.05×10−3 | 2.85×10−3 | 2.75×10−3 | 2.70×10−3 | 2.70×10−3 |
(1)前2 s内的平均反应速率υ(N2)=
(2)达到平衡时NO的转化率为
(3)若上述反应在密闭恒容容器中进行,判断该反应达到平衡的依据为_______(填字母)。
| A.c(N2)不随时间改变 | B.气体的密度不随时间改变 |
| C.压强不随时间改变 | D.单位时间内消耗2 mol NO的同时生成1 mol N2 |
| 编号 | t/℃ | NO初始浓度/mol·L−1 | CO初始浓度/mol·L−1 | 催化剂的比表面积/m2·g−1 |
| Ⅰ | 280 | 6.50×10−3 | 4.00×10−3 | 80.0 |
| Ⅱ | t2 | c1 | 4.00×10−3 | 120 |
| Ⅲ | 350 | 6.50×10−3 | c2 | 80.0 |
②三组实验中的浓度随时间的变化如下图所示:

由曲线Ⅰ、Ⅱ可知,其它条件相同时,增大催化剂的比表面积,该化学反应的速率将
您最近一年使用:0次
2021-11-17更新
|
283次组卷
|
3卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题
6 . 回答下列问题:
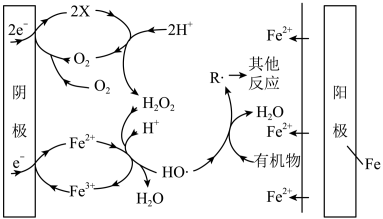
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为____ ,X微粒的化学式为____ ,阴极附近Fe2+参与反应的离子方程式为___ 。
(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是___ 。
a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g) CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
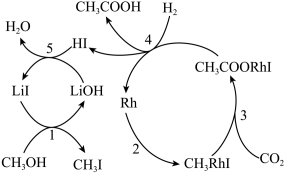
反应历程中,能降低反应活化能的物质有___ (填化学式);中间产物有___ 种。
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为

(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g)
 CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
反应历程中,能降低反应活化能的物质有
您最近一年使用:0次
解题方法
7 . H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的•OH(羟基自由基),•OH可将有机物氧化降解。
(1)Cu2+—H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)=CuOOH+(aq)+H+(aq) △H1=akJ/mol
CuOOH+(aq)=Cu+(aq)+•OH(aq)+ O2(g) △H2=bkJ/mol
O2(g) △H2=bkJ/mol
2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) △H3=ckJ/mol
则H2O2(aq)=2•OH(aq)△H=___ kJ•mol-1。
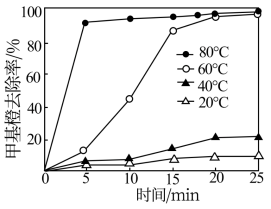
(2)为探究温度对Cu2+—H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除率增大,其原因是___ 。
(3)为探究Fe2+—Cu2+—H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+—Cu2+—H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为___ 。
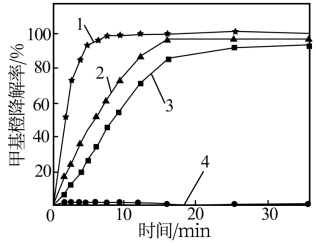
实验条件:200mL甲基橙模拟废水(1.5g•L-1,pH=3.0),温度60℃、V(H2O2)=2.0mL。
曲线1—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
曲线2—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
曲线3—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
曲线4—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(1)Cu2+—H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)=CuOOH+(aq)+H+(aq) △H1=akJ/mol
CuOOH+(aq)=Cu+(aq)+•OH(aq)+
 O2(g) △H2=bkJ/mol
O2(g) △H2=bkJ/mol2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) △H3=ckJ/mol
则H2O2(aq)=2•OH(aq)△H=
(2)为探究温度对Cu2+—H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除率增大,其原因是

(3)为探究Fe2+—Cu2+—H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+—Cu2+—H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为

实验条件:200mL甲基橙模拟废水(1.5g•L-1,pH=3.0),温度60℃、V(H2O2)=2.0mL。
曲线1—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
曲线2—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
曲线3—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
曲线4—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
您最近一年使用:0次
名校
8 . 由下列实验操作及现象能得出相应结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置 | 溶液分层,下层呈紫红色 | 氧化性:Cl2>Br2>I2 |
| B | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| C | 用pH计测定pH: ①NaHCO3溶液②CH3COONa溶液 | pH:①>② | H2CO3酸性弱于CH3COOH |
| D | 将一块未经打磨的铝片剪成相同的两小片,相同温度下分别投入5.0mL浓度均为2.0 mol∙L−1的CuSO4溶液和CuCl2溶液中 | CuSO4溶液中无明显现象;CuCl2溶液中反应剧烈,铝片表面有红色物质生成 | 则Cl-能加速破坏铝片表面的氧化膜 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 某化学小组运用控制变量法研究外界条件对化学反应速率的影响,做了如下实验。请按要求回答下列问题:
(1)室温下,探究影响 分解速率的因素,见下表和如图:
分解速率的因素,见下表和如图:
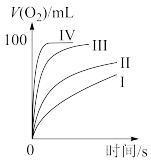
①表中x为_______ ;
②实验Ⅱ、Ⅲ探究的是_______ 对 分解速率的影响,根据图上图,得出的结论是
分解速率的影响,根据图上图,得出的结论是_______ 。
③根据上图,实验Ⅰ、Ⅳ对比得出的结论是_______ 。
(2)为进一步研究离子对 分解的影响,小组同学又做了比较
分解的影响,小组同学又做了比较 和
和 对
对 分解影响的下列实验:
分解影响的下列实验:
①定性分析:用如图装置可通过观察_______ ,定性得出结论。
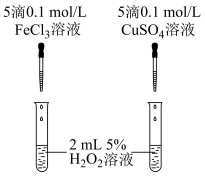
某同学认为将 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是_______ .
②定量分析:为了更精确地研究催化剂对反应速率的影响,利用如图装置进行定量实验。实验测得,在硫酸铜催化下过 发生分解反应,2min时生成气体1.12L(气体体积已换算为标准状况),则
发生分解反应,2min时生成气体1.12L(气体体积已换算为标准状况),则 的分解速率为
的分解速率为_______  。
。
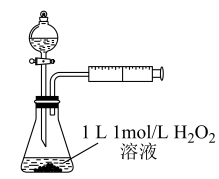
(1)室温下,探究影响
 分解速率的因素,见下表和如图:
分解速率的因素,见下表和如图:
| 实验 | 所用试剂 | |
| Ⅰ | 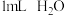 |  |
| Ⅱ | 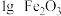 | 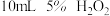 |
| Ⅲ | 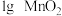 | 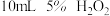 |
| Ⅳ |  | 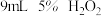 |
②实验Ⅱ、Ⅲ探究的是
 分解速率的影响,根据图上图,得出的结论是
分解速率的影响,根据图上图,得出的结论是③根据上图,实验Ⅰ、Ⅳ对比得出的结论是
(2)为进一步研究离子对
 分解的影响,小组同学又做了比较
分解的影响,小组同学又做了比较 和
和 对
对 分解影响的下列实验:
分解影响的下列实验:①定性分析:用如图装置可通过观察

某同学认为将
 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是②定量分析:为了更精确地研究催化剂对反应速率的影响,利用如图装置进行定量实验。实验测得,在硫酸铜催化下过
 发生分解反应,2min时生成气体1.12L(气体体积已换算为标准状况),则
发生分解反应,2min时生成气体1.12L(气体体积已换算为标准状况),则 的分解速率为
的分解速率为 。
。
您最近一年使用:0次
2021-10-28更新
|
153次组卷
|
2卷引用:福建省南安市侨光中学2021-2022学年高二上学期第一次阶段考化学试题
名校
10 . “接触法制硫酸”的主要反应是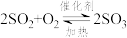 在催化剂表面的反应历程如下:
在催化剂表面的反应历程如下:
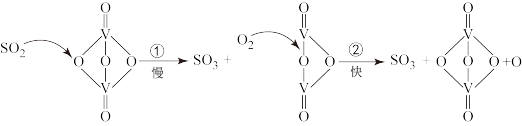
下列说法正确的是
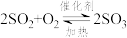 在催化剂表面的反应历程如下:
在催化剂表面的反应历程如下:
下列说法正确的是
| A.使用催化剂只能加快正反应速率 | B.该反应的催化剂是 |
| C.反应②的活化能比反应①大 | D.过程中有 键的形成 键的形成 |
您最近一年使用:0次



