名校
1 . SO2是一种大气污染物,但它在化工和食品工业上却有广泛应用。
(1)某兴趣小组查阅相关资料,设计了如下SO2的制备与性质实验(加热装置略)。

实验记录A中现象如下:
查阅资料:产物中的黑色和灰白色固体物质主要成分为CuS、Cu2S和CuSO4,其中CuS和Cu2S为黑色固体,常温下都不溶于稀盐酸,在空气中灼烧均转化为CuO和SO2。
①实验中盛装浓硫酸的仪器名称为________ ,装置B的作用是___________ 。
②实验记录表明___ 对实验结果有影响,为了得到预期实验现象,在操作上应该___ 。
③装置C中发生反应的离子方程式是______________________________ 。
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有CuS,其原理为___________ (结合化学方程式解释)。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:

由分析可知X为___________ (填化学式),0~t1时间段的温度为__________ 。
(3)燃煤烟气中可通过反应SO2(g)+2CO(g) 2CO2(g)+S(l)实现硫的回收。将1 mol SO2和2 mol CO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106 Pa条件下反应,5 min时,反应达到平衡,气体密度减小16 g·L-1。
2CO2(g)+S(l)实现硫的回收。将1 mol SO2和2 mol CO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106 Pa条件下反应,5 min时,反应达到平衡,气体密度减小16 g·L-1。
①0~5min内,CO的反应速率是________ ;若升高温度,气体的密度增加(S仍为液体),则该反应的ΔH______ 0(填“>”或“<”)。
②T℃时,平衡常数Kp=_________ Pa-1。
(1)某兴趣小组查阅相关资料,设计了如下SO2的制备与性质实验(加热装置略)。

实验记录A中现象如下:
序号 | 反应温度/℃ | 实验现象 |
1 | 134 | 开始出现黑色絮状物,产生后下沉,无气体产生 |
2 | 158 | 黑色固体产生的同时,有气体生成 |
3 | 180 | 气体放出的速度更快,试管内溶液为黑色浑浊 |
4 | 260 | 有大量气体产生,溶液变为蓝色,试管底部产生灰白色固体,品红褪色 |
5 | 300 | 同上 |
①实验中盛装浓硫酸的仪器名称为
②实验记录表明
③装置C中发生反应的离子方程式是
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有CuS,其原理为
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:

由分析可知X为
(3)燃煤烟气中可通过反应SO2(g)+2CO(g)
 2CO2(g)+S(l)实现硫的回收。将1 mol SO2和2 mol CO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106 Pa条件下反应,5 min时,反应达到平衡,气体密度减小16 g·L-1。
2CO2(g)+S(l)实现硫的回收。将1 mol SO2和2 mol CO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106 Pa条件下反应,5 min时,反应达到平衡,气体密度减小16 g·L-1。①0~5min内,CO的反应速率是
②T℃时,平衡常数Kp=
您最近一年使用:0次
2 . 第三代半导体材料以碳化硅和氮化镓为主,广泛应用于新能源汽车、高铁等领域。
(1)基态Si原子的价电子排布图为_______ 。
(2)C、N、Si的第一电离能由大到小的顺序是_______ (填元素符号)。
(3) 的空间构型为
的空间构型为_______ ,其中碳原子的杂化轨道类型为_______ 。
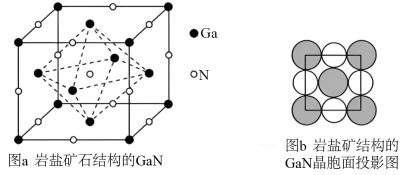
(4)岩盐矿结构的GaN晶体结构如图a、图b所示,Ga、N原子半径分别为 、
、 ,则Ga原子的配位数为
,则Ga原子的配位数为_______ ,设阿伏加德罗常数的值为NA,则该GaN的密度是_______  (列出算式)。
(列出算式)。
(5)煤的气化是一种重要的制氢途径。在一定温度下:向体积固定的密闭容器中加入足量的 和1mol
和1mol ,发生下列反应生成水煤气:
,发生下列反应生成水煤气:
Ⅰ.

Ⅱ.

反应平衡时, 的转化率为50%,CO的物质的量为0.1mol。
的转化率为50%,CO的物质的量为0.1mol。
①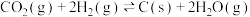

_______ 。
②下列说法正确的是_______ 。
A.将炭块粉碎,可加快反应速率
B.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡
D.平衡时 的体积分数可能大于
的体积分数可能大于
③求反应Ⅱ的平衡常数K=_______ 。
(1)基态Si原子的价电子排布图为
(2)C、N、Si的第一电离能由大到小的顺序是
(3)
 的空间构型为
的空间构型为(4)岩盐矿结构的GaN晶体结构如图a、图b所示,Ga、N原子半径分别为
 、
、 ,则Ga原子的配位数为
,则Ga原子的配位数为 (列出算式)。
(列出算式)。
(5)煤的气化是一种重要的制氢途径。在一定温度下:向体积固定的密闭容器中加入足量的
 和1mol
和1mol ,发生下列反应生成水煤气:
,发生下列反应生成水煤气:Ⅰ.


Ⅱ.


反应平衡时,
 的转化率为50%,CO的物质的量为0.1mol。
的转化率为50%,CO的物质的量为0.1mol。①
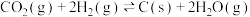

②下列说法正确的是
A.将炭块粉碎,可加快反应速率
B.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡
D.平衡时
 的体积分数可能大于
的体积分数可能大于
③求反应Ⅱ的平衡常数K=
您最近一年使用:0次
名校
3 . 一定温度下的密闭容器中发生反应: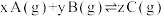 ,平衡时测得
,平衡时测得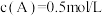 。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测
。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测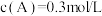 。下列判断正确的是
。下列判断正确的是
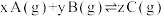 ,平衡时测得
,平衡时测得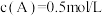 。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测
。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测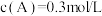 。下列判断正确的是
。下列判断正确的是A.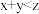 | B.平衡向正反应方向移动 |
| C.C的体积分数减小 | D.A的转化率升高 |
您最近一年使用:0次
4 . 二氧化碳、甲烷是地球大气中的主要温室气体,它们能吸收地面反射的太阳辐射,使地球表面变暖,因此,对二氧化碳、甲烷的高效利用有着举足轻重的作用。回答下列问题:
(1)已知下列反应
①CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2
则二氧化碳重整甲烷反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H3=_______
(2)恒温恒容密闭容器中,反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)达到平衡状态的标志是_______ 。
A.容器内的压强保持不变
B.c(CH4):c(CO2):c(CO):c(H2)=1:1:2:2
C.混合气体的平均分子量保持不变
D.混合气体的颜色保持不变
E.单位时间内断裂C—H键和形成H—H键的数目之比为2:1
(3)反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡常数的表达式为_______ 。
(4)T℃时,向恒容密闭容器中投入CH4和CO2各1mol,发生反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),测得容器内的气体压强随时间的变化如下表所示(气态物质分压=总压×气态物质的物质的量分数,不考虑其他副反应):
①在0~20min内,平均反应速率v(CO)=_______ kPa/min。
②达到平衡时,CO2的体积分数为_______ (结果保留一位小数)
③若在恒温恒压密闭容器中进行上述反应,CH4的转化率将_______ (填增大、减小、不变)。
(5)以CH4和O2、KOH溶液构成燃料电池,该电池的负极反应式为_______ ,燃料电池工作之后,电解质溶液pH将_______ (填增大、减小、不变)。
(1)已知下列反应
①CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2
则二氧化碳重整甲烷反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H3=
(2)恒温恒容密闭容器中,反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)达到平衡状态的标志是
A.容器内的压强保持不变
B.c(CH4):c(CO2):c(CO):c(H2)=1:1:2:2
C.混合气体的平均分子量保持不变
D.混合气体的颜色保持不变
E.单位时间内断裂C—H键和形成H—H键的数目之比为2:1
(3)反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡常数的表达式为
(4)T℃时,向恒容密闭容器中投入CH4和CO2各1mol,发生反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),测得容器内的气体压强随时间的变化如下表所示(气态物质分压=总压×气态物质的物质的量分数,不考虑其他副反应):
| 时间/min | 0 | 10 | 20 | 30 | 50 | 60 |
| 总压/kPa | 100 | 118 | 132 | 141 | 148 | 148 |
②达到平衡时,CO2的体积分数为
③若在恒温恒压密闭容器中进行上述反应,CH4的转化率将
(5)以CH4和O2、KOH溶液构成燃料电池,该电池的负极反应式为
您最近一年使用:0次
名校
5 . 只改变一个条件,化学反应3A(g)+B(s)⇌2C(g)+D(?) ∆H的变化图象如下,其中α(A)表示A的平衡转化率,下列说法不正确的是


| A.由图甲可知,若P1>P2,则D为非气体 |
| B.由图乙可知,T1>T2,∆H<0 |
| C.由丙图可知,B点时,v逆>v正 |
| D.由丁图可知,该反应的∆H<0 |
您最近一年使用:0次
2022-04-06更新
|
111次组卷
|
2卷引用:重庆市第十一中学校2021-2022学年高三上学期12月月考化学试题
6 . 钯催化剂(主要成分为Pd、α−Al2O3,还含少量铁、铜等)在使用过程中,Pd易被氧化为难溶于酸的PdO而失活。一种从废钯催化剂中回收海绵钯的工艺流程如下图:

(1)“还原I”加入甲酸的目的是还原_______ (填化学式)。
(2)“酸浸”过程用盐酸和H2O2,Pd转化为 的离子方程式为
的离子方程式为_______ 。
(3)“还原II”中氧化剂和还原剂的物质的量之比为_______ 。
(4)酸浸在一定温度下充分浸取钯,得到氯亚钯酸(H2PdCl4)溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度是_______ ,最佳的HCl浓度为_______ 。

(5)“离子交换”和“洗脱”可简单表示为(RCl为阴离子交换树脂):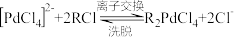 ,“离子交换”流出液中阳离子有H、
,“离子交换”流出液中阳离子有H、_______ (填离子符号)。
(6)“沉钯”过程中先加入氨水得到Pd(NH3)4Cl2溶液,再加入盐酸后得到Pd(NH3)2Cl2沉淀,用化学平衡知识解释加入盐酸的作用_______ 。
(7)已知:常温下,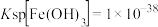 ,
,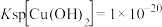 。假设在流出液中各离子的浓度均为0.1mol/L,加入氨水调节pH后过滤,滤液经一系列操作可以得到CuCl2·6H2O。需调节pH的范围是
。假设在流出液中各离子的浓度均为0.1mol/L,加入氨水调节pH后过滤,滤液经一系列操作可以得到CuCl2·6H2O。需调节pH的范围是_______ 。(当离子浓度小于 mol/L时认为已沉淀完全)。
mol/L时认为已沉淀完全)。

(1)“还原I”加入甲酸的目的是还原
(2)“酸浸”过程用盐酸和H2O2,Pd转化为
 的离子方程式为
的离子方程式为(3)“还原II”中氧化剂和还原剂的物质的量之比为
(4)酸浸在一定温度下充分浸取钯,得到氯亚钯酸(H2PdCl4)溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度是

(5)“离子交换”和“洗脱”可简单表示为(RCl为阴离子交换树脂):
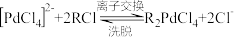 ,“离子交换”流出液中阳离子有H、
,“离子交换”流出液中阳离子有H、(6)“沉钯”过程中先加入氨水得到Pd(NH3)4Cl2溶液,再加入盐酸后得到Pd(NH3)2Cl2沉淀,用化学平衡知识解释加入盐酸的作用
(7)已知:常温下,
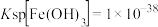 ,
,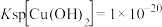 。假设在流出液中各离子的浓度均为0.1mol/L,加入氨水调节pH后过滤,滤液经一系列操作可以得到CuCl2·6H2O。需调节pH的范围是
。假设在流出液中各离子的浓度均为0.1mol/L,加入氨水调节pH后过滤,滤液经一系列操作可以得到CuCl2·6H2O。需调节pH的范围是 mol/L时认为已沉淀完全)。
mol/L时认为已沉淀完全)。
您最近一年使用:0次
2022-03-20更新
|
307次组卷
|
2卷引用:重庆市第十一中学校2021-2022学年高三下学期3月月考化学试题
名校
7 . K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3等杂质)为原料制备K2Cr2O7的一种工艺流程如下:

(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+O2=Na2CrO4+Fe2O3+CO2(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)“滤渣1”的主要成分为_______ (填化学式),它的一种用途为:_______ 。
(3)依据流程图分析熔融反应时,Al2O3变成_______ (填化学式),写出步骤③的离子反应方程式_______ ;
(4)步骤④中调pH,以实现2CrO +2H+⇌Cr2O
+2H+⇌Cr2O +H2O。以下试剂可选用_______(填标号)。
+H2O。以下试剂可选用_______(填标号)。
(5)在步骤⑤中加入适量KCl可得到K2Cr2O7晶体。已知不同温度下各物质的溶解度:
为使K2Cr2O7晶体充分析出并分离,应采取的操作为_______ 、_______ 、洗涤、干燥。
(6)某工厂用50.0kg铬铁矿粉(含Cr2O338%)制K2Cr2O7,最终得到产品29.4kg,产率为_______ 。

(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+O2=Na2CrO4+Fe2O3+CO2(未配平),该反应中氧化剂与还原剂的物质的量之比为
(2)“滤渣1”的主要成分为
(3)依据流程图分析熔融反应时,Al2O3变成
(4)步骤④中调pH,以实现2CrO
 +2H+⇌Cr2O
+2H+⇌Cr2O +H2O。以下试剂可选用_______(填标号)。
+H2O。以下试剂可选用_______(填标号)。| A.SO2 | B.H2SO4 | C.NaOH | D.HI |
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100gH2O) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 70 | 376 | |
为使K2Cr2O7晶体充分析出并分离,应采取的操作为
(6)某工厂用50.0kg铬铁矿粉(含Cr2O338%)制K2Cr2O7,最终得到产品29.4kg,产率为
您最近一年使用:0次



