解题方法
1 . 碘水中存在可逆反应:I2(aq)+I-(aq) I
I (aq),为测定该反应的平衡常数K进行如下实验。
(aq),为测定该反应的平衡常数K进行如下实验。
实验i 测定平衡体系中I2和I 总浓度
总浓度

实验ii 测定饱和碘水中I2浓度

已知: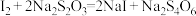 。
。
(1)碘量瓶是带磨口塞和水封槽的锥形瓶,盖上塞子后可以水封瓶口,常用于碘量分析本实验采用碘量瓶的目的是___________ 。
(2)滴定过程应使用___________ 滴定管。
(3)滴定过程,当溶液变为浅黄色时再加入淀粉溶液,滴定终点现象为___________ 。
(4)实验i和实验ii中I2浓度近似相等,则实验i剩余碘固体的质量___________ 实验ii(填“大于”、“小于”或“等于”)。
(5)实验测得平衡体系中c(I )=
)=___________ mol·L-1,平衡常数K=___________ (列表达式即可)
(6)下列关于实验分析的说法正确的是___________ (填标号)。
A.实验i的碘量瓶在使用前未烘干会影响实验结果
B.实验i应精准控制加入 溶液的体积
溶液的体积
C.实验ii吸取上层清液时,不慎吸入碘固体,则测得的K偏大
D.实验ii滴定终点时俯视读数,则测得的K偏大
(7)另外设计实验方案测定平衡常数K:取10.00 碘量瓶②中上层清液,加入10
碘量瓶②中上层清液,加入10
 萃取
萃取 并分液。用0.0050
并分液。用0.0050
 溶液分别滴定水层和有机层、消耗
溶液分别滴定水层和有机层、消耗 溶液的体积为
溶液的体积为
 和
和
 。试分析该方案是否可行,并说明理由
。试分析该方案是否可行,并说明理由___________ 。
 I
I (aq),为测定该反应的平衡常数K进行如下实验。
(aq),为测定该反应的平衡常数K进行如下实验。实验i 测定平衡体系中I2和I
 总浓度
总浓度
实验ii 测定饱和碘水中I2浓度

已知:
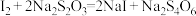 。
。(1)碘量瓶是带磨口塞和水封槽的锥形瓶,盖上塞子后可以水封瓶口,常用于碘量分析本实验采用碘量瓶的目的是
(2)滴定过程应使用
(3)滴定过程,当溶液变为浅黄色时再加入淀粉溶液,滴定终点现象为
(4)实验i和实验ii中I2浓度近似相等,则实验i剩余碘固体的质量
(5)实验测得平衡体系中c(I
 )=
)=(6)下列关于实验分析的说法正确的是
A.实验i的碘量瓶在使用前未烘干会影响实验结果
B.实验i应精准控制加入
 溶液的体积
溶液的体积C.实验ii吸取上层清液时,不慎吸入碘固体,则测得的K偏大
D.实验ii滴定终点时俯视读数,则测得的K偏大
(7)另外设计实验方案测定平衡常数K:取10.00
 碘量瓶②中上层清液,加入10
碘量瓶②中上层清液,加入10
 萃取
萃取 并分液。用0.0050
并分液。用0.0050
 溶液分别滴定水层和有机层、消耗
溶液分别滴定水层和有机层、消耗 溶液的体积为
溶液的体积为
 和
和
 。试分析该方案是否可行,并说明理由
。试分析该方案是否可行,并说明理由
您最近一年使用:0次
2 . 硫化氢(H2S)是一种有害气体,可用多种方法进行脱除。
(1)含H2S的酸性溶液对钢管壁的危害如图1所示,钢管壁内部的缺陷处会积聚H2,产生的压力对管壁造成危害。缺陷处产生H2的微观过程可描述为_____
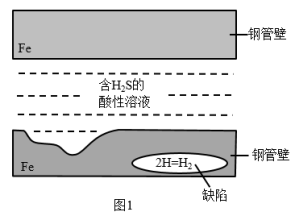
(2)一种转化H2S的燃料电池工作原理如图2所示。该电池工作时,负极的电极反应式为_______ 。
(3)一种脱除H2S回收硫磺工艺的两个阶段主要反应分别如下:
第一阶段: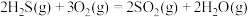
第二阶段:
该工艺需控制第一阶段与第二阶段参加反应的H2S的物质的量之比n1(H2S):n2(H2S)约为1:2。若n1(H2S):n2(H2S)过大,会导致_______ 。
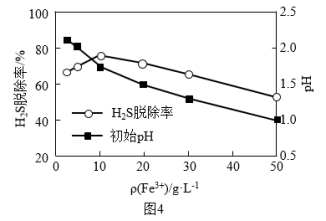
(4)Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图3所示。

①Fe2(SO4)3溶液脱除空气中H2S的总反应化学方程式为_______ 。
②将一定体积含H2S的空气匀速通入Fe2(SO4)3溶液中,反应相同时间,初始Fe3+浓度ρ(Fe3+)及其pH与H2S脱除率的关系如图4所示。当ρ(Fe3+)>10g·L-1,H2S脱除率下降的原因是_______ 。
(1)含H2S的酸性溶液对钢管壁的危害如图1所示,钢管壁内部的缺陷处会积聚H2,产生的压力对管壁造成危害。缺陷处产生H2的微观过程可描述为

(2)一种转化H2S的燃料电池工作原理如图2所示。该电池工作时,负极的电极反应式为

(3)一种脱除H2S回收硫磺工艺的两个阶段主要反应分别如下:
第一阶段:
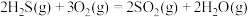
第二阶段:

该工艺需控制第一阶段与第二阶段参加反应的H2S的物质的量之比n1(H2S):n2(H2S)约为1:2。若n1(H2S):n2(H2S)过大,会导致
(4)Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图3所示。

①Fe2(SO4)3溶液脱除空气中H2S的总反应化学方程式为
②将一定体积含H2S的空气匀速通入Fe2(SO4)3溶液中,反应相同时间,初始Fe3+浓度ρ(Fe3+)及其pH与H2S脱除率的关系如图4所示。当ρ(Fe3+)>10g·L-1,H2S脱除率下降的原因是

您最近一年使用:0次
3 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g) + O2(g) ⇌2NO2(g) ∆H;该反应分两步完成,其反应历程如图所示:
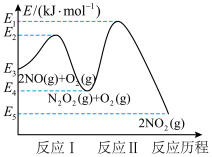
回答下列问题:
①写出反应I的热化学方程式_______ 。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)⇌2NO2(g)反应速率的是_______ (填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_______ (反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)⇌N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
①T℃时,该反应的平衡常数为_______ (保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是_______ 。
(3)NO2存在如下平衡:2NO2(g)⇌N2O4(g) ∆H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_______ ;在图中标出点中,指出能表示反应达到平衡状态的点是_______ 。

(1)NO在空气中存在如下反应:2NO(g) + O2(g) ⇌2NO2(g) ∆H;该反应分两步完成,其反应历程如图所示:

回答下列问题:
①写出反应I的热化学方程式
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)⇌2NO2(g)反应速率的是
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)⇌N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.040 | 0.03 | 0.030 |
| 20 | 0.032 | 0.034 | 0.017 |
①T℃时,该反应的平衡常数为
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是
(3)NO2存在如下平衡:2NO2(g)⇌N2O4(g) ∆H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=

您最近一年使用:0次
名校
解题方法
4 . 1-溴丁烷,为无色透明液体,可用作溶剂及有机合成时的烷基化试剂及中间体等;实验室用1-丁醇、溴化钠和过量的浓硫酸共热制得。该反应的实验装置图(省略加热装置及夹持装置)和有关数据如下:

实验步骤如下:
步骤一:在A中加入20.0 mL蒸馏水,再加入30.0 mL浓H2SO4,振摇冷却至室温,再依次加入18.0mL 1-丁醇及25g NaBr,充分摇振后加入几粒碎瓷片,按上图连接装置,用小火加热至沸,回流40min(此过程中,要经常摇动)。冷却后,改成蒸馏装置,得到粗产品。
步骤二:将粗产品依次用水洗、浓H2SO4洗、水洗、饱和NaHCO3溶液洗,最后再水洗;产物移入干燥的锥形瓶中,用无水CaCl2固体间歇摇动,静置片刻,过滤除去CaCl2固体,进行蒸馏纯化,收集99~103℃馏分,得1-溴丁烷18.0g。
回答下列问题:
(1)已知本实验中发生的第一步反应为NaBr+H2SO4(浓)=HBr↑+NaHSO4,则下一步制备1-溴丁烷的化学方程式为_______ 。
(2)选用下图装置进行步骤二中最后的蒸馏纯化,其中仪器D的名称为_______ 。

(3)通过查阅资料发现实验室制取1-溴丁烷的反应有一定的可逆性,因此步骤一中加入的浓硫酸的作用除了与溴化钠反应生成溴化氢之外还有_______ (从化学平衡的角度来说明)。
(4)该实验中可能生成的有机副产物是_______ 、_______ (写结构简式)。
(5)经步骤一制得的粗产品常呈现黄色,除利用NaHCO3溶液外还可选用下列哪种试剂除去该杂质_______ (填字母)。
a.NaHSO3 b.Na2SO4 c.C2H5OH d.H2O2
(6)步骤二中,用浓硫酸洗的目的是_______ ,用饱和碳酸氢钠溶液洗的目的是洗去硫酸等酸性物质,实验中不能用NaOH溶液来代替,原因是_______ 。
(7)本实验的产率是_______ 。(用百分数表示,结果保留三位有效数字)

| 名称 | 分子量 | 密度g/mL | 沸点(℃) | 溶解性 | ||
| 水 | 乙醇 | 硫酸 | ||||
| 正丁醇 | 74 | 0.810 | 118.0 | 微溶 | 溶 | 溶 |
| 正溴丁烷 | 137 | 1.275 | 101.6 | 不溶 | 溶 | 不溶 |
步骤一:在A中加入20.0 mL蒸馏水,再加入30.0 mL浓H2SO4,振摇冷却至室温,再依次加入18.0mL 1-丁醇及25g NaBr,充分摇振后加入几粒碎瓷片,按上图连接装置,用小火加热至沸,回流40min(此过程中,要经常摇动)。冷却后,改成蒸馏装置,得到粗产品。
步骤二:将粗产品依次用水洗、浓H2SO4洗、水洗、饱和NaHCO3溶液洗,最后再水洗;产物移入干燥的锥形瓶中,用无水CaCl2固体间歇摇动,静置片刻,过滤除去CaCl2固体,进行蒸馏纯化,收集99~103℃馏分,得1-溴丁烷18.0g。
回答下列问题:
(1)已知本实验中发生的第一步反应为NaBr+H2SO4(浓)=HBr↑+NaHSO4,则下一步制备1-溴丁烷的化学方程式为
(2)选用下图装置进行步骤二中最后的蒸馏纯化,其中仪器D的名称为

(3)通过查阅资料发现实验室制取1-溴丁烷的反应有一定的可逆性,因此步骤一中加入的浓硫酸的作用除了与溴化钠反应生成溴化氢之外还有
(4)该实验中可能生成的有机副产物是
(5)经步骤一制得的粗产品常呈现黄色,除利用NaHCO3溶液外还可选用下列哪种试剂除去该杂质
a.NaHSO3 b.Na2SO4 c.C2H5OH d.H2O2
(6)步骤二中,用浓硫酸洗的目的是
(7)本实验的产率是
您最近一年使用:0次
2021-05-10更新
|
327次组卷
|
3卷引用:黑龙江省大庆市大庆实验中学2020-2021学年高二下学期期中考试化学试题
名校
5 . 在某一密闭容器中,若反应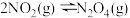 达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是
达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是
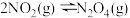 达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是
达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是| A.容器内气体密度减小 | B.平衡向正反应方向移动 |
| C.二氧化氮的转化率增大 | D.四氧化二氮的体积分数增大 |
您最近一年使用:0次
2021-05-07更新
|
216次组卷
|
2卷引用:江苏省苏州市吴中区2020-2021学年高二下学期期中调研测试化学试题
名校
6 . 一定条件下,密闭容器中,1 mol/L X和3 mol/L Y进行反应:X(g)+3Y(g)⇌2Z(g),经2 s达到平衡,此时Z为0.6 mol/L 。下列说法不正确 的是
| A.以X浓度变化表示的反应速率为0.3 mol/(L·s) |
| B.平衡后,Y的平衡浓度为2.1 mol/L |
| C.平衡后,物质X的转化率为30% |
| D.若升高温度,该反应的化学平衡会发生改变 |
您最近一年使用:0次
7 . 下列实验操作、现象和结论均正确的是
| 实验操作 | 实验现象 | 结论 | |
| A | 向两支盛有KI3溶液的试管中分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀生成 | KI3溶液中存在平衡:I  I2+I- I2+I- |
| B | 向0.1molL-1H2O2溶液中滴加0.1mol·L-1KMnO4溶液 | 溶液褪色 | H2O2具有氧化性 |
| C | 用pH试纸分别测CH3COONa溶液和Na2C2O4溶液的pH | CH3COONa溶液的pH约为9,Na2C2O4溶液的pH约为8 | Ka(CH3COOH)<Ka(H2C2O4) |
| D | 向淀粉溶液中加入适量20%的H2SO4溶液,加热,冷却后加入足量NaOH溶液,再滴加少量碘水 | 溶液未变蓝色 | 淀粉已完全水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
20-21高二下·浙江·阶段练习
名校
8 . 已知重铬酸根和铬酸根离子间存在如下平衡: +H2O
+H2O 2
2 +2H+。向试管中加入4 mL0. lmol·L-1K2Cr2O7溶液。下列说法正确的是
+2H+。向试管中加入4 mL0. lmol·L-1K2Cr2O7溶液。下列说法正确的是
 +H2O
+H2O 2
2 +2H+。向试管中加入4 mL0. lmol·L-1K2Cr2O7溶液。下列说法正确的是
+2H+。向试管中加入4 mL0. lmol·L-1K2Cr2O7溶液。下列说法正确的是| A.向试管中加水,平衡向右移动,c(H+)增大 |
| B.向该试管中滴加数滴1 mol·L-1 NaOH溶液,溶液由橙色变为黄色 |
| C.向K2Cr2O7强酸性溶液中加入FeSO4固体,平衡正向移动 |
D.加入催化剂,可提高平衡时 的浓度 的浓度 |
您最近一年使用:0次
9 . (1)下列反应中,属于吸热反应的是___________ (填序号),写出反应⑥的化学方程式___________ 。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ 粉末和
粉末和 粉末反应
粉末反应
(2)已知一定条件下,石墨转化为金刚石时需吸收能量,则石墨和金刚石相比,较稳定的是___________ 。
(3) 、
、 /
/ 可组成高效无污染的燃料电池,则该电池负极的电极反应为
可组成高效无污染的燃料电池,则该电池负极的电极反应为___________ 。
(4)对于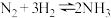 的反应,若一段时间后,
的反应,若一段时间后, 的浓度增加了
的浓度增加了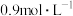 ,用
,用 表示其反应速率为
表示其反应速率为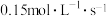 ,则所经过的时间为
,则所经过的时间为___________ 。
(5)氟利昂(如 )会破坏臭氧层,它们破坏臭氧层的机理为:
)会破坏臭氧层,它们破坏臭氧层的机理为:
①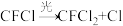 ②
②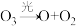
③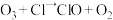 ④
④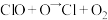
上述反应的总反应式为___________ , 原子在反应中的作用是
原子在反应中的作用是___________ 。
(6)一定条件下,向某恒容密闭容器中充入 和
和 ,发生如下反应:①
,发生如下反应:①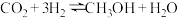 ;②
;②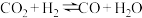 ;③
;③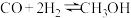 。平衡时,
。平衡时, ,
,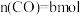 ,则
,则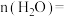
___________  。
。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥
 粉末和
粉末和 粉末反应
粉末反应(2)已知一定条件下,石墨转化为金刚石时需吸收能量,则石墨和金刚石相比,较稳定的是
(3)
 、
、 /
/ 可组成高效无污染的燃料电池,则该电池负极的电极反应为
可组成高效无污染的燃料电池,则该电池负极的电极反应为(4)对于
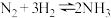 的反应,若一段时间后,
的反应,若一段时间后, 的浓度增加了
的浓度增加了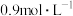 ,用
,用 表示其反应速率为
表示其反应速率为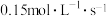 ,则所经过的时间为
,则所经过的时间为(5)氟利昂(如
 )会破坏臭氧层,它们破坏臭氧层的机理为:
)会破坏臭氧层,它们破坏臭氧层的机理为:①
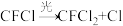 ②
②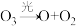
③
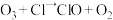 ④
④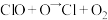
上述反应的总反应式为
 原子在反应中的作用是
原子在反应中的作用是(6)一定条件下,向某恒容密闭容器中充入
 和
和 ,发生如下反应:①
,发生如下反应:①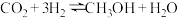 ;②
;②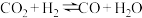 ;③
;③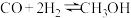 。平衡时,
。平衡时, ,
,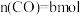 ,则
,则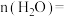
 。
。
您最近一年使用:0次
10 . 下列说法正确的是
A.固氮反应: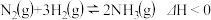 ,升高温度,正反应速率减小 ,升高温度,正反应速率减小 |
B.炭基化法精炼镍: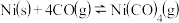 ,增加 ,增加 的用量,可加快该反应速率 的用量,可加快该反应速率 |
C.工业上制水煤气: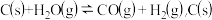 的质量不再改变,反应达到平衡 的质量不再改变,反应达到平衡 |
D.乙苯催化脱氢法制苯乙烯: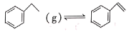 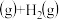 ,恒温恒压下,充入 ,恒温恒压下,充入 ,平衡不移动 ,平衡不移动 |
您最近一年使用:0次



