解题方法
1 . 在4月22日的领导人气候峰会上,习主席表示,中国将力争2030年前实现碳达峰、2060年前实现碳中和。其中 、
、 的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
(1)室温下, 溶液呈碱性的原因是
溶液呈碱性的原因是___________ (用离子方程式表示)。
(2)已知: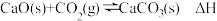
①
___________ 0(填或“<”、“=”或“<”)
②分别将20g、40g的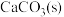 放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡(
放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡( 都未完全分解),则两容器中分解的
都未完全分解),则两容器中分解的 的物质的量关系:
的物质的量关系:
___________ 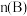 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(3)利用二氧化碳加氢合成甲醇,既能缓解环境问题,又能解决能源危机。涉及以下主要反应:
反应Ⅰ: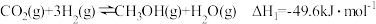
反应Ⅱ: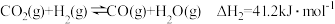
在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示
的平衡产率随温度的变化关系如下图所示
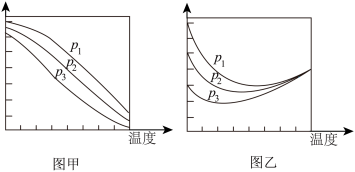
①下列说法正确的是___________
A.
B.图甲纵坐标表示 的平衡产率,图乙纵坐标表示
的平衡产率,图乙纵坐标表示 的平衡产率
的平衡产率
C.一定温度、压强下,寻找活性更高的催化剂,是提高 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向
D.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压的反应条件
的平衡产率,应选择低温、高压的反应条件
②图乙中压强一定时,曲线随温度变化先降后升的原因是:___________ ;图乙中三条曲线在某温度时交于一点的原因是:___________
③在一定温度下,控制容器体积1L保持不变,测得 平衡转化率为60%,其中甲醇的选择性为
平衡转化率为60%,其中甲醇的选择性为 ,请计算该温度下反应Ⅰ的平衡常数K=
,请计算该温度下反应Ⅰ的平衡常数K=___________
(4)二氧化碳与氢气以1:3投料比合成甲醇常采用铜基催化剂,测得 随时间变化如图所示。研究发现,采用
随时间变化如图所示。研究发现,采用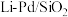 代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用
代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用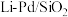 催化剂作用下,
催化剂作用下, 随时间变化的曲线
随时间变化的曲线___________ 。

 、
、 的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:(1)室温下,
 溶液呈碱性的原因是
溶液呈碱性的原因是(2)已知:
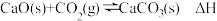
①

②分别将20g、40g的
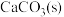 放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡(
放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡( 都未完全分解),则两容器中分解的
都未完全分解),则两容器中分解的 的物质的量关系:
的物质的量关系:
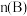 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(3)利用二氧化碳加氢合成甲醇,既能缓解环境问题,又能解决能源危机。涉及以下主要反应:
反应Ⅰ:
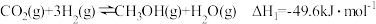
反应Ⅱ:
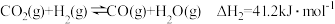
在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示
的平衡产率随温度的变化关系如下图所示
①下列说法正确的是
A.

B.图甲纵坐标表示
 的平衡产率,图乙纵坐标表示
的平衡产率,图乙纵坐标表示 的平衡产率
的平衡产率C.一定温度、压强下,寻找活性更高的催化剂,是提高
 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向D.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压的反应条件
的平衡产率,应选择低温、高压的反应条件②图乙中压强一定时,曲线随温度变化先降后升的原因是:
③在一定温度下,控制容器体积1L保持不变,测得
 平衡转化率为60%,其中甲醇的选择性为
平衡转化率为60%,其中甲醇的选择性为 ,请计算该温度下反应Ⅰ的平衡常数K=
,请计算该温度下反应Ⅰ的平衡常数K=(4)二氧化碳与氢气以1:3投料比合成甲醇常采用铜基催化剂,测得
 随时间变化如图所示。研究发现,采用
随时间变化如图所示。研究发现,采用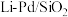 代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用
代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用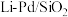 催化剂作用下,
催化剂作用下, 随时间变化的曲线
随时间变化的曲线
您最近一年使用:0次
2 . 在化学发展史上,许多理论对化学科学的发展起到了重要作用。下列利用化学理论解释化学事实不正确的是
| A.用平衡移动原理解释钟乳石的形成 |
B.用元素周期律解释反应 |
C.用能量最低原理解释钾原子的电子排布式为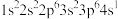 |
D.用杂化轨道理论解释 是正四面体空间结构 是正四面体空间结构 |
您最近一年使用:0次
2021-07-07更新
|
144次组卷
|
2卷引用:湖北省襄阳市、宜昌市、荆州市、荆门市等七市2020-2021学年高二下学期期末考试化学试题
3 . 某已平衡的化学可逆反应,下列有关叙述正确的是
| A.使用合适的催化剂可以使平衡正向移动 |
| B.升高温度,平衡一定正向移动 |
| C.增加生成物的质量,平衡一定逆向移动 |
| D.有气体参加的可逆反应,减小体积增大压强能够加快反应速率 |
您最近一年使用:0次
2021-07-04更新
|
748次组卷
|
5卷引用:河南省2020-2021学年高二下学期领军考试7月联考化学试题
河南省2020-2021学年高二下学期领军考试7月联考化学试题(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)课前-2.4 化学反应的调控-课前、课中、课后(人教版2019选择性必修1)河南省豫南重点高中2021-2022学年高二上学期精英对抗赛化学试题福建省泉州科技中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
4 . 能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
II.2CH3OH(g) CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2
III.CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=___________ (用含△H1、△H2、△H3的代数表示)。
(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
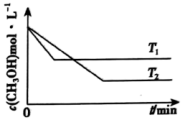
①△H___________ (填“>”“<”或“=”)0,说明理由___________ 。
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________ (填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为___________ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡___________ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1
III.CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为___________ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为___________ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1II.2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2III.CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3则3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
①△H
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1III.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为
您最近一年使用:0次
2021-07-02更新
|
1679次组卷
|
7卷引用:广西河池市九校2020-2021学年高二下学期第二次联考化学试题
广西河池市九校2020-2021学年高二下学期第二次联考化学试题(已下线)第2章 化学反应速率和化学平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)重庆市缙云教育联盟2021-2022学年高三10月质量检测化学试题(已下线)2.2.3 影响化学平衡的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河南宏力学校2021-2022学年高二上学期期中考试化学试题(已下线)第二章 化学反应速率与化学平衡(B卷·能力提升练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)浙江省杭师大附中2022-2023学年高二上学期期中考试 化学试题
解题方法
5 . 大气、水体常见污染元素主要有氮、硫。含氮废气、废液处理是化学学科重要研究课题。
(1)在含 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是___ 。
(2)用NaClO可以将氨氮(NH3、NH )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式___ 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。
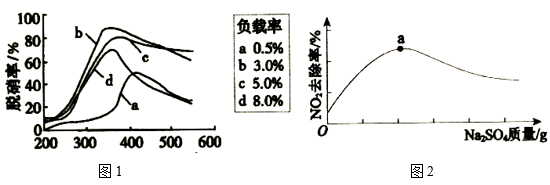
为达到最佳的脱硝效果,应采取的反应条件为___ (填温度和负载率数值)。
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+ (aq)
(aq) CaSO4(s)+
CaSO4(s)+ (aq)
(aq)
Ⅱ. (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq)
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是___ 。
(1)在含
 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是(2)用NaClO可以将氨氮(NH3、NH
 )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。

为达到最佳的脱硝效果,应采取的反应条件为
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+
 (aq)
(aq) CaSO4(s)+
CaSO4(s)+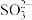 (aq)
(aq)Ⅱ.
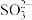 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq) 浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是
您最近一年使用:0次
2021-06-30更新
|
141次组卷
|
2卷引用:江苏省宿迁市2020-2021学年高二下学期期末考试化学试题
6 . 金属铝有广泛的应用,有人对碳还原氧化铝制备铝进行了实验研究。在2.0 L真空密闭容器中稍过量石墨与1.0 mol Al2O3混合后加热,图1是体系压强随着加热时间变化的曲线图,图2是在不同的恒定温度下,反应达到平衡,冷却后容器内剩余固体中部分 含铝元素物质的物质的量随温度变化曲线图。

已知:1.01×105 Pa下Al熔点933 K,沸点2700 K;10 Pa下Al沸点低于1000 K,Al2O3和C沸点高于2000 K。
反应I:Al2O3(s)+3C(s) 2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
反应II:2Al2O3(s)+9C(s) Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
反应III:Al2O3(s)+Al4C3(s) 6Al(s)+3CO(g) △H3
6Al(s)+3CO(g) △H3
请回答下列问题:
(1)工业上电解法冶炼铝的化学方程式为___ 。
(2)△H3=___ 。
(3)图1中石墨与Al2O3混合物加热至150 min时容器内温度约为___ 。
(4)从反应自发性推测,实验室进行碳还原氧化铝制备铝的实验需要在真空容器中进行,可能的原因是___ 。
(5)由图2可得1650 K时,反应I的平衡常数K=___ 。
(6)下列说法不正确 的是___ 。
A.图1中约170 min后体系压强很快减小可能是反应I、II急剧发生,吸收了大量的热,容器内温度降低,导致反应I、II平衡向逆方向移动
B.图2显示约1650~1700 K之间是石墨与Al2O3反应制备Al的最佳温度
C.图2中T≥1700K时体系中一定还发生了其他副反应
D.综合分析可得,碳还原氧化铝制备铝比电解法成本更低,产率更高,适合大规模应用
(7)请在图3中画出温度在1450-1650 K之间2.0 L真空密闭容器中CO的浓度随温度变化曲线图___ 。


已知:1.01×105 Pa下Al熔点933 K,沸点2700 K;10 Pa下Al沸点低于1000 K,Al2O3和C沸点高于2000 K。
反应I:Al2O3(s)+3C(s)
 2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1反应II:2Al2O3(s)+9C(s)
 Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1反应III:Al2O3(s)+Al4C3(s)
 6Al(s)+3CO(g) △H3
6Al(s)+3CO(g) △H3请回答下列问题:
(1)工业上电解法冶炼铝的化学方程式为
(2)△H3=
(3)图1中石墨与Al2O3混合物加热至150 min时容器内温度约为
(4)从反应自发性推测,实验室进行碳还原氧化铝制备铝的实验需要在真空容器中进行,可能的原因是
(5)由图2可得1650 K时,反应I的平衡常数K=
(6)下列说法
A.图1中约170 min后体系压强很快减小可能是反应I、II急剧发生,吸收了大量的热,容器内温度降低,导致反应I、II平衡向逆方向移动
B.图2显示约1650~1700 K之间是石墨与Al2O3反应制备Al的最佳温度
C.图2中T≥1700K时体系中一定还发生了其他副反应
D.综合分析可得,碳还原氧化铝制备铝比电解法成本更低,产率更高,适合大规模应用
(7)请在图3中画出温度在1450-1650 K之间2.0 L真空密闭容器中CO的浓度随温度变化曲线图

您最近一年使用:0次
解题方法
7 . 尿素[ ]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
(1)合成:氨气加压并预热后与压缩的二氧化碳在合成塔中反应生成尿素。
①氨气加压并预热的作用是___________ 。
②合成尿素的化学方程式是___________ 。该反应属于___________ 反应(填“氧化还原”或“非氧化还原”)。
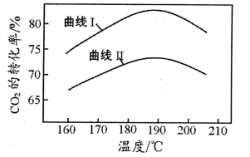
③合成中氨碳比[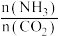 ]分别为3和4时,
]分别为3和4时, 的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为
的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为___________ ,反应最适宜温度为___________ 。
(2)分离:尿素水溶液经二段蒸发分离得到尿素。尿素水溶液在加热蒸发过程中会部分水解成碳酸铵或碳酸氢铵。
①尿素熔点132.7℃,沸点196.6℃,尿素晶体属于___________ 晶体。
②尿素水解生成碳酸铵的化学方程式为___________ 。
 ]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
(1)合成:氨气加压并预热后与压缩的二氧化碳在合成塔中反应生成尿素。
①氨气加压并预热的作用是
②合成尿素的化学方程式是
③合成中氨碳比[
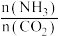 ]分别为3和4时,
]分别为3和4时, 的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为
的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为(2)分离:尿素水溶液经二段蒸发分离得到尿素。尿素水溶液在加热蒸发过程中会部分水解成碳酸铵或碳酸氢铵。
①尿素熔点132.7℃,沸点196.6℃,尿素晶体属于
②尿素水解生成碳酸铵的化学方程式为
您最近一年使用:0次
8 . 甲醇是重要的化工原料,又可作为燃料。以CO2和H2为原料生产甲醇时,同时发生下列两个反应,反应的热化学方程式如下:
I.
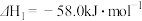
II.
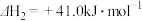
(1)上述两个反应中,在热力学上趋势较大的是____ (填反应代号)。
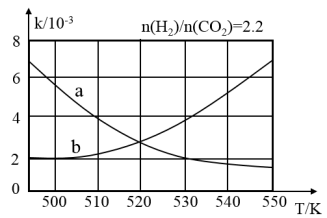
(2)下图中表示反应II平衡常数K随温度变化关系的曲线为__ (填曲线标记字母),其判断依据是___ 。
(3)CO和H2反应也可生成气态甲醇。相关的化学键键能数据如下:
①则x=______ 。
②CO和H2生成甲醇的反应,体系总压强为P MPa恒定,在温度T时,起始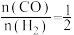 ,若到达平衡时,CO的转化率为50%,则平衡常数Kp=
,若到达平衡时,CO的转化率为50%,则平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)某实验室控制CO2和H2初始投料比为1:2.2。在相同压强下,发生I、II两个反应,经过相同反应时间测得如下实验数据如图A、图B所示:
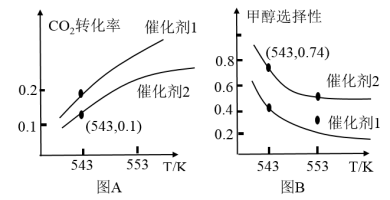
①有利于提高CO2转化为CH3OH平衡转化率的措施有_______ 。
A.使用催化剂1
B.增大CO2和H2的初始投料比
C.使用催化剂2
D.投料比不变,增加反应物的浓度
②在催化剂2的作用下,543 K时,CO的选择性(CO2转化为CO的体积百分比)为____ ,H2的转化率为____ (保留两位有效数字)。
I.

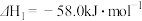
II.

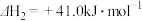
(1)上述两个反应中,在热力学上趋势较大的是
(2)下图中表示反应II平衡常数K随温度变化关系的曲线为

(3)CO和H2反应也可生成气态甲醇。相关的化学键键能数据如下:
| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 |  |
①则x=
②CO和H2生成甲醇的反应,体系总压强为P MPa恒定,在温度T时,起始
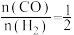 ,若到达平衡时,CO的转化率为50%,则平衡常数Kp=
,若到达平衡时,CO的转化率为50%,则平衡常数Kp=(4)某实验室控制CO2和H2初始投料比为1:2.2。在相同压强下,发生I、II两个反应,经过相同反应时间测得如下实验数据如图A、图B所示:

①有利于提高CO2转化为CH3OH平衡转化率的措施有
A.使用催化剂1
B.增大CO2和H2的初始投料比
C.使用催化剂2
D.投料比不变,增加反应物的浓度
②在催化剂2的作用下,543 K时,CO的选择性(CO2转化为CO的体积百分比)为
您最近一年使用:0次
2021-06-28更新
|
474次组卷
|
2卷引用:河南省开封市五县联考2020-2021学年高二下学期期末考试化学试题
9 . Ⅰ.电解法制取有广泛用途的Na2FeO4,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

(1)电解过程中,阳极电极反应式___ 。
(2)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:___ 。
(3)有实验表明用铁粉末压制的“粉末铁”做阳极比用纯铁块做阳极能够获得更高的浓度和产量,试分析原因:___ 。
Ⅱ.在酸性介质中HNO2参加的氧化还原反应速率相当快。实验表明HNO2加入酸性NaI溶液,HNO2将I-氧化成I2的过程由3步反应组成:
①HNO2(aq)+H+((aq)=NO+(aq)+H2O(1)②___;③2ONI(aq)=I2(aq)+2NO↑
(1)写出第②步反应的离子方程式___ 。
(2)在溶液中存在化学平衡:I2(aq)+NaI(aq) NaI3(aq),其平衡常数表达式为
NaI3(aq),其平衡常数表达式为___ 。
Ⅲ.合成氨工业中的原料气H2可以利用如下反应获取CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4kJ•mol-1Ea=240.1kJ•mol-1
(1)一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___ 。
A.升高温度 B.增大水蒸气浓度
C.选择性能优良的催化剂 D.投料比不变,增大反应物浓度
(2)该反应的逆反应活化能Ea′=___ kJ•mol-1。
 ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
(1)电解过程中,阳极电极反应式
(2)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:
(3)有实验表明用铁粉末压制的“粉末铁”做阳极比用纯铁块做阳极能够获得更高的浓度和产量,试分析原因:
Ⅱ.在酸性介质中HNO2参加的氧化还原反应速率相当快。实验表明HNO2加入酸性NaI溶液,HNO2将I-氧化成I2的过程由3步反应组成:
①HNO2(aq)+H+((aq)=NO+(aq)+H2O(1)②___;③2ONI(aq)=I2(aq)+2NO↑
(1)写出第②步反应的离子方程式
(2)在溶液中存在化学平衡:I2(aq)+NaI(aq)
 NaI3(aq),其平衡常数表达式为
NaI3(aq),其平衡常数表达式为Ⅲ.合成氨工业中的原料气H2可以利用如下反应获取CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4kJ•mol-1Ea=240.1kJ•mol-1
(1)一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
A.升高温度 B.增大水蒸气浓度
C.选择性能优良的催化剂 D.投料比不变,增大反应物浓度
(2)该反应的逆反应活化能Ea′=
您最近一年使用:0次
10 . 对于反应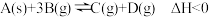 ,下列说法正确的是
,下列说法正确的是
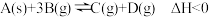 ,下列说法正确的是
,下列说法正确的是| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.该反应△S>0,△H<0,在任何条件下能自发进行 |
| C.恒温恒容条件下,混合气体密度不变达到化学平衡状态 |
| D.达到平衡状态后,若增加A的量,平衡向正反应方向移动 |
您最近一年使用:0次
2021-06-28更新
|
917次组卷
|
6卷引用:浙江省嘉兴市2020-2021学年高二下学期期末检测化学试题
浙江省嘉兴市2020-2021学年高二下学期期末检测化学试题(已下线)第二章 第四节 化学反应进行的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)专题2.3 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)浙江省天台中学2021-2022学年高二上学期返校考试化学试题辽宁省葫芦岛市第八高级中学2021-2022学年高二上学期实验班第一次月考化学试题(已下线)考点24 化学反应的方向-备战2023年高考化学一轮复习考点帮(全国通用)



