1 . 制备金属钾的反应:Na+KCl K+NaCl,有关数据的沸点如下:
K+NaCl,有关数据的沸点如下:
下列说法不正确的是
 K+NaCl,有关数据的沸点如下:
K+NaCl,有关数据的沸点如下:| 物质 | K | Na | KCl | NaCl |
| 沸点/℃ | 759 | 883 | 1420 | 1465 |
| A.该反应的发生不能说明Na的金属性强于K |
| B.升温至900℃,收集金属钾,钾的纯度会更高 |
| C.金属钾中含有杂质钠,可通过真空蒸馏的方法分离提纯 |
| D.850℃时,钾蒸气逸出,平衡正向移动,KCl的转化率增大 |
您最近一年使用:0次
名校
2 . 对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A.Cl2+H2O HCl+HClO,氯水中加入碳酸钙,漂白性增强 HCl+HClO,氯水中加入碳酸钙,漂白性增强 |
B.ZnS + Cu2+ CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS) CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS) |
C.2NO2 N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅 N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅 |
D.Cr2O72-(橙色)+H2O 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深 |
您最近一年使用:0次
2019-12-19更新
|
1123次组卷
|
10卷引用:山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题
山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题北京市朝阳区2018-2019学年高二第二学期期末统一考试化学试题河北省张家口市第一中学2019-2020学年高二12月月考(实验班)化学试题江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题湖北省荆州中学、宜昌一中两校2019-2020学年高二上学期期末考试化学试题新疆昌吉市教育共同体2019-2020学年高二年级上学期期末考试化学试题第2章《化学键 化学反应规律》单元测试——鲁科版(2019)必修第二册2020年北京高二下学期 复习模拟试题二(选修4人教版)新疆阿勒泰地区2020-2021学年高二上学期期末考试化学试题黑龙江省鸡东二中2020-2021学年高二上学期期末考试化学试题
名校
3 . 反应2X(g)⇌2Y(g)+2Z(g)△H>0达到平衡时,要使正反应速率降低,X的浓度增大,应采取的措施是( )
| A.加压 | B.减压 | C.减小Z的浓度 | D.降温 |
您最近一年使用:0次
名校
4 . 在一恒容密闭容器中,反应:A(g)+B(g) 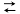 C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
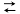 C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )| A.A的浓度一定比原平衡小 |
| B.A的转化率增大 |
| C.C的体积分数一定大于原平衡C的体积分数 |
| D.B的转化率一定增大 |
您最近一年使用:0次
2019-11-22更新
|
298次组卷
|
9卷引用:山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题
山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题新疆昌吉市教育共同体2019-2020学年高二上学期期中考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题(已下线)2.3.1 浓度对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)云南省砚山县第二高级中学2021-2022学年高二下学期期中(4月)考试化学试题第2课时 浓度、压强对化学平衡的影响云南省普洱市云南省思茅第一中学2022-2023学年高二下学期6月月考化学试题(已下线)专题05 影响化学平衡的因素【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题
真题
名校
5 . 在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
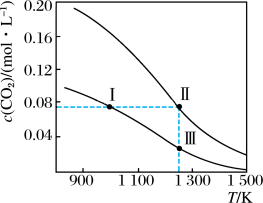
 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.反应CO2(g)+C(s)  2CO(g)的ΔS>0、ΔH<0 2CO(g)的ΔS>0、ΔH<0 |
| B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
| D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
您最近一年使用:0次
2019-11-21更新
|
1546次组卷
|
35卷引用:山西大学附属中学2020-2021学年高二上学期期中考试化学试题
山西大学附属中学2020-2021学年高二上学期期中考试化学试题2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2015-2016学年江苏省南通中学高二上学期期末化学试卷2015-2016学年山东省淄博六中高二上学期期末化学试卷2015-2016学年安徽省蚌埠二中高二下学期期中化学试卷2016-2017学年河北省冀州中学高二上期中化学卷2016-2017学年河北省邢台一中高二上月考二化学卷2016-2017学年四川省成都七中高二上11月考试化学卷安徽师范大学附属中学2017-2018学年高二上学期10月月考化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题河南省南阳市第一中学2017-2018学年高二上学期第二次月考化学试题安徽师范大学附属中学2017-2018学年高二上学期期中考查化学试题江西省南昌市第二中学2017-2018学年高二上学期期中考试化学试题江西省南昌二中2017-2018学年高二上学期期中考试化学试卷内蒙古杭锦后旗奋斗中学2017-2018学年高二下学期第一次月考化学试题江西省宁都中学2018-2019学年高二上学期期中考试化学试题【全国百强校】四川省成都市成都外国语学校2018-2019学年高二上学期12月月考化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略黑龙江省哈尔滨师范大学附属中学2019-2020学年高二上学期期中考试化学试题四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题江西省高安中学2019-2020学年高二上学期期末考试化学(A卷)试题安徽省滁州市民办高中2019-2020学年高二上学期期末考试化学试题江西省高安中学2019-2020学年高二上学期期末考试化学(B卷)试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分河南省漯河市临颍县南街高级中学2019-2020学年高二下学期期末考试化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题浙江省绍兴市柯桥区2021届高三下学期6月选考科目考试化学试题山东省青岛第二中学2020-2021学年高二上学期期中考试化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题15 化学平衡图像-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
6 . 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )容器1 | 容器2 | 容器3 | |
| 应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
| 平衡v正(SO2)/mol•L-1•S-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol•L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
| A. v1< v2,c2<2c1 | B. K1> K3,p2>2p3 |
| C.v1< v3,α1(SO2 ) <α2(SO2 ) | D. c2>2c3,α2(SO3 )+α3(SO2 )<1 |
您最近一年使用:0次
2019-11-14更新
|
1904次组卷
|
12卷引用:【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期10月模块诊断化学试题
【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期10月模块诊断化学试题【全国百强校】黑龙江省大庆实验中学2018-2019学年高二上学期10月月考化学试题【全国百强校】山东省泰安市第一中学2018-2019学年高二上学期期中考试化学试题【校级联考】福建省晋江市(安溪一中、养正中学、惠安一中、泉州实验中学四校)2018-2019学年高二上学期期中考试化学试题福建省福清市华侨中学2018-2019学年高二下学期期中考试化学试题江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题河南省南阳市南阳一中2019-2020学年高二上期第三次月考化学试题步步为赢 高二化学寒假作业:综合检测(一)2019年秋高三化学复习强化练习—— 等效平衡山东省泰安第二中学2021-2022学年高二上学期期中考试化学试题新疆塔城地区第二中学2022-2023学年高二上学期11月月考化学试题
名校
7 . 已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是
| A.向甲容器中充入一定量的氦气 |
| B.向乙容器中充入一定量的N2 |
| C.升高乙容器的温度 |
| D.增大甲容器的压强 |
您最近一年使用:0次
2019-10-29更新
|
289次组卷
|
9卷引用:山西省朔州市平鲁区李林中学2018-2019学年高二上学期第一次月考化学试题
山西省朔州市平鲁区李林中学2018-2019学年高二上学期第一次月考化学试题安徽省砀山县第二中学2019-2020学年高二10月月考化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第二次月考化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题云南省丘北县第一中学校2021-2022学年高二下学期开学考试化学试题云南省玉溪市江川区第二中学2021-2022学年高二下学期开学考试化学试题四川省成都外国语学校2022-2023学年高二上学期12月月考化学试题安徽省合肥市第六中学2022-2023学年高二下学期3月段考化学试题作业(九) 温度、催化剂对化学平衡的影响
名校
8 . 某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)  2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )

 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
| A.若T2<T1,则正反应一定是放热反应 |
| B.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a |
| C.达到平衡时A2的转化率大小为b>a>c |
| D.若T2<T1,达到平衡时b、d点的反应速率为vd>vb |
您最近一年使用:0次
2019-10-11更新
|
232次组卷
|
4卷引用:山西大学附属中学2019-2020学年高二10月月考化学试题
名校
9 . 下列事实中,不能用勒夏特列原理解释的是
| A.氨水应密闭保存,放置于低温处 |
B.对2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深 |
| C.生产硝酸的过程中使用过量空气以提高氨气的利用率 |
D.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
您最近一年使用:0次
2019-09-30更新
|
480次组卷
|
4卷引用:山西省临猗县临晋中学2020-2021学年高二9月月考化学试题
10 . 下列事实,不能用勒夏特列原理解释的是
| A.高压比常压有利于合成SO3 |
| B.合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
| C.对CO(g)+NO2(g)⇌CO2(g)+NO(g)平衡体系增大压强可使颜色变深 |
| D.溴水中有平衡:Br2+H2O⇌HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 |
您最近一年使用:0次
2019-09-17更新
|
100次组卷
|
2卷引用:山西省长治市第二中学2018-2019学年高一下学期期末考试化学试题



