名校
解题方法
1 . I:室温下,通过下列实验探究 溶液的性质。
溶液的性质。
依据实验操作和现象,回答下列问题:
(1)向0.1mol/L 溶液滴入酚酞溶液,观察到的现象是
溶液滴入酚酞溶液,观察到的现象是___________ ,原因___________ (用离子方程式表示)。
(2)实验3中随 的不断通入,溶液中
的不断通入,溶液中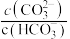
___________ (填减小、不变或增大)。
(3)常温下, 均为12的
均为12的 溶液与NaOH溶液中水电离出的
溶液与NaOH溶液中水电离出的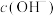 之比为
之比为___________ 。
Ⅱ:① 溶液②
溶液② 溶液③
溶液③ 溶液④
溶液④ 气体⑤碘水⑥氨水⑦
气体⑤碘水⑥氨水⑦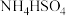 溶液
溶液
(4)向②中通入足量④,发生反应的离子方程式为___________ 。
(5)为得到浓度较大的⑤,实验室在配制时,常加入 ,溶液中存在如下平衡:
,溶液中存在如下平衡: ,向⑤中加入一定量的①,该平衡将
,向⑤中加入一定量的①,该平衡将___________ (填“正向”或“逆向”)移动。
Ⅲ:
(6)泡沫灭火器原理(用离子方程式表示):___________
(7)配置 溶液为什么要将
溶液为什么要将 固体溶解在浓盐酸中(用离子方程式表示):
固体溶解在浓盐酸中(用离子方程式表示):___________
(8)加热蒸干 为什么得不到
为什么得不到 原理(用化学方程式表示):
原理(用化学方程式表示):___________
 溶液的性质。
溶液的性质。| 实验 | 实验操作和现象 |
| 1 | 用 试纸测定0.1mol/L 试纸测定0.1mol/L 溶液的 溶液的 ,测得 ,测得 约为12 约为12 |
| 2 | 向0.1mol/L 溶液中加入过量0.2mol/L 溶液中加入过量0.2mol/L 溶液,产生白色沉淀 溶液,产生白色沉淀 |
| 3 | 向0.1mol/L 溶液中通入过量 溶液中通入过量 ,测得溶液 ,测得溶液 约为8 约为8 |
| 4 | 向0.1mol/L 溶液中滴加几滴0.05mol/L 溶液中滴加几滴0.05mol/L ,观察不到实验现象 ,观察不到实验现象 |
(1)向0.1mol/L
 溶液滴入酚酞溶液,观察到的现象是
溶液滴入酚酞溶液,观察到的现象是(2)实验3中随
 的不断通入,溶液中
的不断通入,溶液中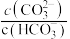
(3)常温下,
 均为12的
均为12的 溶液与NaOH溶液中水电离出的
溶液与NaOH溶液中水电离出的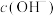 之比为
之比为Ⅱ:①
 溶液②
溶液② 溶液③
溶液③ 溶液④
溶液④ 气体⑤碘水⑥氨水⑦
气体⑤碘水⑥氨水⑦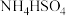 溶液
溶液(4)向②中通入足量④,发生反应的离子方程式为
(5)为得到浓度较大的⑤,实验室在配制时,常加入
 ,溶液中存在如下平衡:
,溶液中存在如下平衡: ,向⑤中加入一定量的①,该平衡将
,向⑤中加入一定量的①,该平衡将Ⅲ:
(6)泡沫灭火器原理(用离子方程式表示):
(7)配置
 溶液为什么要将
溶液为什么要将 固体溶解在浓盐酸中(用离子方程式表示):
固体溶解在浓盐酸中(用离子方程式表示):(8)加热蒸干
 为什么得不到
为什么得不到 原理(用化学方程式表示):
原理(用化学方程式表示):
您最近半年使用:0次
名校
解题方法
2 . 表中实验操作、现象与结论对应关系均正确的
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取2mL0.lmol/LAgNO3溶液,先后滴加3滴0.lmol/LNaCl溶液和6滴0.lmol/LKI溶液,观察沉淀情况 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)大于Ksp(AgI) |
| B | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY弱 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测定pH=3.2 | NaHSO3溶液呈酸性,证明 在水中的电离程度大于水解程度 在水中的电离程度大于水解程度 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
3 . Ⅰ.高铁电池:高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,并且以其为主体的高铁电池研制也在进行中。如图所示是高铁电池的模拟实验装置。___________ 。
(2)盐桥中盛有饱和 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动。
(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有:___________ 。
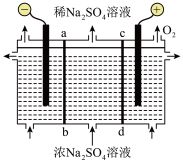
利用如图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜,可进行烧碱与硫酸的制备。___________ ,ab为___________ (填“阴”或“阳”)离子交换膜。阳极对应的电极反应式:___________ 。
Ⅲ.碱性银锌二次航空电池为价格昂贵的高能电池。
该电池的总反应为: ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下: ___________ (填“正极”或“负极”)。
(6)以 溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
反应(ⅰ)锌电极板的溶解:
反应(ⅱ)锌电极板上 的析出:
的析出:
放电时,析出的 会覆盖在锌电极板表面,影响电池使用效果。用浓
会覆盖在锌电极板表面,影响电池使用效果。用浓 溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:___________ 。
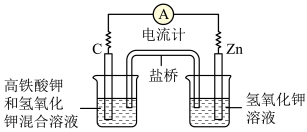
(2)盐桥中盛有饱和
 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有:

利用如图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜,可进行烧碱与硫酸的制备。
Ⅲ.碱性银锌二次航空电池为价格昂贵的高能电池。
该电池的总反应为:
 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下: 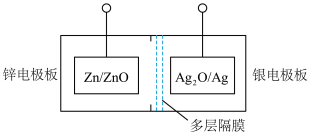
(6)以
 溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:反应(ⅰ)锌电极板的溶解:

反应(ⅱ)锌电极板上
 的析出:
的析出:
放电时,析出的
 会覆盖在锌电极板表面,影响电池使用效果。用浓
会覆盖在锌电极板表面,影响电池使用效果。用浓 溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
您最近半年使用:0次
名校
4 . 实验室以二氧化铈( )废渣为原料制备
)废渣为原料制备 含量少的
含量少的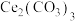 ,其部分实验过程如下:
,其部分实验过程如下:
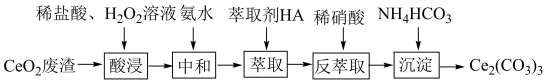
(1)“酸浸”时 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为___________
(2)pH约为7的 溶液与
溶液与 溶液反应可生成
溶液反应可生成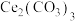 沉淀,同时放出
沉淀,同时放出 ,该沉淀中
,该沉淀中 含量与加料方式有关。
含量与加料方式有关。
①得到含 量较少的
量较少的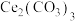 的加料方式为
的加料方式为___________ (填序号)。
A.将 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中
② 溶液与
溶液与 溶液反应的离子方程式:
溶液反应的离子方程式:___________
(3)通过中和、萃取、反萃取、沉淀等过程,可制备 含量少的
含量少的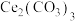 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是___________ 。
②反萃取的目的是将有机层 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有___________ 。
(4)实验中需要测定溶液中 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的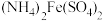 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取25.00 mL
。请补充完整实验方案:①准确量取25.00 mL  溶液[
溶液[ 约为
约为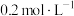 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
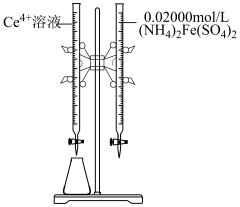
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将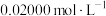
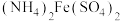 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③___________
 )废渣为原料制备
)废渣为原料制备 含量少的
含量少的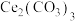 ,其部分实验过程如下:
,其部分实验过程如下:
(1)“酸浸”时
 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为(2)pH约为7的
 溶液与
溶液与 溶液反应可生成
溶液反应可生成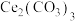 沉淀,同时放出
沉淀,同时放出 ,该沉淀中
,该沉淀中 含量与加料方式有关。
含量与加料方式有关。①得到含
 量较少的
量较少的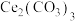 的加料方式为
的加料方式为A.将
 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中②
 溶液与
溶液与 溶液反应的离子方程式:
溶液反应的离子方程式:(3)通过中和、萃取、反萃取、沉淀等过程,可制备
 含量少的
含量少的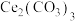 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是
②反萃取的目的是将有机层
 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(4)实验中需要测定溶液中
 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的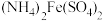 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取25.00 mL
。请补充完整实验方案:①准确量取25.00 mL  溶液[
溶液[ 约为
约为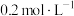 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将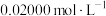
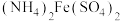 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③
您最近半年使用:0次
5 . 一定温度时,恒容密闭容器中发生反应:2HI(g)⇌H2(g)+I2(g),达平衡充入HI(g)。下列说法错误的是
| A.平衡向正反应方向移动 | B.HI的分解率不变 |
| C.HI的百分含量不变 | D.气体颜色深浅不变 |
您最近半年使用:0次
名校
解题方法
6 . 苯酚是重要的有机化工原料,还可用作溶剂、实验试剂和消毒剂,苯酚的水溶液可以使植物细胞内染色体上蛋白质与DNA分离,便于对DNA进行染色,实验小组同学查阅文献后进行苯酚的制备和相关性质的探究。回答下列问题:
I.苯酚的制备
工业上用异丙苯氧化法合成苯酚,其合成原理如下:
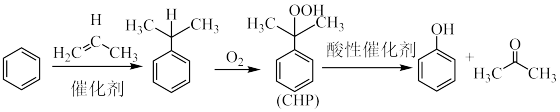
已知:①过氧化氢异丙苯基(CHP)受热易分解。
②相关化合物的物理常数如下表所示:
③苯酚显色反应的原理为 。
。
(1)苯和丙烯在催化下发生烷基化反应生成异丙苯,异丙苯经 氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是
氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是___________ ,___________ 。
(2)过氧化氢异丙苯基(CHP)在酸性催化剂作用下分解为苯酚和丙酮,再通过蒸馏得到高纯度苯酚。蒸馏时先得到的馏分是___________ 。在蒸馏操作中,下列仪器安装正确的是___________ (填标号)。
A.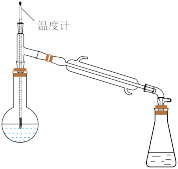 B.
B.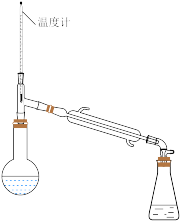 C.
C.  D.
D.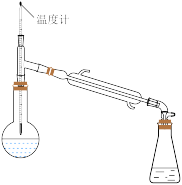
(3)若检验丙酮中是否存在苯酚杂质,可选择的试剂是___________(填标号)。
Ⅱ.探究铁离子与苯酚的显色反应
实验1:

实验2:

【提出猜想】
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(4)若向实验1反应后溶液中继续加入NaCl固体,溶液颜色无变化,由此得出的结论是___________ 。
(5)若向实验1反应后溶液中加入___________ 固体(填化学式),溶液颜色变为浅紫色,说明猜想2成立。
(6)实验小组同学提出猜想3:溶液的pH会影响显色效果。设计如下实验:
①实验ⅱ中红褐色沉淀是___________ (填化学式)。
②实验ⅲ中继续滴加过量盐酸,溶液由紫色变为浅黄色的原因是___________ 。
I.苯酚的制备
工业上用异丙苯氧化法合成苯酚,其合成原理如下:

已知:①过氧化氢异丙苯基(CHP)受热易分解。
②相关化合物的物理常数如下表所示:
| 物质 | 相对分子质量 | 密度/( ) ) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
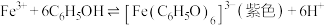 。
。(1)苯和丙烯在催化下发生烷基化反应生成异丙苯,异丙苯经
 氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是
氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是(2)过氧化氢异丙苯基(CHP)在酸性催化剂作用下分解为苯酚和丙酮,再通过蒸馏得到高纯度苯酚。蒸馏时先得到的馏分是
A.
 B.
B. C.
C.  D.
D.
(3)若检验丙酮中是否存在苯酚杂质,可选择的试剂是___________(填标号)。
| A.酸性高锰酸钾溶液 | B.乙醇 |
| C.石蕊溶液 | D.氢氧化钠溶液 |
Ⅱ.探究铁离子与苯酚的显色反应
实验1:

实验2:

【提出猜想】
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(4)若向实验1反应后溶液中继续加入NaCl固体,溶液颜色无变化,由此得出的结论是
(5)若向实验1反应后溶液中加入
(6)实验小组同学提出猜想3:溶液的pH会影响显色效果。设计如下实验:
| 实验 | 操作 | 现象 |
| ⅰ | 向2mL苯酚溶液(调节pH=5.5)滴加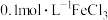 溶液 溶液 | 溶液显紫色(显色效果最佳) |
| ⅱ | 向2mL苯酚溶液(调节pH=9)滴加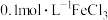 溶液 溶液 | 生成红褐色沉淀 |
| ⅲ | 向实验Ⅱ所得悬浊液中逐滴加入过量 盐酸 盐酸 | 沉淀逐渐溶解,溶液变为紫色;继续滴加过量盐酸,溶液由紫色变为浅黄色 |
②实验ⅲ中继续滴加过量盐酸,溶液由紫色变为浅黄色的原因是
您最近半年使用:0次
名校
7 . 根据下列操作和现象所得到的结论正确的是k
| 选项 | 操作和现象 | 结论 |
| A | 往 溶液中滴加KSCN溶液,再加入少量K2SO4固体,溶液先变成血红色后无明显变化 溶液中滴加KSCN溶液,再加入少量K2SO4固体,溶液先变成血红色后无明显变化 |  与 与 的反应不可逆 的反应不可逆 |
| B | 分别测浓度均为 的CH3COONH4和NaHCO3溶液的pH,后者大于前者 的CH3COONH4和NaHCO3溶液的pH,后者大于前者 | 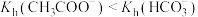 |
| C | 向Na2HPO4溶液中滴加AgNO3溶液,出现黄色沉淀(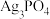 ) ) | Na2HPO4发生了电离反应 |
| D | 将 固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 |  既体现碱性又体现酸性 既体现碱性又体现酸性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
8 . 下列解释事实的离子方程式不正确的是
A.NH4Cl溶于D2O使溶液显酸性: NH + D2O + D2O NH3•D2O +H+ NH3•D2O +H+ |
| B.CuSO4溶液中通入H2S气体生成黑色沉淀:Cu2+ +H2S=CuS↓+2H+ |
C.向AgCl的悬浊液中滴入Na2S溶液,浊液变黑:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq) Ag2S(s)+2Cl-(aq) |
D.向Na2CrO4溶液中滴加浓硫酸,溶液变为橙色:2CrO +2H+ +2H+  Cr2O Cr2O +H2O +H2O |
您最近半年使用:0次
名校
解题方法
9 . 工业制硫酸的关键反应为 。T℃时,向
。T℃时,向 恒容密闭容器中按照物质的量之比
恒容密闭容器中按照物质的量之比 通入
通入 和
和 ,测得容器内某些物质的量随时间变化如图。下列说法正确的是
,测得容器内某些物质的量随时间变化如图。下列说法正确的是
 。T℃时,向
。T℃时,向 恒容密闭容器中按照物质的量之比
恒容密闭容器中按照物质的量之比 通入
通入 和
和 ,测得容器内某些物质的量随时间变化如图。下列说法正确的是
,测得容器内某些物质的量随时间变化如图。下列说法正确的是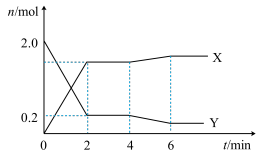
A.用 表示 表示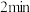 内的平均反应速率为 内的平均反应速率为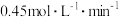 |
B.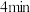 时改变的条件可能是降温或增加 时改变的条件可能是降温或增加 的量 的量 |
| C.T℃,正反应的化学平衡常数K为810 |
D.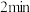 时,若再加入 时,若再加入 和 和 各 各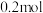 ,平衡逆向移动 ,平衡逆向移动 |
您最近半年使用:0次
2024-01-07更新
|
237次组卷
|
4卷引用:湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题
湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题(已下线)提升练05 化学平衡常数的计算-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
10 . 下列化学平衡在改变条件时发生现象的描述,不正确的是
A. ⇌ ⇌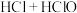 ,光照后氯水黄绿色变浅 ,光照后氯水黄绿色变浅 |
B.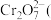 橙色 橙色 ⇌ ⇌ 黄色 黄色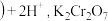 溶液中滴几滴浓硫酸,溶液变黄 溶液中滴几滴浓硫酸,溶液变黄 |
C. 蓝色 蓝色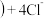 ⇌ ⇌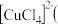 黄色 黄色 ,将氯化铜溶液加热颜色变绿 ,将氯化铜溶液加热颜色变绿 |
D.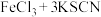 ⇌ ⇌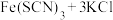 ,向平衡体系中加入KCl固体,体系颜色不发生改变 ,向平衡体系中加入KCl固体,体系颜色不发生改变 |
您最近半年使用:0次



