1 . 一定条件下可合成乙烯:6H2(g)+2CO2(g)⇌CH2=CH2 (g)+4H2O(g) 已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是
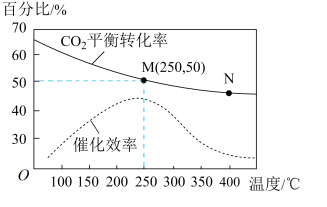
| A.温度不变,若增大压强,ν正>ν逆,平衡常数增大 |
| B.升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 |
| C.温度不变,若恒压下向平衡体系中充入惰性气体,平衡不移动 |
| D.若投料比n(H2):n(CO2)=3:1,则图中 M点乙烯的体积分数为7.7% |
您最近半年使用:0次
名校
解题方法
2 . 在恒温恒压下,向密闭容器中充入4mol  和2mol
和2mol  ,发生如下反应:
,发生如下反应: △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是
 和2mol
和2mol  ,发生如下反应:
,发生如下反应: △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是A.若反应开始时容器体积为2L,则 |
B.若把条件“恒温恒压”改为“恒压恒容”,则平衡后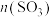 大于1.4mol 大于1.4mol |
C.2min后,向容器中再通入一定量的 气体,重新达到平衡时 气体,重新达到平衡时 的含量变小 的含量变小 |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于Q kJ |
您最近半年使用:0次
3 .  制甲醇的反应历程如图:
制甲醇的反应历程如图:
Ⅰ. 与
与 在活化后的催化剂表面生成甲醇的反应是放热的可逆反应
在活化后的催化剂表面生成甲醇的反应是放热的可逆反应
Ⅱ.该过程的副反应:CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0
CO(g)+H2O(g)ΔH>0
下列说法错误的是
 制甲醇的反应历程如图:
制甲醇的反应历程如图: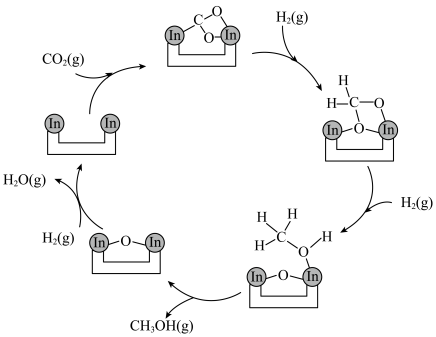
Ⅰ.
 与
与 在活化后的催化剂表面生成甲醇的反应是放热的可逆反应
在活化后的催化剂表面生成甲醇的反应是放热的可逆反应Ⅱ.该过程的副反应:CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH>0
CO(g)+H2O(g)ΔH>0下列说法错误的是
A. 制甲醇的方程式为: 制甲醇的方程式为: |
| B.反应中经历了In−C、In−O键的形成和断裂 |
| C.升高温度可以提高甲醇在平衡时的选择性 |
D.加压可以提高 的平衡转化率 的平衡转化率 |
您最近半年使用:0次
4 . 某温度下气体反应体系达到化学平衡,其平衡常数K=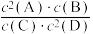 ,恒容时,若温度升高,C的浓度增加。下列说法正确的是
,恒容时,若温度升高,C的浓度增加。下列说法正确的是
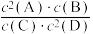 ,恒容时,若温度升高,C的浓度增加。下列说法正确的是
,恒容时,若温度升高,C的浓度增加。下列说法正确的是| A.其他条件不变,增大压强,平衡左移 |
B.该反应的热化学方程式为2A(g)+B(g) C(g)+2D(g) ΔH<0 C(g)+2D(g) ΔH<0 |
| C.增大c(A)、c(B),K增大 |
| D.平衡时,向体系中再加入C,逆反应速率逐渐增大 |
您最近半年使用:0次
解题方法
5 . 为了减缓温室效应,实现碳中和目标,可将 转化为甲醚、甲醇等产品.请回答问题:
转化为甲醚、甲醇等产品.请回答问题:
 与
与 制甲醚
制甲醚 的主要反应如下:
的主要反应如下:
I.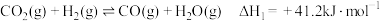
Ⅱ.
Ⅲ.
(1)总反应 的
的
__________ .
(2)若在体积恒定的密闭容器内发生上述反应,下列措施可提高总反应速率的是_________ .
a.加入催化剂 b.降低温度 c.充入惰性气体 d.同比例的增大 和
和 的投料
的投料
(3)密闭容器中充入 ,在
,在 条件下测得平衡时
条件下测得平衡时 转化率和
转化率和 选择性随温度的变化如图所示.
选择性随温度的变化如图所示.

已知: 选择性
选择性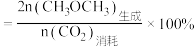
①表示 选择性的是曲线
选择性的是曲线___________ 填(“M”或“N”);
②温度高于 时,曲线N随温度升高而升高的原因是
时,曲线N随温度升高而升高的原因是_____________ ;
③为同时提高平衡时 转化率和
转化率和 选择性,应选择的反应条件为
选择性,应选择的反应条件为________ (填字母)
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
④Q点温度下 的物质的量为
的物质的量为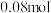 ,则该温度下反应Ⅲ的
,则该温度下反应Ⅲ的
________ .
(4)研究发现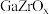 双金属氧化物对
双金属氧化物对 加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是
加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是__________ .

a.反应①有极性键的断裂和形成 b.氧空位的作用是用于捕获
c.整个过程中, 元素的化合价未发生变化 d.机理图上中间体有三种
元素的化合价未发生变化 d.机理图上中间体有三种
 转化为甲醚、甲醇等产品.请回答问题:
转化为甲醚、甲醇等产品.请回答问题: 与
与 制甲醚
制甲醚 的主要反应如下:
的主要反应如下:I.
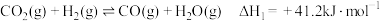
Ⅱ.

Ⅲ.

(1)总反应
 的
的
(2)若在体积恒定的密闭容器内发生上述反应,下列措施可提高总反应速率的是
a.加入催化剂 b.降低温度 c.充入惰性气体 d.同比例的增大
 和
和 的投料
的投料(3)密闭容器中充入
 ,在
,在 条件下测得平衡时
条件下测得平衡时 转化率和
转化率和 选择性随温度的变化如图所示.
选择性随温度的变化如图所示.
已知:
 选择性
选择性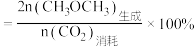
①表示
 选择性的是曲线
选择性的是曲线②温度高于
 时,曲线N随温度升高而升高的原因是
时,曲线N随温度升高而升高的原因是③为同时提高平衡时
 转化率和
转化率和 选择性,应选择的反应条件为
选择性,应选择的反应条件为a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
④Q点温度下
 的物质的量为
的物质的量为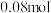 ,则该温度下反应Ⅲ的
,则该温度下反应Ⅲ的
(4)研究发现
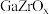 双金属氧化物对
双金属氧化物对 加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是
加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是
a.反应①有极性键的断裂和形成 b.氧空位的作用是用于捕获

c.整个过程中,
 元素的化合价未发生变化 d.机理图上中间体有三种
元素的化合价未发生变化 d.机理图上中间体有三种
您最近半年使用:0次
6 . 卤素化合物在生产生活中应用广泛,回答下列问题
(1)研究表明 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: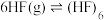 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是____________ ;在测定 相对分子质量的实验中,
相对分子质量的实验中,____________ (填“低压”或“高压”)有利于测定的准确性.
(2) 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为__________ ;产物中的另一种气体可以起到的作用是________________ .
(3) 与
与 以共价键形成
以共价键形成 ,其中
,其中________ 显负电性, 与水反应的方程式是
与水反应的方程式是____________ .
(4)利用 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: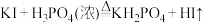 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:________ (“强酸性”“强氧化性”“高沸点”).
(1)研究表明
 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: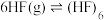 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是 相对分子质量的实验中,
相对分子质量的实验中,(2)
 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为(3)
 与
与 以共价键形成
以共价键形成 ,其中
,其中 与水反应的方程式是
与水反应的方程式是(4)利用
 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: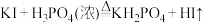 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:
您最近半年使用:0次
7 . 可逆反应A(?)+aB(g) C(g)+2D(g)(a为正整数) ΔH。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是
C(g)+2D(g)(a为正整数) ΔH。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是
 C(g)+2D(g)(a为正整数) ΔH。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是
C(g)+2D(g)(a为正整数) ΔH。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是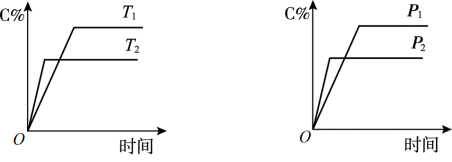
| A.T1>T2、p1>p2 | B.a不可能大于3 |
| C.该反应的ΔH>0 | D.反应过程中,始终有v(C)=2v(D) |
您最近半年使用:0次
8 . t℃时,某一气态平衡体系中含有X、Y、Z、W四种气体物质,此温度下发生反应的平衡常数表达式为: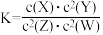 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
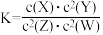 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是| A.升高温度,平衡常数K增大,则正反应为吸热反应 |
| B.增大压强,W质量分数增加 |
| C.增大X浓度,平衡向正反应方向移动 |
| D.升高温度,若混合气体的平均相对分子质量变大,则正反应是放热反应 |
您最近半年使用:0次
解题方法
9 . 氮及其化合物在生产、生活中具有广泛的应用。
(1)已知一定条件下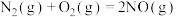
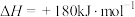 。1mol
。1mol 分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则
分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则 的键能为
的键能为___________ 。
(2)某些过氧由基可以将NO氧化为 ,其反应机理如图所示(标*的为自由基)。X的分子式为
,其反应机理如图所示(标*的为自由基)。X的分子式为___________ ,总反应的化学方程式为___________ 。
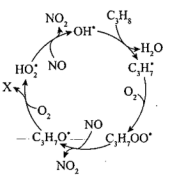
(3)反应 的速率方程可表示为
的速率方程可表示为 ,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
根据表中数据计算,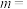
___________ ,
___________ 。温度为650K时该反应的速率常数
___________ 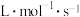 。
。
(4) 储存还原技术法(NSR)利用催化剂消除汽车尾气中的
储存还原技术法(NSR)利用催化剂消除汽车尾气中的 ,反应的化学方程式:
,反应的化学方程式: 。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
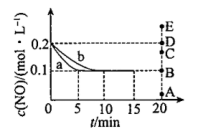
①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线___________ 。
②曲线b表示的反应前10min内CO的平均反应速率
___________  。
。
③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是___________ 点。
(1)已知一定条件下
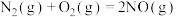
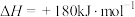 。1mol
。1mol 分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则
分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则 的键能为
的键能为(2)某些过氧由基可以将NO氧化为
 ,其反应机理如图所示(标*的为自由基)。X的分子式为
,其反应机理如图所示(标*的为自由基)。X的分子式为
(3)反应
 的速率方程可表示为
的速率方程可表示为 ,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:| 实验编号 | 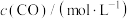 | 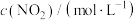 | 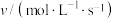 |
| ① | 0.025 | 0.040 | 2.2×10-4 |
| ② | 0.050 | 0.040 | 4.4×10-4 |
| ③ | 0.025 | 0.120 | 6.6×10-4 |
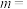


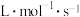 。
。(4)
 储存还原技术法(NSR)利用催化剂消除汽车尾气中的
储存还原技术法(NSR)利用催化剂消除汽车尾气中的 ,反应的化学方程式:
,反应的化学方程式: 。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线
②曲线b表示的反应前10min内CO的平均反应速率

 。
。③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是
您最近半年使用:0次
10 . 下列实验能达到预期目的的实验个数是
| 编号 | 实验内容 | 实验目的 |
| ① | 室温下,用pH试纸分别测定浓度相等的NaClO溶液和NaHCO3溶液的pH | 比较HClO与H2CO3的酸性强弱 |
| ② | 往含有酚酞的Na2CO3溶液中,加入少量CaCl2晶体,现象溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| ③ | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铁粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| ④ | 快速压缩装有NO2、N2O4平衡混合气体的针筒活塞,平衡后气体颜色变深 | 探究压强对化学平衡的影响 |
| A.1 | B.2 | C.3 | D.4 |
您最近半年使用:0次



