名校
1 . 恒温下,反应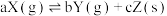 达到平衡状态,把容器容积缩小到原来的一半,且达到新的平衡状态时,X的物质的量浓度从0.1mol·L-1增大到0.19mol·L-1。下列判断中正确的是
达到平衡状态,把容器容积缩小到原来的一半,且达到新的平衡状态时,X的物质的量浓度从0.1mol·L-1增大到0.19mol·L-1。下列判断中正确的是
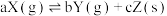 达到平衡状态,把容器容积缩小到原来的一半,且达到新的平衡状态时,X的物质的量浓度从0.1mol·L-1增大到0.19mol·L-1。下列判断中正确的是
达到平衡状态,把容器容积缩小到原来的一半,且达到新的平衡状态时,X的物质的量浓度从0.1mol·L-1增大到0.19mol·L-1。下列判断中正确的是| A.a>b | B.a<b+c | C.a=b+c | D.a<b |
您最近半年使用:0次
2 . 将 催化转化成CO是实现
催化转化成CO是实现 资源化利用的关键步骤,发生的反应有
资源化利用的关键步骤,发生的反应有
反应Ⅰ:

反应Ⅱ: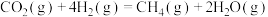

反应Ⅲ: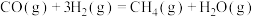
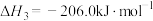 ,0.1MPa,在密闭容器中按
,0.1MPa,在密闭容器中按 投料,平衡时各组分的摩尔分数[物质i的摩尔分数:
投料,平衡时各组分的摩尔分数[物质i的摩尔分数: ,
, 未计入]随温度的变化如图。下列说法
未计入]随温度的变化如图。下列说法不正确 的是
 催化转化成CO是实现
催化转化成CO是实现 资源化利用的关键步骤,发生的反应有
资源化利用的关键步骤,发生的反应有反应Ⅰ:


反应Ⅱ:
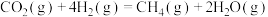

反应Ⅲ:
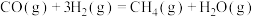
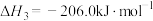 ,0.1MPa,在密闭容器中按
,0.1MPa,在密闭容器中按 投料,平衡时各组分的摩尔分数[物质i的摩尔分数:
投料,平衡时各组分的摩尔分数[物质i的摩尔分数: ,
, 未计入]随温度的变化如图。下列说法
未计入]随温度的变化如图。下列说法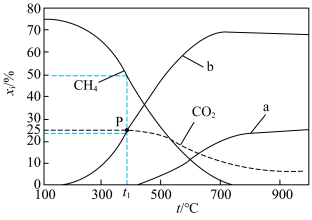
| A.低温下有利于反应Ⅱ正向进行 | B.曲线b为 |
C.P点时反应Ⅰ的 约为 约为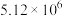 | D.900℃时,适当增大体系压强,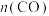 保持不变 保持不变 |
您最近半年使用:0次
名校
解题方法
3 . 将玉米秸秆进行热化学裂解可制备出以CO、 、
、 、
、 为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
(1)已知:几种常见共价键的键能如下表所示:
由此可计算反应 的焓变
的焓变
___________ kJ⋅mol 。
。
(2)若在恒容绝热的密闭容器中进行上述反应,下列说法正确的是___________(填标号)。
(3) 和
和 合成乙醇的反应为
合成乙醇的反应为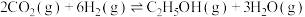 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的变化关系如图所示。
的体积分数随温度和压强的变化关系如图所示。
___________  (填“>、<”或“=”,下同)。判断依据是
(填“>、<”或“=”,下同)。判断依据是___________ 。
②a、b两点的平衡常数
___________  。
。
③已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
___________ J⋅mol 。从图中信息获知催化效率较高的催化剂是
。从图中信息获知催化效率较高的催化剂是___________ (填“m”或“n”)。
 、
、 、
、 为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。(1)已知:几种常见共价键的键能如下表所示:
| 共价键 | C-H | C-O | C≡O | H-H | O-H |
键能(kJ⋅mol ) ) | 413 | 358 | 839 | 436 | 467 |
 的焓变
的焓变
 。
。(2)若在恒容绝热的密闭容器中进行上述反应,下列说法正确的是___________(填标号)。
| A.体系温度不再发生变化时,反应达到化学平衡状态 |
B.体系中若 和 和 的物质的量之比达到2∶1,则反应已达到平衡 的物质的量之比达到2∶1,则反应已达到平衡 |
C.加入催化剂,可以提高 的平衡产率 的平衡产率 |
| D.其它条件不变,增大CO的浓度,能提高H2的平衡转化率 |
(3)
 和
和 合成乙醇的反应为
合成乙醇的反应为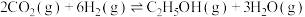 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的变化关系如图所示。
的体积分数随温度和压强的变化关系如图所示。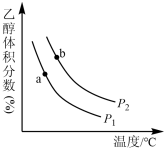

 (填“>、<”或“=”,下同)。判断依据是
(填“>、<”或“=”,下同)。判断依据是②a、b两点的平衡常数

 。
。③已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
 。从图中信息获知催化效率较高的催化剂是
。从图中信息获知催化效率较高的催化剂是
您最近半年使用:0次
名校
4 . 一定条件下,1-苯基丙炔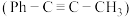 与HCl发生催化加成,反应如下:
与HCl发生催化加成,反应如下:
反应Ⅰ: 产物A:
产物A: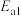 ;
;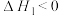
反应Ⅱ: 产物B:
产物B: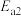 ;
;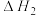
反应Ⅲ: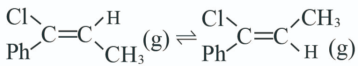 ;
;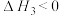
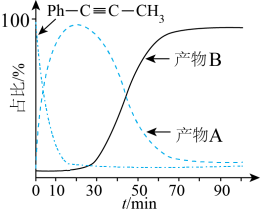
T℃,向密闭容器中通入2molPh-C≡C-CH3(g)和3molHCl(g),平衡时测得Ph-C≡C-CH3(g)的转化率为 ,反应Ⅲ的平衡常数
,反应Ⅲ的平衡常数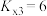 ,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
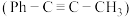 与HCl发生催化加成,反应如下:
与HCl发生催化加成,反应如下:反应Ⅰ:
 产物A:
产物A: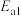 ;
;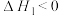
反应Ⅱ:
 产物B:
产物B: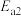 ;
;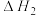
反应Ⅲ:
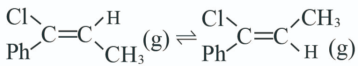 ;
;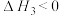
T℃,向密闭容器中通入2molPh-C≡C-CH3(g)和3molHCl(g),平衡时测得Ph-C≡C-CH3(g)的转化率为
 ,反应Ⅲ的平衡常数
,反应Ⅲ的平衡常数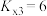 ,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
A.活化能: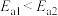 |
B.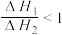 |
C.T℃反应的平衡常数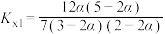 |
| D.若保持温度和压强不变,再向容器中通N2,反应I的化学平衡将逆向移动 |
您最近半年使用:0次
5 . 石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并利用。
(1)热分解法: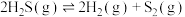
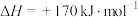 ,工业上,通常在等温、等用条件下将
,工业上,通常在等温、等用条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会___________ (填“增大”、“减小”或“不变”)。
(2)氧化法: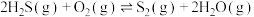
已知: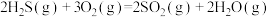
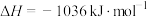
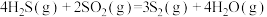
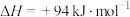
无催化剂条件下,混合加热 与
与 ,探究相同时间内
,探究相同时间内 (g)产率影响因素。
(g)产率影响因素。
①用氧化法处理 ,若生成1mol
,若生成1mol  (g),放出热量为
(g),放出热量为___________ kJ。
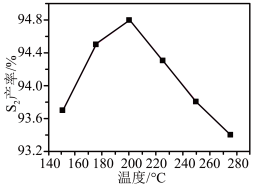
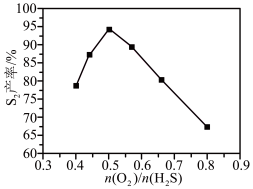
②其他条件相同时, 产率随温度的变化如图所示。随着温度升高,
产率随温度的变化如图所示。随着温度升高, (g)产率先增大后减小,原因是
(g)产率先增大后减小,原因是___________ 。
③其他条件相同时, (g)产率随
(g)产率随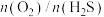 值的变化如图所示。
值的变化如图所示。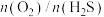 值过高不利于提高
值过高不利于提高 (g)产率,可能的原因是
(g)产率,可能的原因是___________ 。
(3)微电池法:利用电化学原理去除天然气中的 ,装置如图所示,总反应是:
,装置如图所示,总反应是: 。
。
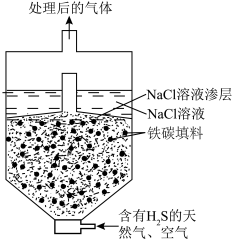
①写出负极的电极反应式___________ 。
②一段时间后,单位时间内 的去除率降低,其可能的原因是
的去除率降低,其可能的原因是___________ 。
(4)硫酸钙吸收法:如图为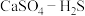 反应体系在不同温度、不同
反应体系在不同温度、不同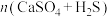 物质的量比的物相变化图。
物质的量比的物相变化图。
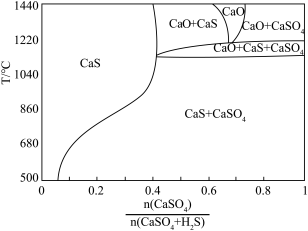
①用斜线在图中画出 可以完全转化并且有CaO生成的区域
可以完全转化并且有CaO生成的区域___________ 。
②若不通入 ,简述
,简述 随温度升高分解的规律
随温度升高分解的规律___________ 。
(1)热分解法:
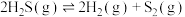
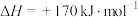 ,工业上,通常在等温、等用条件下将
,工业上,通常在等温、等用条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会(2)氧化法:
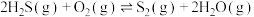
已知:
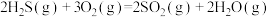
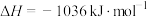
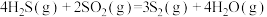
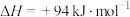
无催化剂条件下,混合加热
 与
与 ,探究相同时间内
,探究相同时间内 (g)产率影响因素。
(g)产率影响因素。①用氧化法处理
 ,若生成1mol
,若生成1mol  (g),放出热量为
(g),放出热量为②其他条件相同时,
 产率随温度的变化如图所示。随着温度升高,
产率随温度的变化如图所示。随着温度升高, (g)产率先增大后减小,原因是
(g)产率先增大后减小,原因是
③其他条件相同时,
 (g)产率随
(g)产率随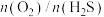 值的变化如图所示。
值的变化如图所示。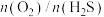 值过高不利于提高
值过高不利于提高 (g)产率,可能的原因是
(g)产率,可能的原因是
(3)微电池法:利用电化学原理去除天然气中的
 ,装置如图所示,总反应是:
,装置如图所示,总反应是: 。
。
①写出负极的电极反应式
②一段时间后,单位时间内
 的去除率降低,其可能的原因是
的去除率降低,其可能的原因是(4)硫酸钙吸收法:如图为
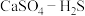 反应体系在不同温度、不同
反应体系在不同温度、不同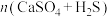 物质的量比的物相变化图。
物质的量比的物相变化图。
①用斜线在图中画出
 可以完全转化并且有CaO生成的区域
可以完全转化并且有CaO生成的区域②若不通入
 ,简述
,简述 随温度升高分解的规律
随温度升高分解的规律
您最近半年使用:0次
解题方法
6 .  时,A、B、C三种气体在恒容密闭容器中反应时,浓度的变化情况如图,回答下列问题。
时,A、B、C三种气体在恒容密闭容器中反应时,浓度的变化情况如图,回答下列问题。
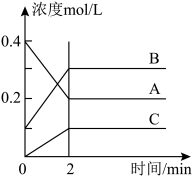
(1)写出该反应的方程式:___________ 。
(2)前 ,A的分解速率为
,A的分解速率为___________ 。
(3)达到平衡后,若增大压强,平衡向___________ 方向移动(填“正”或“逆”或“不移动)。
(4)该反应的平衡常数
___________ 。
(5) 反应达平衡,容器内混合气体的平均相对分子质量比起始时
反应达平衡,容器内混合气体的平均相对分子质量比起始时___________ (填“大”,“小”或“相等”,下同),混合气体密度比起始时___________
(6)在某一时刻采取下列措施能使该反应速率减小的是___________。
 时,A、B、C三种气体在恒容密闭容器中反应时,浓度的变化情况如图,回答下列问题。
时,A、B、C三种气体在恒容密闭容器中反应时,浓度的变化情况如图,回答下列问题。
(1)写出该反应的方程式:
(2)前
 ,A的分解速率为
,A的分解速率为(3)达到平衡后,若增大压强,平衡向
(4)该反应的平衡常数

(5)
 反应达平衡,容器内混合气体的平均相对分子质量比起始时
反应达平衡,容器内混合气体的平均相对分子质量比起始时(6)在某一时刻采取下列措施能使该反应速率减小的是___________。
| A.加催化剂 | B.降低温度 |
| C.容积不变,充入A | D.容积不变,从容器中分离出A |
您最近半年使用:0次
解题方法
7 . 可逆反应在密闭容器中进行,如图所示,反应在不同时间t、温度T和压强p与生成物浓度的关系曲线,下列反应中符合图像的是
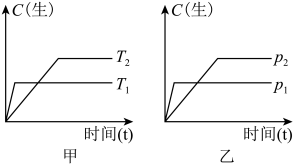

A.  |
B.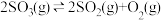  |
C.  |
D.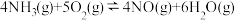  |
您最近半年使用:0次
8 . 下列事实不能 用勒夏特列原理来解释的是
| A.实验室中常用排饱和食盐水的方法收集Cl2 |
| B.鼓入过量空气有利于SO2转化为SO3 |
| C.开启啤酒瓶后,压强变小,瓶中立刻泛起大量泡沫 |
| D.煅烧硫铁矿时先将矿石粉碎 |
您最近半年使用:0次
名校
解题方法
9 . 近年来,碳中和、碳达峰成为热点。以CO2、H2为原料生产甲醇是一种有效利用二氧化碳的途径。
途径一:涉及的反应有
I.
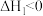
Ⅱ.

III.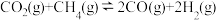
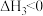
(1)关于反应I,下列描述正确的是___________(填字母序号)。
(2)根据反应I~Ⅲ,计算 ΔH=
ΔH=___________ 。
(3)工业中,对于反应I,通常同时存在副反应IV: ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。

①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________ 。
②由图b可知,ΔH4___________ 0(填“>”、“<”或“=”);H2的物质的量分数随温度升高而增大,原因是___________ 。
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为___________ 。
途径二:涉及的反应有
I.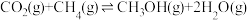
Ⅱ.
III.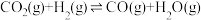
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为___________ (用含a、b、V的代数式表示)。
途径一:涉及的反应有
I.

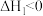
Ⅱ.


III.
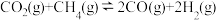
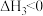
(1)关于反应I,下列描述正确的是___________(填字母序号)。
| A.恒容下达平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态 |
| C.当反应达平衡状态时,2V正(H2)=V逆(H2O) |
| D.恒温下缩小容器体积,反应物的活化分子百分数增大 |
 ΔH=
ΔH=(3)工业中,对于反应I,通常同时存在副反应IV:
 ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是
②由图b可知,ΔH4
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为
途径二:涉及的反应有
I.
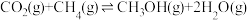
Ⅱ.

III.
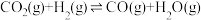
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为
您最近半年使用:0次
名校
解题方法
10 . 下列实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 快速拉伸装有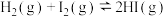 的针筒活塞,气体颜色变浅 的针筒活塞,气体颜色变浅 | 证明压强改变对平衡的影响 |
| B | 常温下,测物质的量浓度相等的HA和HB溶液的 | 比较HA与HB的酸性强弱 |
| C | 用 稀硫酸与足量纯锌反应,产生气泡速率较慢,加入 稀硫酸与足量纯锌反应,产生气泡速率较慢,加入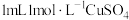 溶液后,迅速产生较多气泡 溶液后,迅速产生较多气泡 | 证明反应速率会随反应物浓度的增大而加快 |
| D | 向 硝酸银溶液中加入 硝酸银溶液中加入 溶液,出现白色沉淀,再加入几滴 溶液,出现白色沉淀,再加入几滴 的 的 溶液,有黑色沉淀生成 溶液,有黑色沉淀生成 | 证明在相同温度下的 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



