名校
1 . 下列叙述中正确的是
A.向氨水中不断通入CO2, 随着CO2的增加, 不断变大 不断变大 |
| B.在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu |
| C.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)= 4Fe(OH)3(s) △H>0, △S<0 |
D.将图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深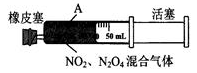 |
您最近一年使用:0次
2017-02-28更新
|
454次组卷
|
3卷引用:湖南省永州市双牌县第二中学2019届高三上学期12月月考化学试题
名校
解题方法
2 . 一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 2 | 4 | 6 | 8 |
| n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
| A.反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1 |
| B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大 |
| C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10% |
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时 减小 减小 |
您最近一年使用:0次
2017-02-17更新
|
717次组卷
|
7卷引用:【全国百强校】江苏省南通市海安高级中学2018-2019学年高二12月月考(选修)化学试题
3 . 在一定条件下,某可逆反应aA(g)+bB(s)⇌cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是
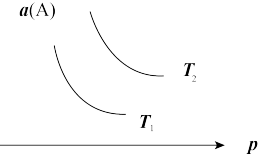

| A.a+b<c |
| B.若T2>T1,则该反应在高温下易自发进行 |
| C.△H>0 |
| D.若T2<T1,则该反应一定不能自发进行 |
您最近一年使用:0次
名校
4 . 已知反应:2NO2(红棕色) N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

 N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
| A.b点的操作是拉伸注射器 |
| B.d点:v(正)>v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
您最近一年使用:0次
2016-12-09更新
|
115次组卷
|
2卷引用:2016届湖南省长沙长郡中学高三下学期第六次月考化学试卷
名校
5 . 将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
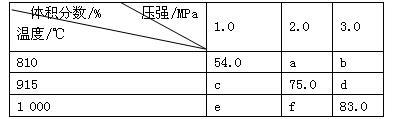
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
| A.a<54.0 |
| B.b> f |
| C.915 ℃,2.0 MPa时E的转化率为60% |
| D.K(1000 ℃)>K(810 ℃) |
您最近一年使用:0次
2016-12-09更新
|
371次组卷
|
2卷引用:陕西省西安中学2019-2020学年高二12月月考化学试题
名校
6 . 请回答下列问题
(1)已知:25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。
①HA是________ (填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________ (填字母)。
A.c(H+)/c(HA) B.c(HA)/ c (A-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是_______ (填字母)。
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是__________ (用序号连接)
(3)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是____ 。

①A、C两点的反应速率:A>C
②A、C两点气体的颜色:A深、C浅
③B、C两点的气体的平均分子质量:B<C
④由状态B到状态A,可以用加热方法
(1)已知:25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。
①HA是
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是
A.c(H+)/c(HA) B.c(HA)/ c (A-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
(3)对于2NO2(g)
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是
①A、C两点的反应速率:A>C
②A、C两点气体的颜色:A深、C浅
③B、C两点的气体的平均分子质量:B<C
④由状态B到状态A,可以用加热方法
您最近一年使用:0次
2016-12-09更新
|
248次组卷
|
3卷引用:2014-2015湖南省浏阳市高二上学期理科化学试卷
7 . 恒容体系,发生如下反应2A(g) B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
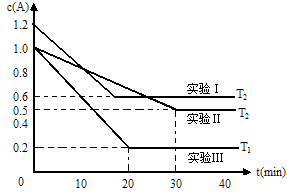
(1)在实验Ⅲ中,0~20min的时间内,v(B)=_______________ 。
(2)根据以上实验事实,完成以下填空:x=____________ ,生成物C的状态为____________ ,反应热△H________ 0(填“>”、“=”或者“<”)。
(3)在实验Ⅱ中,当化学反应进行到35min时,下列关于反应体系中的有关说法,正确的是__________ 。
a.单位时间内生成n mol B的同时生成2n mol A
b.单位时间内生成n mol C的同时消耗2n mol A
c.用A、B、C表示的反应速率的比为2:1:2
d.混合气体中反应物A与生成物B的体积分数之比为2:1
e.混合气体中B与C的物质的量相等
(4)该反应的化学平衡常数表达式K=_________ ,在T2℃时K的数值为_______ 。
(5)T1℃时,保持容器的体积不变,若充入amolA、bmolB、cmolC,达到平衡时C的体积分数为0.4,则a、b、c的取值可以是______________ 。
a.a=2、b=1、c=2
b.a=0.5、b=1.7、c=1.7
c.a=1、b=1、c=1
d.a=x、b=c=2x(x>0)
e.b=c、a为大于0的任意值
 B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
(1)在实验Ⅲ中,0~20min的时间内,v(B)=
(2)根据以上实验事实,完成以下填空:x=
(3)在实验Ⅱ中,当化学反应进行到35min时,下列关于反应体系中的有关说法,正确的是
a.单位时间内生成n mol B的同时生成2n mol A
b.单位时间内生成n mol C的同时消耗2n mol A
c.用A、B、C表示的反应速率的比为2:1:2
d.混合气体中反应物A与生成物B的体积分数之比为2:1
e.混合气体中B与C的物质的量相等
(4)该反应的化学平衡常数表达式K=
(5)T1℃时,保持容器的体积不变,若充入amolA、bmolB、cmolC,达到平衡时C的体积分数为0.4,则a、b、c的取值可以是
a.a=2、b=1、c=2
b.a=0.5、b=1.7、c=1.7
c.a=1、b=1、c=1
d.a=x、b=c=2x(x>0)
e.b=c、a为大于0的任意值
您最近一年使用:0次
11-12高二上·广东·期中
8 . 在一容积为2 L的密闭容器内加入0.2 mol 的N2和0.6 mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
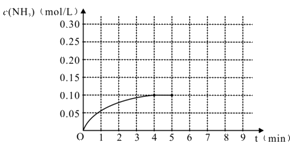
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为_________________ 。
(2)该反应的化学平衡常数表达式K=___________________ 。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________ 。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________ 移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________ (填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。___________________
 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为
(2)该反应的化学平衡常数表达式K=
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
您最近一年使用:0次
11-12高二上·辽宁沈阳·阶段练习
9 . 对于平衡体系mA(g)+nB(g)=pC(g)+qD(g) ΔH<0。下列结论中错误的是
| A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n |
| C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
| D.若改变条件使平衡体系中物质的浓度发生变化,则平衡一定发生移动 |
您最近一年使用:0次
10-11高三上·湖南郴州·阶段练习
10 . 在一定温度下的某容积可变的密闭容器中,建立下列化学平衡: C(s)+H2O(g)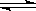 CO(g)+H2(g)试分析和回答下列问题:
CO(g)+H2(g)试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是____ (选填序号)。
A 体系的压强不再发生变化
B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将_____ (填写不变.变小.变大)
(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量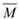 的取值范围是
的取值范围是_____________ 。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为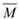 ),分别给出
),分别给出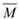 的变化(请填写条件和结论):
的变化(请填写条件和结论):______________ 、______________ 、______________ 。
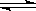 CO(g)+H2(g)试分析和回答下列问题:
CO(g)+H2(g)试分析和回答下列问题:(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是
A 体系的压强不再发生变化
B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从
 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量
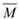 的取值范围是
的取值范围是②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为
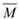 ),分别给出
),分别给出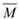 的变化(请填写条件和结论):
的变化(请填写条件和结论):
您最近一年使用:0次



