解题方法
1 . 合成气(CO+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品。
(1)煤化工中生产合成气的反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.5kJ·mol-1
CO(g)+H2(g) ΔH=+131.5kJ·mol-1
①判断该反应的自发性条件___________ ;
②在恒温恒容下,同时放入C(s)、H2O(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H2O(g) CO(g)+H2(g)已达到平衡的是
CO(g)+H2(g)已达到平衡的是___________ 。
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH—O键断裂的同时有1molH—H键断裂
D.混合气体的平均相对分子质量保持不变
(2)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g) 2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
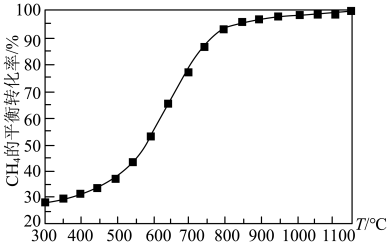
①请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线________ 。
②现有实验测得反应2CH4(g)+O2(g) 2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
最佳碳氧比[n(CH4)/n(O2)]为___________ 。
(1)煤化工中生产合成气的反应为:C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.5kJ·mol-1
CO(g)+H2(g) ΔH=+131.5kJ·mol-1①判断该反应的自发性条件
②在恒温恒容下,同时放入C(s)、H2O(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H2O(g)
 CO(g)+H2(g)已达到平衡的是
CO(g)+H2(g)已达到平衡的是A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH—O键断裂的同时有1molH—H键断裂
D.混合气体的平均相对分子质量保持不变
(2)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g)
 2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
①请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线
②现有实验测得反应2CH4(g)+O2(g)
 2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)| 碳氧比[n(CH4)/n(O2)] | 1︰0.25 | 1︰0.5 | 1︰1 | 1︰1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
您最近一年使用:0次
解题方法
2 .  的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。
Ⅰ.利用 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:
反应①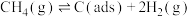

反应②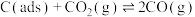

有关物质的相对能量与反应历程的变化如图所示[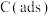 为吸附性活性炭]:
为吸附性活性炭]:
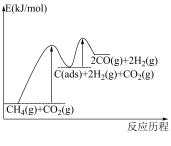
(1)总反应 能自发进行的条件为
能自发进行的条件为_______ 。
(2)总反应速率由反应_______ (填“①”或“②”)决定,增加 的浓度,
的浓度,_______ (填“能”或“不能”)显著提升总反应的速率。
Ⅱ.工业上可利用 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:
反应③

反应④
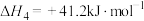
在5MPa的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。

(3)在425℃~675℃范围内(其他条件不变), 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:_______ ,_______ 。
(4)下列说法正确的是_______(填字母)。
(5)反应④在545K时的平衡常数
_______ 。
(6)结合上图,在下图中画出 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线_______ (标出B点坐标)。
 的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。Ⅰ.利用
 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:反应①
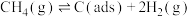

反应②
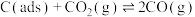

有关物质的相对能量与反应历程的变化如图所示[
 为吸附性活性炭]:
为吸附性活性炭]:
(1)总反应
 能自发进行的条件为
能自发进行的条件为(2)总反应速率由反应
 的浓度,
的浓度,Ⅱ.工业上可利用
 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:反应③


反应④

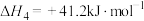
在5MPa的恒压反应器中,按照
 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。
(3)在425℃~675℃范围内(其他条件不变),
 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:(4)下列说法正确的是_______(填字母)。
| A.曲线Ⅱ代表CO的选择性随温度的变化 |
B.温度越低,越有利于工业生产 |
C.上述反应条件下, 的平衡转化率等于 的平衡转化率等于 的平衡转化率 的平衡转化率 |
D.原料气中掺入适量CO能提高 的产率 的产率 |
(5)反应④在545K时的平衡常数

(6)结合上图,在下图中画出
 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线
您最近一年使用:0次
名校
3 . 将产能过剩的乙酸在特定催化剂作用下和氢气反应生成乙醇,其反应原理如下:CH3COOH(g)+2H2(g)⇌CH3CH2OH(g)+H2O(g) △H1
已知:298k和100kPa时物质的燃烧热:
1.根据以上燃烧热,计算该反应在298k和100kPa的△H1时,需补充_______ 。
A.水的汽化热 B.乙酸、乙醇和水的汽化热 C.反应物的汽化热
2.一定温度下,将不同量的原料通入恒压密闭容器中,测出平衡时的热量变化
则,该温度下,△H1=_______kJ·mol–1。
3.该反应在_______能向正反应方向自发进行。
4.250℃,恒压绝热密闭容器中充入一定量CH3COOH和H2,下列条件能判断反应达到平衡状态的是_______。
上述反应发生时还伴随有副反应发生,生成少量乙酸乙酯:CH3COOH(g)+CH3CH2OH(g)⇌CH3COOCH2CH3(g)+H2O(g) △H2<0
已知:①该副反应的热效应很小;
②S表示产物选择性,乙醇、乙酸乙酯选择性表示为:
S(乙醇)= ;S(乙酸乙酯)=
;S(乙酸乙酯)=
当nH2(g):n(CH3COOH)=10:1时,下图表示2Mpa,平衡时S(乙醇)、S(乙酸乙酯)随温度的变化以及250℃,平衡时S(乙醇)、S(乙酸乙酯)随压强的变化:_______ 。
A.a B.c C.d
6.曲线b是S(乙醇)随温度变化的曲线,解释b的变化趋势。_______ 。
7.150℃,在催化剂作用下,H2和CH3COOH反应一段时间后,S(乙醇)位于m点,不改变反应时间和温度,一定能提高S(乙醇)的措施是_______ 。(任写一条)
8.一定温度和压强下,向初始体积为1L的密闭容器中通入2molH2(g)和1molCH3COOH(g),同时发生主反应和副反应,测定平衡时n[H2O(g)]=0.8mol,体积减小20%,则平衡时n(CH3COOH)=_______ mol、c(H2)=_______ mol·L–1。主反应的平衡常数K=_______ 。
已知:298k和100kPa时物质的燃烧热:
| 物质 | CH3COOH(l) | H2(g) | CH3CH2OH(l) |
| 燃烧热/kJ·mol–1 | –871 | –286 | –1367 |
A.水的汽化热 B.乙酸、乙醇和水的汽化热 C.反应物的汽化热
2.一定温度下,将不同量的原料通入恒压密闭容器中,测出平衡时的热量变化
| 实验编号 | 反应物投入量 | 平衡时, 热量变化 | |||
| CH3CH2OH(g) | H2(g) | CH3CH2OH(g) | H2O(g) | ||
| I | 1mol | 2mol | 0 | 0 | 放热xkJ |
| II | 0 | 0 | 1mol | 1mol | 吸收ykJ |
| A.x+y | B.x-y | C.-(x+y) | D.y-x |
| A.任何温度下 | B.较低温度下 | C.较高温度下 | D.无法确定 |
| A.混合气体的密度保持不变 | B.v(H2)正:v(H2O)正=2:1 |
| C.n(CH3COOH):n(H2)=1:2 | D.反应体系的温度保持不变 |
上述反应发生时还伴随有副反应发生,生成少量乙酸乙酯:CH3COOH(g)+CH3CH2OH(g)⇌CH3COOCH2CH3(g)+H2O(g) △H2<0
已知:①该副反应的热效应很小;
②S表示产物选择性,乙醇、乙酸乙酯选择性表示为:
S(乙醇)=
 ;S(乙酸乙酯)=
;S(乙酸乙酯)=
当nH2(g):n(CH3COOH)=10:1时,下图表示2Mpa,平衡时S(乙醇)、S(乙酸乙酯)随温度的变化以及250℃,平衡时S(乙醇)、S(乙酸乙酯)随压强的变化:

A.a B.c C.d
6.曲线b是S(乙醇)随温度变化的曲线,解释b的变化趋势。
7.150℃,在催化剂作用下,H2和CH3COOH反应一段时间后,S(乙醇)位于m点,不改变反应时间和温度,一定能提高S(乙醇)的措施是
8.一定温度和压强下,向初始体积为1L的密闭容器中通入2molH2(g)和1molCH3COOH(g),同时发生主反应和副反应,测定平衡时n[H2O(g)]=0.8mol,体积减小20%,则平衡时n(CH3COOH)=
您最近一年使用:0次
2024-04-01更新
|
186次组卷
|
2卷引用:上海市华东师范大学第二附属中学2023-2024学年高二下学期等级考 阶段检测 化学试题
4 . 化学反应伴随着能量变化,研究化学反应中的能量变化具有重大意义。请回答下列问题:
Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:
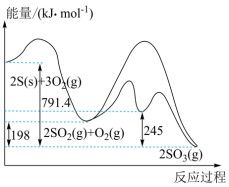
(1)表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为______ 。
(2)对于反应 :
:
①______ (填“低温”、“高温”或“任意温度”)有利于该反应正向自发进行。
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是______ (填标号)。
A.升高温度 B.压缩容器体积 C.增大 浓度 D.再充入一定量的
浓度 D.再充入一定量的
Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
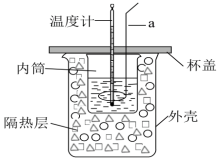
实验步骤:
①量取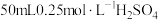 ,溶液倒入小烧杯中,测量温度;
,溶液倒入小烧杯中,测量温度;
②量取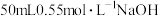 溶液,测量温度;
溶液,测量温度;
③将溶液倒入小烧杯中,混合均匀后测量混合液温度。
(3)仪器a的名称为______ ,使用的溶液稍微过量的原因是______ 。
(4)实验数据记录:
(5)实验过程中,向 溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
______ (填“偏大”或“偏小”,下同);若用 氨水代替NaOH溶液,将会导致测得的
氨水代替NaOH溶液,将会导致测得的
______ 。
Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:

(1)表示
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)对于反应
 :
:①
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是
A.升高温度 B.压缩容器体积 C.增大
 浓度 D.再充入一定量的
浓度 D.再充入一定量的
Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。

实验步骤:
①量取
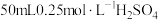 ,溶液倒入小烧杯中,测量温度;
,溶液倒入小烧杯中,测量温度;②量取
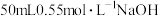 溶液,测量温度;
溶液,测量温度;③将溶液倒入小烧杯中,混合均匀后测量混合液温度。
(3)仪器a的名称为
(4)实验数据记录:
实验次数 | 反应物的初始温度/℃ | 反应后体系的温度/℃ | ||
H2SO4溶液 | NaOH溶液 | 平均值 | ||
1 | 25.2 | 25.4 | 28.6 | |
2 | 24.9 | 25.1 | 28.4 | |
3 | 25.3 | 25.3 | 28.0 | |
4 | 25.0 | 25.2 | 28.3 | |
设实验所用的酸、碱溶液的密度均为 ,反应前后溶液的比热容
,反应前后溶液的比热容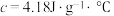 。计算该实验的
。计算该实验的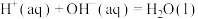

 。
。
(5)实验过程中,向
 溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
 氨水代替NaOH溶液,将会导致测得的
氨水代替NaOH溶液,将会导致测得的
您最近一年使用:0次
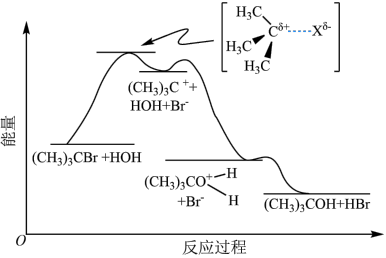
5 . 已知:空间位阻越大,离去越容易。2-溴-2-甲基丙烷(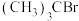 )发生水解反应[
)发生水解反应[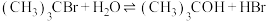 ]的能量变化与反应过程的关系如图所示。下列说法不正确的是
]的能量变化与反应过程的关系如图所示。下列说法不正确的是
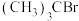 )发生水解反应[
)发生水解反应[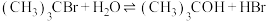 ]的能量变化与反应过程的关系如图所示。下列说法不正确的是
]的能量变化与反应过程的关系如图所示。下列说法不正确的是
| A.该反应在低温下自发进行 |
B.碘原子半径比氧大,因此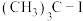 水解生成 水解生成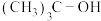 的速率比 的速率比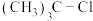 快 快 |
| C.升高温度,可能加快反应速率,同时提高2-溴-2甲基丙烷的平衡转化率 |
D.为了提高2-溴-2-甲基丙烷的水解程度,可以加入适量 固体 固体 |
您最近一年使用:0次
名校
6 . 某小组学生用如图所示简易量热计进行中和反应反应热的测定。近似处理实验所用酸、碱溶液的密度为1.0 g∙cm-3、比热容为4.2J/(g∙℃),忽略量热计的比热容。
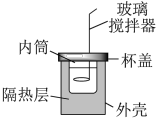
【药品】:50mL 0.50mol/L 盐酸、50mL 0.55mol/L NaOH溶液、50mL 0.55mol/L KOH溶液。
【实验数据】学生甲进行的三次实验数据如下表所示:
(1)从实验装置上看,还缺少的仪器名称是___________ 。
(2)学生甲实测数据处理
①∆t=___________ ℃。
②放出的热量Q甲___________ kJ(保留一位数)。
③Q甲kJ比该反应理论上放热为Q kJ略微偏小,其原因可能是___________ (写一条)。
(3)学生乙选用KOH溶液,其他均与学生甲同,且操作规范,预测实验放出热量的数值Q乙___________ Q甲(填“<”或“=”或“>”)。
(4)写出上面实验理论上生成1mol H2O时,中和反应的反应热的热化学方程式为(用含Q的代数式表示)___________ 。
(5)TiO2转化为TiCl4有直接氯化法和碳氯化法。1000 ℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+172 kJ·mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH2=-51 kJ·mol-1,Kp2=1.2×1012Pa
①反应2C(s)+O2(g)=2CO(g)的ΔH为___________ kJ·mol-1,Kp=___________ Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是___________ 。
③数据显示在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是___________ 。
④TiO2碳氯化是一个“气-固-固”反应,有利于TiO2-C“固-固”接触的措施是___________ 。

【药品】:50mL 0.50mol/L 盐酸、50mL 0.55mol/L NaOH溶液、50mL 0.55mol/L KOH溶液。
【实验数据】学生甲进行的三次实验数据如下表所示:
| 实验次数 | 反应前体系的温度/℃ | 反应后体系温度/℃ | 温度差平均值/℃ | ||
| 50mL 0.50mol/L盐酸 | 50mL 0.55mol/L NaOH溶液 | 平均值 | |||
| 1 | 24.9 | 25.1 | 28.4 | ∆t | |
| 2 | 25.1 | 25.0 | 26.3 | ||
| 3 | 25.0 | 25.0 | 28.4 | ||
(1)从实验装置上看,还缺少的仪器名称是
(2)学生甲实测数据处理
①∆t=
②放出的热量Q甲
③Q甲kJ比该反应理论上放热为Q kJ略微偏小,其原因可能是
(3)学生乙选用KOH溶液,其他均与学生甲同,且操作规范,预测实验放出热量的数值Q乙
(4)写出上面实验理论上生成1mol H2O时,中和反应的反应热的热化学方程式为(用含Q的代数式表示)
(5)TiO2转化为TiCl4有直接氯化法和碳氯化法。1000 ℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+172 kJ·mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH2=-51 kJ·mol-1,Kp2=1.2×1012Pa
①反应2C(s)+O2(g)=2CO(g)的ΔH为
②碳氯化的反应趋势远大于直接氯化,其原因是
③数据显示在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
④TiO2碳氯化是一个“气-固-固”反应,有利于TiO2-C“固-固”接触的措施是
您最近一年使用:0次
7 . 证据推理是化学学科重要核心素养。下列证据能得出相应推论的是
| 选项 | 证据 | 推论 |
| A | 反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g)能自发进行 C2H4(g)+4H2O(g)能自发进行 | 该反应的△H<0 |
| B | 增大压强,化学反应速率加快 | 增大压强,活化分子百分数增多,有效碰撞概率增大 |
| C | 用pH计测定浓度相等的NaClO溶液和Na2CO3溶液的pH,NaClO溶液碱性更强 | 酸性:H2CO3>HClO |
| D | 向双氧水中滴加浓硫酸,产生气体的速率加快 | 浓硫酸对H2O2的分解具有催化作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . “节能减排”和“低碳经济”的一项重要课题就是如何将 转化为可利用的资源。
转化为可利用的资源。
Ⅰ.目前工业上有一种方法是用 来生产燃料甲醇。
来生产燃料甲醇。
已知: 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol 、
、 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol
反应①:
 kJ⋅mol
kJ⋅mol
反应②:
 kJ⋅mol
kJ⋅mol
反应③:

(1)


(2)恒温条件下,在某恒容密闭容器中;按照
 投料发生反应③,测得
投料发生反应③,测得 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。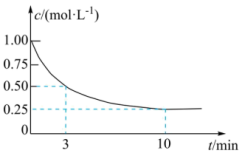
①从反应开始到3 min, 的平均反应速率
的平均反应速率
 ⋅min
⋅min ;试在图中绘制出
;试在图中绘制出 的浓度随时间变化的图像
的浓度随时间变化的图像
②该反应的平衡常数
(3)恒温条件下,在某恒压密闭容器中仅发生反应①,当反应达到平衡后,
Ⅰ.降低温度,CO的平衡转化率
Ⅱ.向平衡体系中通入惰性气体,平衡
您最近一年使用:0次
9 . 已知: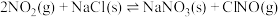
 ,下列说法正确的是
,下列说法正确的是
A.该反应的平衡常数可表达为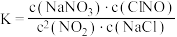 |
| B.该反应一定能自发进行 |
C.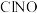 分子的VSEPR模型名称为平面三角形 分子的VSEPR模型名称为平面三角形 |
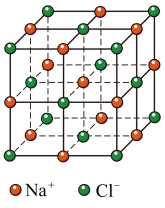
D. 晶胞(如图所示)中每个 晶胞(如图所示)中每个 周围与其距离最近的 周围与其距离最近的 有12个 有12个 |
您最近一年使用:0次
解题方法
10 . 某反应的反应机理、能量与反应进程的关系如下图所示,下列说法正确的是
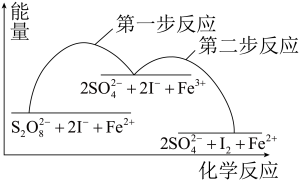

A. 是该反应的催化剂 是该反应的催化剂 | B.该反应焓变 <0可知,该反应可自发进行 <0可知,该反应可自发进行 |
C.加入催化剂后,反应的 变小 变小 | D.第一步反应的活化能比第二步反应的小 |
您最近一年使用:0次



