名校
1 . 甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式为:
ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。
回答下列问题:
(1)a=______ (用b、c表示),已知反应ⅱ在一定条件下可自发进行,则b______ (填“>”“<”或“=”)0。
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)___ (填“>”“<”或“=”)v(逆),平衡常数_______ (填“变大”“变小”或“不变”)。
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
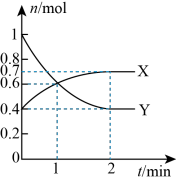
①Y为_____ (填化学式)。
②0~1min时v(CO)为_____ mol/(L·min)。
③该温度下,该反应的平衡常数Kc=______ 。
(4)工业上以 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

______ 。若该反应的 ,
, (
(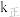 、
、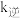 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则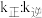
_______ (填“增大”“不变”或“减小”)。
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和 分别取
分别取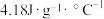 和
和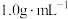 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热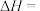
_____  。
。
②下列操作会使所测得的焓变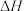 偏小的是
偏小的是______ 。
a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
ⅰ.CO(g)+2H2(g)
 CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。回答下列问题:
(1)a=
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
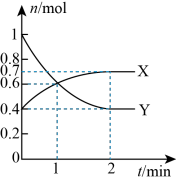
①Y为
②0~1min时v(CO)为
③该温度下,该反应的平衡常数Kc=
(4)工业上以
 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

 ,
, (
(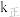 、
、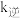 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则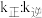
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和
 分别取
分别取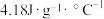 和
和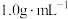 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热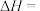
 。
。②下列操作会使所测得的焓变
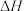 偏小的是
偏小的是a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
您最近一年使用:0次
名校
2 . 氯化硫酰(SO2Cl2)常用作氧化剂,它是一种无色液体,熔点:-54.1℃,沸点:69.1℃,可用干燥的SO2和Cl2在活性炭作催化剂的条件下制取:SO2(g)+Cl2(g)⇌SO2Cl2(l) ΔH=-97.3kJ·mol-1。下列有关SO2Cl2制取的说法正确的是
| A.该反应在高温下能自发进行 |
| B.使用活性炭作催化剂能缩短该反应达平衡的时间 |
| C.化学平衡发生移动,该反应平衡常数必发生变化 |
| D.使SO2Cl2液化从平衡体系中分离,能加快正反应速率,增大Cl2转化率 |
您最近一年使用:0次
名校
解题方法
3 . 下列说法正确的是
| A.非自发进行的反应在任何条件下都不能发生 |
B. |
C.反应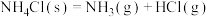 在室温下不可自发进行,则该反应的 在室温下不可自发进行,则该反应的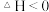 |
| D.“酒香不怕巷子深”“花香四溢”都体现了生活中的“熵增”原理 |
您最近一年使用:0次
4 . Ⅰ.铁触媒催化合成氨经历下图所示①至⑥步基元反应(从状态Ⅰ至状态Ⅶ):
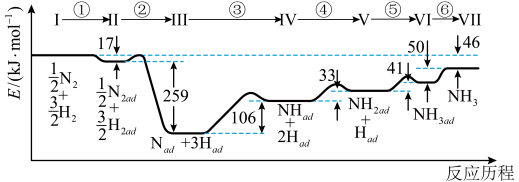
上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=___________ 。
(2)上述反应的ΔS___ 0(填“>”“<”或“=”)。已知:反应N2(g)+3H2(g) 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是____ (填标号)。
A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。
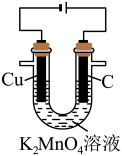
以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH______ (填“升高”“降低”或“不变”)。
(4)铜极、石墨极能否互换并简述理由:___________ 。
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中_______ (填离子符号)向左烧杯迁移。
(6)石墨极的电极反应式为_______ 。实验结论是氧化性:
___  (填>”“<”或“=”)。
(填>”“<”或“=”)。

上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g)
 2NH3(g) ΔH=
2NH3(g) ΔH=(2)上述反应的ΔS
 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。

以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH
(4)铜极、石墨极能否互换并简述理由:
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中
(6)石墨极的电极反应式为

 (填>”“<”或“=”)。
(填>”“<”或“=”)。
您最近一年使用:0次
2024-02-02更新
|
153次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题
名校
5 . 研究碳、氮等元素化合物的性质或转化对体会化学与生活有重要意义。
Ⅰ.以CO2和NH3为原料合成尿素总反应为:CO2 (g)+ 2NH3 (g) CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
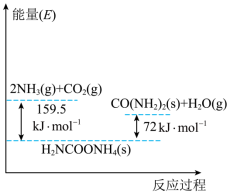
(1)总反应的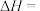
______  ,该反应在
,该反应在______ (填“高温”或“低温”或“任何条件都不”)可以自发进行。
(2)若该反应在恒容密闭容器中进行,判断该反应达到化学平衡状态的依据是________ (填字母序号)。
(3)在恒温、体积为1L的恒容装置中通入CO2和NH3各1mol 、1.5mol,达平衡时CO2的转化率为50%,平衡常数的值为_______ 。
Ⅱ.亚硝酸钠(NaNO2)是肉制品生产中常使用的一种食品添加剂,外观与食盐极为相似,具有较强毒性,误食可能造成死亡。已知常温下 Ka(HNO2)=1.75×10-4,Ka(CH3COOH)=1.8×10-5。
(4)常温下,pH=4的HNO2溶液中,由水电离出的c(H+)约为______ mol·L-1,浓度均为 0.1mol/L 的 NaNO2和 CH3COONa 的混合溶液中各离子浓度由大到小的关系为__________ 。
(5)高锰酸钾常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02000 mol·L-1 KMnO4标准溶液(酸性)进行滴定,反应离子方程式是: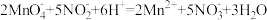 ,滴定结束后消耗KMnO4溶液VmL。
,滴定结束后消耗KMnO4溶液VmL。
进行滴定操作时无需另加指示剂,达到滴定终点时的现象是_______ ,测得该样品中NaNO2的质量分数为_______ 。(写出计算式)
Ⅰ.以CO2和NH3为原料合成尿素总反应为:CO2 (g)+ 2NH3 (g)
 CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
(1)总反应的
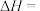
 ,该反应在
,该反应在(2)若该反应在恒容密闭容器中进行,判断该反应达到化学平衡状态的依据是________ (填字母序号)。
| A.反应速率2 v(CO2) = v(NH3) | B.混合气体中 CO2的浓度保持不变 |
| C.混合气体密度不变 | D.消耗2 mol NH3的同时生成 1 mol H2O |
(3)在恒温、体积为1L的恒容装置中通入CO2和NH3各1mol 、1.5mol,达平衡时CO2的转化率为50%,平衡常数的值为
Ⅱ.亚硝酸钠(NaNO2)是肉制品生产中常使用的一种食品添加剂,外观与食盐极为相似,具有较强毒性,误食可能造成死亡。已知常温下 Ka(HNO2)=1.75×10-4,Ka(CH3COOH)=1.8×10-5。
(4)常温下,pH=4的HNO2溶液中,由水电离出的c(H+)约为
(5)高锰酸钾常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02000 mol·L-1 KMnO4标准溶液(酸性)进行滴定,反应离子方程式是:
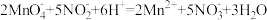 ,滴定结束后消耗KMnO4溶液VmL。
,滴定结束后消耗KMnO4溶液VmL。进行滴定操作时无需另加指示剂,达到滴定终点时的现象是
您最近一年使用:0次
6 . 以下过程在常温下都可以自发进行,可利用焓判据来解释的是
| A.2N2O5(g)=4N2O4(g)+O2(g) ΔH=+56.7kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1 |
| C.硝酸铵自发地溶于水 |
| D.湿衣服经过晾晒变干 |
您最近一年使用:0次
2024-01-28更新
|
40次组卷
|
2卷引用:四川省成都市成华区某校2023-2024学年高二上学期12月月考化学试题
名校
解题方法
7 . 下列推论正确的是
| A.S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则:ΔH1>ΔH2 |
| B.石墨燃烧热为393.5kJ·mol-1,则有2C(s)+O2(g)=2CO(g)ΔH=-393.5kJ·mol-1 |
| C.中和热为57.4kJ/mol,则有Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) ΔH<-114.8kJ/mol |
| D.已知CaCO3(s)=CaO(s)+CO2(g)ΔH>0,该反应任何温度下都能自发进行 |
您最近一年使用:0次
2024-01-28更新
|
37次组卷
|
3卷引用:四川省成都市成华区某校2023-2024学年高二上学期12月月考化学试题
名校
解题方法
8 . 甲醇(CH3OH)是重要有机化工原料,现在全球的能源紧张,甲醇需求也在增大。利用合成气(主要成分为CO和H2)在催化剂的作用下合成甲醇的方法是:CO(g)+2H2(g) CH3OH(g) ∆H。
CH3OH(g) ∆H。
(1)已知该反应为自发反应,则∆H___________ 0。(填“>”,“<”或“=”)
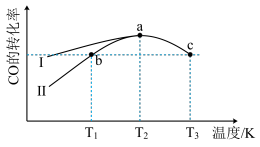
(2)向恒容密闭容器中充入一定量的CO和H2,在使用不同催化剂时,相同时间t内测得CO的转化率随温度的变化如下图所示,有关说法不正确的是___________。
(3)已知:v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH);p(CO),p(H2),p(CH3OH)为各组分气体的分压(分压=气体的物质的量分数×体系总压)。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
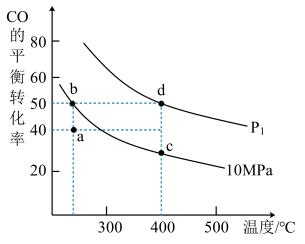
①P1___________ 10Mpa(填“>”或“<”);
②b、c、d三点平衡常数Kb、Kc、Kd三者之间的关系为___________ 。
③实际工业生产往往采用300-400℃和10Mpa的条件,其原因可能有___________ 。(至少写出两方面的原因)
④在10Mpa下,求a点的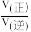 =
=___________ 。(保留1位小数)
 CH3OH(g) ∆H。
CH3OH(g) ∆H。(1)已知该反应为自发反应,则∆H
(2)向恒容密闭容器中充入一定量的CO和H2,在使用不同催化剂时,相同时间t内测得CO的转化率随温度的变化如下图所示,有关说法不正确的是___________。

| A.使用催化剂Ⅰ时,反应的活化能较高 |
| B.b点时v正>v逆。 |
| C.KT1对应的平衡常数等于KT3对应的平衡常数 |
| D.在相同时间t内,理论上最佳生产温度应为T2 |
(3)已知:v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH);p(CO),p(H2),p(CH3OH)为各组分气体的分压(分压=气体的物质的量分数×体系总压)。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。

①P1
②b、c、d三点平衡常数Kb、Kc、Kd三者之间的关系为
③实际工业生产往往采用300-400℃和10Mpa的条件,其原因可能有
④在10Mpa下,求a点的
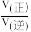 =
=
您最近一年使用:0次
名校
9 .  催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热 :
:
则 催化重整反应的
催化重整反应的
___________  。
。
(2)在体积为 的恒容密闭容器中分别通入
的恒容密闭容器中分别通入 和
和 ,发生反应:
,发生反应: 。
。
①该反应的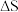
___________ 0(填“>”“<”或“=”),在(填“高温”或“低温”)条件下能自发进行。
②下列情况,能判断该反应达到平衡状态的是___________ (填字母)。
A.反应体系的密度保持不变 B.混合气体的平均摩尔质量不变
C. 和
和 的物质的量之比不变 D.混合气体中
的物质的量之比不变 D.混合气体中 的体积分数不变
的体积分数不变
(3)将原料按初始组成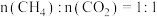 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应,达到平衡时
发生反应,达到平衡时 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
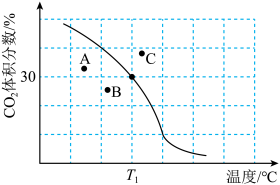
① 下,
下, (平衡时气体)
(平衡时气体) (初始气体)=
(初始气体)=___________ ;该温度下,此反应的平衡常数
___________  (以分压表示,列出计算式)。
(以分压表示,列出计算式)。
②若 三点表示不同温度和压强下已达平衡时
三点表示不同温度和压强下已达平衡时 的体积分数,
的体积分数,___________ 点对应的平衡常数最小,理由是___________ 。
(4)其它条件相同,在不同催化剂 作用下,反应
作用下,反应 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图:
的产率随反应温度的变化如图:
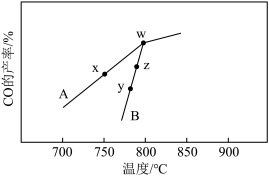
在催化剂 作用下,它们正、逆反应活化能差值分别用
作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则
___________ 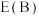 (填“>”、“<”或“=”下同)。
(填“>”、“<”或“=”下同)。
(5) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
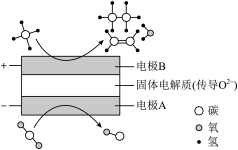
①阴极上的反应式为___________ 。
②若生成的乙烯和乙烷的体积比为3∶1,则消耗的 和
和 的体积比为
的体积比为___________ 。
 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热
 :
:| 物质 |  |  |  |
燃烧热 |  |  |  |
 催化重整反应的
催化重整反应的
 。
。(2)在体积为
 的恒容密闭容器中分别通入
的恒容密闭容器中分别通入 和
和 ,发生反应:
,发生反应: 。
。①该反应的
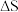
②下列情况,能判断该反应达到平衡状态的是
A.反应体系的密度保持不变 B.混合气体的平均摩尔质量不变
C.
 和
和 的物质的量之比不变 D.混合气体中
的物质的量之比不变 D.混合气体中 的体积分数不变
的体积分数不变(3)将原料按初始组成
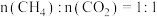 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应,达到平衡时
发生反应,达到平衡时 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①
 下,
下, (平衡时气体)
(平衡时气体) (初始气体)=
(初始气体)=
 (以分压表示,列出计算式)。
(以分压表示,列出计算式)。②若
 三点表示不同温度和压强下已达平衡时
三点表示不同温度和压强下已达平衡时 的体积分数,
的体积分数,(4)其它条件相同,在不同催化剂
 作用下,反应
作用下,反应 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图:
的产率随反应温度的变化如图:
在催化剂
 作用下,它们正、逆反应活化能差值分别用
作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则
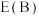 (填“>”、“<”或“=”下同)。
(填“>”、“<”或“=”下同)。(5)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极上的反应式为
②若生成的乙烯和乙烷的体积比为3∶1,则消耗的
 和
和 的体积比为
的体积比为
您最近一年使用:0次
名校
10 . 已知气相直接水合法可以制取乙醇:
 。在
。在 的条件下投料,乙烯的平衡转化率与温度(T)及压强(p)的关系如图所示。
的条件下投料,乙烯的平衡转化率与温度(T)及压强(p)的关系如图所示。

下列有关说法错误的是

 。在
。在 的条件下投料,乙烯的平衡转化率与温度(T)及压强(p)的关系如图所示。
的条件下投料,乙烯的平衡转化率与温度(T)及压强(p)的关系如图所示。
下列有关说法错误的是
A. 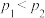 |
| B.如果温度过高,该反应不能自发进行 |
C.在 、280℃条件下,C点的 、280℃条件下,C点的 |
D.A点对应条件下反应的平衡常数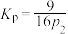 (用平衡分压代替浓度,分压=总压×物质的量分数) (用平衡分压代替浓度,分压=总压×物质的量分数) |
您最近一年使用:0次



