解题方法
1 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为:
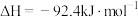
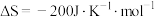
(1)下列关于工业合成氨的说法正确的是___________。
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___________
(3)工业上合成氨的部分工艺流程如图:
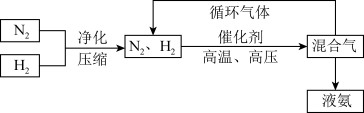
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因__________________ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度)。则:
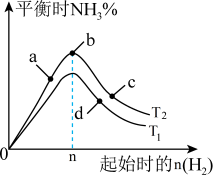
图象中T2和T1的关系是:T1___________ T2(填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________ (填字母)。
(5)恒温下,往一个4L的密闭容器中充入2 mol N2和5.2 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
此条件下该反应的化学平衡常数K =___________ ; 若维持容器体积不变,温度不变,往原平衡体系中加入N2、H2和NH3各4 mol,化学平衡将向___________ 反应方向移动(填“正”或“逆”)。

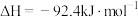
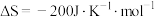
(1)下列关于工业合成氨的说法正确的是___________。
| A.因为ΔH<0,所以该反应一定能自发进行 |
| B.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行 |
| C.合成氨反应选择在400~500℃进行的重要原因是此温度下氨的产率最高 |
| D.生产中在考虑动力和设备材料承受能力的前提下,压强越大转化率越大 |
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 | B.2v正(H2)=3v逆(NH3) |
| C.容器内压强保持不变 | D.混合气体的密度保持不变 |

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度)。则:

图象中T2和T1的关系是:T1
(5)恒温下,往一个4L的密闭容器中充入2 mol N2和5.2 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/ mol∙L−1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
您最近一年使用:0次
名校
2 . 下列有关化学反应进行的方向和限度的说法中正确的是
A. ,平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数增大,正反应速率增大,平衡正向移动 ,平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数增大,正反应速率增大,平衡正向移动 |
B. 在常温下能自发进行,则该反应的 在常温下能自发进行,则该反应的 |
C.对于反应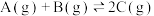 ,起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变 ,起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变 |
D.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下发生分解反应: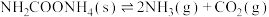 , , 的体积分数不再改变,则反应已达平衡 的体积分数不再改变,则反应已达平衡 |
您最近一年使用:0次
解题方法
3 . 向恒温恒容密闭容器中加入足量的Fe2O3(s)和CO(g),发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H>0,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
2Fe(s)+3CO2(g) △H>0,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
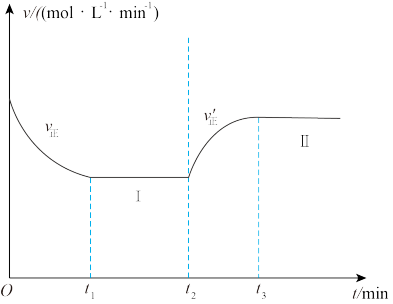
 2Fe(s)+3CO2(g) △H>0,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
2Fe(s)+3CO2(g) △H>0,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
| A.该反应在常温下能自发进行 |
| B.容器中气体变化的质量与固体变化的质量相等时达到平衡状态 |
| C.混合气体的平均相对分子质量不变时达到平衡状态 |
| D.t2时改变的条件是升高温度 |
您最近一年使用:0次
4 . 已知:①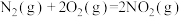
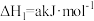
②
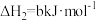
③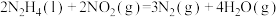

下列叙述错误的是
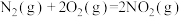
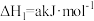
②

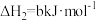
③
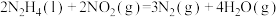

下列叙述错误的是
A. |
B.1mol 和 和 的总能量等于 的总能量等于 的总能量 的总能量 |
C.反应②中若生成 , , 将变小 将变小 |
| D.在常温下,反应③能自发进行 |
您最近一年使用:0次
2023-05-07更新
|
289次组卷
|
3卷引用:湖南省常德市第一中学2022~2023学年高二上学期期中考试化学试题
5 . 相同的温度和压强下,有关下列两个反应的说法不正确的是
注:其中Δn表示反应方程式中气体系数差;
| 反应 | ΔH/kJ•mol-1 | Δn | ΔS/J•K•mol-1 |
| MgCO3(s)=MgO(s)+CO2(g) | 117.6 | 1 | a |
| CaCO3(s)=CaO(s)+CO2(g) | 177.9 | 1 | b |
| A.因为Δn相同,所以a与b大小相近 |
| B.a-b=S[MgO(s)]+S[CaCO3(s)]-S[MgCO3(s)]-S[CaO(s)] |
| C.热分解温度:MgCO3(s)>CaCO3(s) |
| D.两个反应的ΔH和ΔS都大于零 |
您最近一年使用:0次
名校
6 . 关于反应
 ,下列说法正确的是
,下列说法正确的是

 ,下列说法正确的是
,下列说法正确的是| A.该反应在高温条件下可以自发进行 |
| B.向反应容器中加入催化剂,反应自发进行的临界温度会降低 |
| C.恒容条件下,通入He和Ar组成的混合气体,压强会增大,反应的速率会加快 |
D.恒容条件下,可通入过量的CO2气体来提高 转化率并增大生成物 转化率并增大生成物 的浓度 的浓度 |
您最近一年使用:0次
2023-05-05更新
|
361次组卷
|
7卷引用:陕西省西安市长安区第一中学2022-2023学年高二上学期期末考试(理科)化学试题
陕西省西安市长安区第一中学2022-2023学年高二上学期期末考试(理科)化学试题新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期末考试化学试题云南省昆明市云南师范大学附属中学2023-2024学年高二上学期期中联考化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)四川省绵竹中学2023-2024学年高二上学期第二次月考化学试题湖北省黄冈市黄梅国际育才高级中学2023-2024学年高二上学期12月月考化学试题陕西省西安市长安区第一中学2022-2023学年高一下学期第二次质量检测化学试题
名校
7 . 下列说法中错误的是
| A.焓降低且熵增加的反应,在任何温度下都能自发进行 |
| B.对于等物质的量的同一物质在不同状态时的熵值:气态>液态>固态 |
| C.平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大 |
| D.凡是能量达到活化能的分子发生的碰撞均为有效碰撞 |
您最近一年使用:0次
名校
8 . 对于反应4NH3(g)+5O2(g) 4NO(g) +6H2O(g) ΔH=-904 kJ·mol-1,下列有关说法不正确的是
4NO(g) +6H2O(g) ΔH=-904 kJ·mol-1,下列有关说法不正确的是
 4NO(g) +6H2O(g) ΔH=-904 kJ·mol-1,下列有关说法不正确的是
4NO(g) +6H2O(g) ΔH=-904 kJ·mol-1,下列有关说法不正确的是| A.该反应一定能自发进行 |
| B.该反应的正反应的活化能小于逆反应的活化能 |
| C.达到平衡时,增大容器的体积,v(正)增加、v(逆)减小 |
| D.断裂1mol N-H键的同时,断裂1mol O-H键,说明该反应达到平衡状态 |
您最近一年使用:0次
2023-04-30更新
|
200次组卷
|
2卷引用:江苏省连云港市东海县2022-2023学年高二上学期期中考试化学试题
名校
9 . 完成下列小题
(1)以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)=CO(g)+H2(g) △H =+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H =-43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(s) △H =-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H =
CaCO3(s)+2H2(g)的△H =___________ kJ/mol;
②反应I能自发进行的条件是___________ (填“较低温度”“较高温度”或“任何温度”)。
(2)在一定体积的密闭容器中,进行如下化学反应: CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
①该反应的化学平衡常数表达式为K=___________ 。
②该反应的逆反应为___________ (填“吸热”或“放热”)反应。
③在1200℃时,加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为___________ (保留三位有效数字)。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol∙L-1,c(H2)为1.5mol∙L-1,c(CO)为1mol∙L-1,c(H2O)为3mol∙L-1,则此时平衡___________ (填“向左移动”“向右移动”或“不移动”)。
(3)可将炼铁产生的CO2与CH4反应得到气体燃料,其反应原理为:CO2(g)+CH4(g)=2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
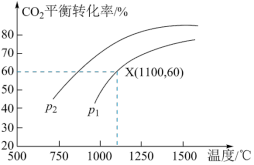
①压强:p1___________ p2(填“ ”或“
”或“ ”)。
”)。
②1100℃、p1KPa条件下,反应经tmin达到平衡,则平均反应速率v(CO2)=___________ mol/(L·min)。反应的平衡常数Kp=___________ (KPa)2(用含p1的代数式表示,Kp为以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(1)以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)=CO(g)+H2(g) △H =+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H =-43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(s) △H =-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g)的△H =
CaCO3(s)+2H2(g)的△H =②反应I能自发进行的条件是
(2)在一定体积的密闭容器中,进行如下化学反应: CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 2 | 4 |
回答下列问题:
①该反应的化学平衡常数表达式为K=
②该反应的逆反应为
③在1200℃时,加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol∙L-1,c(H2)为1.5mol∙L-1,c(CO)为1mol∙L-1,c(H2O)为3mol∙L-1,则此时平衡
(3)可将炼铁产生的CO2与CH4反应得到气体燃料,其反应原理为:CO2(g)+CH4(g)=2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。

①压强:p1
 ”或“
”或“ ”)。
”)。②1100℃、p1KPa条件下,反应经tmin达到平衡,则平均反应速率v(CO2)=
 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
22-23高二上·浙江杭州·期中
10 . 按要求完成下列问题。
(1)汽油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知反应的△H>0,判断该设想能否实现________ (填“能”或“不能”),并简述原因________________ 。
(2)甲烷的烧热△H = - 890.3kJ/mol,写出甲烷的燃烧热的热化学方程式:__________________ 。
(1)汽油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知反应的△H>0,判断该设想能否实现
(2)甲烷的烧热△H = - 890.3kJ/mol,写出甲烷的燃烧热的热化学方程式:
您最近一年使用:0次



