名校
解题方法
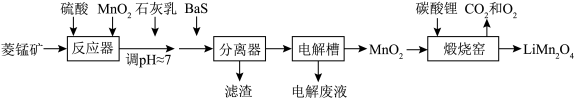
1 .  作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量
,含有少量 、
、 、
、 、
、 等元素)制备
等元素)制备 的流程如下:
的流程如下:
已知: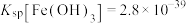 ,
,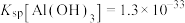 ,
,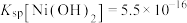 。
。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)加入少量
 的作用是
的作用是(3)溶矿反应完成后,反应器中溶液
 ,此时
,此时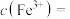
 ;用石灰乳调节至
;用石灰乳调节至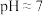 ,除去的金属离子是
,除去的金属离子是(4)加入少量
 溶液除去
溶液除去 ,生成的沉淀有
,生成的沉淀有(5)在电解槽中,发生电解反应的离子方程式为
(6)煅烧窑中,生成
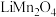 反应的化学方程式是
反应的化学方程式是
您最近一年使用:0次
2023-09-02更新
|
442次组卷
|
3卷引用:湖南省长沙市弘益高级中学2023-2024学年高三上学期第四次月考化学试卷
名校
解题方法
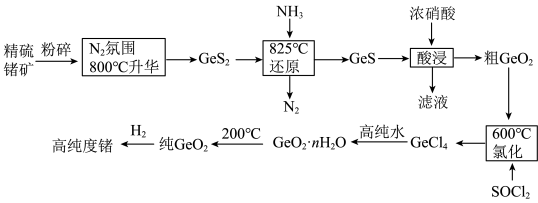
2 . 门捷列夫最早预言了具有半导体特性类硅元素锗(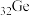 ),工业上用精硫锗矿(主要成分为
),工业上用精硫锗矿(主要成分为 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;
②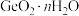 在5.3
在5.3  的盐酸中溶解度最小。
的盐酸中溶解度最小。
(1)基态锗原子的价层电子排布式为___________ ,晶体锗的晶体类型是___________ 。
(2)800℃,使精硫锗矿在 氛围中升华的原因:
氛围中升华的原因:___________ 。
(3)还原时发生反应: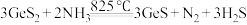 ,比较键角:
,比较键角:
___________  (填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)
(填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)___________ 。
(4)酸浸时温度不能过高的原因:___________ 。
(5)氯化除生成 外,反应还生成一种V形分子,写出相应的化学方程式:
外,反应还生成一种V形分子,写出相应的化学方程式:___________ 。
(6) 水解得到
水解得到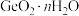 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是___________ 。
(7) 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
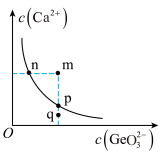
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
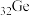 ),工业上用精硫锗矿(主要成分为
),工业上用精硫锗矿(主要成分为 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;
②
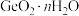 在5.3
在5.3  的盐酸中溶解度最小。
的盐酸中溶解度最小。(1)基态锗原子的价层电子排布式为
(2)800℃,使精硫锗矿在
 氛围中升华的原因:
氛围中升华的原因:(3)还原时发生反应:
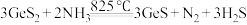 ,比较键角:
,比较键角:
 (填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)
(填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)(4)酸浸时温度不能过高的原因:
(5)氯化除生成
 外,反应还生成一种V形分子,写出相应的化学方程式:
外,反应还生成一种V形分子,写出相应的化学方程式:(6)
 水解得到
水解得到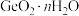 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是(7)
 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
A.n点与p点对应的 相等 相等 |
B.q点无 沉淀生成 沉淀生成 |
| C.通过蒸发可以使溶液由q点变到p点 |
D.加入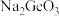 可以使溶液由n点变到m点 可以使溶液由n点变到m点 |
您最近一年使用:0次
2023-09-01更新
|
1154次组卷
|
8卷引用:湖南省长沙市长郡中学、衡阳市第八中学2024届高三8月大联考化学试题
3 . 下列实验的方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 实验方案设计 | 实验现象和结论 |
| A | 检验某固体试样中是否存在三价铁 | 取少量固体试样完全溶于盐酸,再滴加KSCN溶液 | 没有出现血红色,说明该固体试样中不存在三价铁 |
| B | 检验溴乙烷中溴元素 | 溴乙烷和NaOH溶液混合,振荡后加热,静置分层后,取少量上层清液,移入另一支试管中,加入2滴 溶液 溶液 | 若有淡黄色沉淀产生,则说明溴乙烷中含溴元素 |
| C | 比较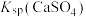 与 与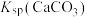 的大小 的大小 | 向饱和 溶液中滴加相同浓度的 溶液中滴加相同浓度的 溶液 溶液 | 产生白色沉淀,说明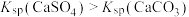 |
| D | 探究电石与水的反应 | 将电石与饱和食盐水反应产生的气体通入酸性高锰酸钾溶液 | 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-01更新
|
1265次组卷
|
9卷引用:湖南省长沙市长郡中学、衡阳市第八中学2024届高三8月大联考化学试题
湖南省长沙市长郡中学、衡阳市第八中学2024届高三8月大联考化学试题湖南省长沙市湖南师范大学附属中学2023-2024学年高三上学期第一次质量检测化学试题湖南省名校大联考2024届高三上学期第一次质量检测化学试题湖南四大名校2024届高三上学期第一次联考化学试题湖南省炎德英才联考2024届高三上学期第一次质量检测化学试题(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江西省宜春市宜丰中学创新部2023-2024学年高三上学期第一次月考化学试题江苏省句容三中、海安实验中学联考2023-2024学年高三上学期10月月考化学试题重庆市江北区2023-2024学年高三下学期模拟测试化学试题(七)
名校
4 . 常温下,Ksp(CaSO4)=9×10-6 mol2·L-2,常温下CaSO4在水溶液中的沉淀溶解平衡曲线如图。下列说法不正确的是
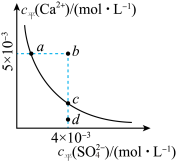

A.CaSO4溶解在水中,c平(Ca2+)=c平(SO )=3×10-3 mol·L-1 )=3×10-3 mol·L-1 |
| B.在d点溶液中加入一定量的CaCl2可能会有沉淀析出 |
| C.a点对应的Ksp等于c点对应的Ksp |
D.b点将有沉淀生成,平衡后溶液中c平(SO )等于3×10-3 mol·L-1 )等于3×10-3 mol·L-1 |
您最近一年使用:0次
2023-08-26更新
|
620次组卷
|
5卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期中考试化学试题
5 . 已知:Ksp(AgCl)=1.8×10-10 ,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI>Ag2CrO4 | B.AgCl>Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
您最近一年使用:0次
2023-08-14更新
|
1018次组卷
|
55卷引用:湖南省雅礼中学2019-2020学年高二上学期第一次月考化学试题
湖南省雅礼中学2019-2020学年高二上学期第一次月考化学试题湖南省长郡中学2020-2021学年高二上学期期中考试化学试题湖南省长沙市宁乡市四校联考2022-2023学年高二上学期11月月考化学试题2010年普通高等学校招生全国统一考试化学试题(海南卷)2010年高考化学试题分项专题十 电解质溶液(已下线)2010年北京五中高二下学期期末考试化学试题(已下线)2010—2011学年山西省大同一中高二上学期期末考试化学试卷(已下线)2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷(已下线)2011-2012学年江西省九江一中高二上学期第二次月考化学试卷(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷(已下线)2011-2012学年河北省元氏一中高二上学期期中考试化学试卷(已下线)2012-2013学年山东省济宁市泗水一中高二12月质量检测化学试卷(已下线)2012-2013学年福建省南安一中高二上学期期末考试化学试卷(已下线)2013-2014学年湖北省恩施高中高二12月月考化学试卷2014-2015湖南省怀化市中小学课改高二上学期期末化学试卷2014-2015河北省隆化县存瑞中学高二下学期期中考试化学试卷2015-2016学年湖南省衡阳县高二上学期期末统考化学试卷2015-2016学年湖北省武汉三十九中高二上学期期末化学试卷2015-2016学年青海师大附属二中高二下4月月考化学试卷2015-2016学年福建师大附中高二下期中化学试卷2017届湖北省枣阳市高级中学高三上学期8月月考化学试卷2017届内蒙古赤峰二中高三上第二次月考化学试卷广西陆川县中学2017-2018学年高二上学期期中考试化学试题河北省衡水市安平中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡内蒙古包头市第四中学2017-2018学年高二上学期期末考试化学试题(已下线)2018年11月15日 《每日一题》人教选修4-溶度积的应用【全国百强校】贵州省铜仁市第一中学2018-2019学年高二下学期开学考试化学试题步步为赢 高二化学暑假作业:作业十 水溶液中的离子平衡陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算黑龙江省哈尔滨市第三中学2019-2020学年高二上学期期中考试化学(理)试题陕西省咸阳市西藏民族大学附属中学2019-2020学年高二上学期第二次月考化学试题2019年秋高三化学复习强化练习—— 与浓度积的相关计算(强化练)吉林省通化市梅河口市博文学校2019-2020学年高二上学期第二次月考化学试题(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷湖北省恩施州清江外国语学校2020-2021学年高二上学期10月月考化学试题河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡(已下线)练习14 难溶电解质的沉淀溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)贵州省蟠龙高级中学2020-2021学年高二上学期第二次月考化学试题黑龙江省大庆中学2021-2022学年高二上学期期末考试化学试题(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)河南省新乡市第一中学2022-2023学年高二上学期第一次月考化学试题湖北省罗田县第一中学2021-2022学年高二上学期12月月考化学试题山西省太原市英才学校2021-2022学年高二上学期第二次月考化学试题山东省潍坊第一中学2022-2023学年高二上学期期末考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)第1课时 沉淀溶解平衡与溶度积作业(二十一) 沉淀溶解平衡与溶度积天津市第一中学2023-2024学年高二上学期期末考试化学试卷山东师大附中幸福柳分校2023-2024学年高二上学期12月份化学学科阶段性测试(已下线)湖南省郴州市临武县第一中学2023-2024学年高三下学期5月期中化学试题
名校
解题方法
6 . 下列反应的离子方程式正确的是
A.水杨酸与过量碳酸钠溶液反应:2 + +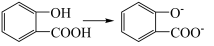 +2 +2 |
B.向碘化亚铁溶液中滴加少量稀硝酸: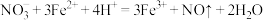 |
C.Mg(HCO3)2溶液中加足量的烧碱溶液: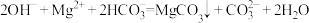 |
D.二元弱酸亚磷酸(H3PO3)溶液中滴加少量的NaOH溶液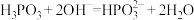 |
您最近一年使用:0次
2023-08-12更新
|
522次组卷
|
4卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题
名校
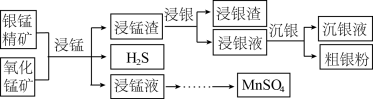
7 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下, 的氧化性强于
的氧化性强于 ;
;
Ⅱ.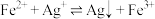 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:________ 。
②“浸锰”过程中,发生反应: ,则可推断:
,则可推断: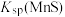
________ (填“>”或“<”)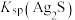 。
。
③在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有________ 。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_____ 。
________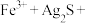 ________
________ ________
________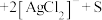
②结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用:________ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有 和
和________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:________ 。
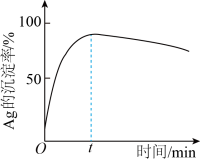
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下,
 的氧化性强于
的氧化性强于 ;
;Ⅱ.
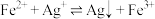 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①写出Mn元素基态原子的价层电子排布式:
②“浸锰”过程中,发生反应:
 ,则可推断:
,则可推断: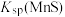
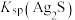 。
。③在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
________
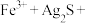 ________
________ ________
________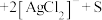
②结合平衡移动原理,解释浸出剂中
 、
、 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
 和
和②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
2023-07-19更新
|
605次组卷
|
2卷引用:湖南师范大学附属中学2024届高三摸底考试化学试题
名校
8 . 下列实验操作和现象与结论一致的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向含有 和 和 的白色悬浊液中滴加少量 的白色悬浊液中滴加少量 溶液,有黑色沉淀生成 溶液,有黑色沉淀生成 |  |
| B | 向 溶液中逐滴加入 溶液中逐滴加入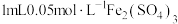 溶液,再滴加少量 溶液,再滴加少量 溶液,溶液变红色 溶液,溶液变红色 |  与 与 的反应有一定的限度 的反应有一定的限度 |
| C | 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体经水洗后,再通入酸性 溶液中,溶液褪色 溶液中,溶液褪色 | 溴乙烷发生了取代反应 |
| D | 用 计分别测定饱和 计分别测定饱和 和 和 溶液的 溶液的 ,前者 ,前者 大 大 | 水解程度: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 某含砷( )的有毒工业废水经如图流程转化为粗
)的有毒工业废水经如图流程转化为粗 ,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。

(1)砷是氮的同族元素,且比氮多2个电子层,则 在元素周期表中的位置为
在元素周期表中的位置为___________ ; 的电子式为
的电子式为___________ 。
(2)“碱浸”的目的是将废水中的 和
和 转化为盐。
转化为盐。 属于
属于___________ 电解质(填“强”或“弱”), 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(3)“氧化”时,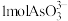 转化为
转化为 至少需要
至少需要
___________  。
。
(4)“沉砷”是将砷元素转化为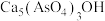 沉淀,发生的主要反应有
沉淀,发生的主要反应有
①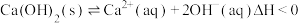
②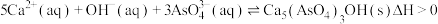
资料表明:“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是
时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是___________ 。
(5)从绿色化学和综合利用的角度考虑,滤液2需要处理,可将滤液2返回___________ 环节循环使用。
 )的有毒工业废水经如图流程转化为粗
)的有毒工业废水经如图流程转化为粗 ,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
(1)砷是氮的同族元素,且比氮多2个电子层,则
 在元素周期表中的位置为
在元素周期表中的位置为 的电子式为
的电子式为(2)“碱浸”的目的是将废水中的
 和
和 转化为盐。
转化为盐。 属于
属于 转化为
转化为 的离子方程式为
的离子方程式为(3)“氧化”时,
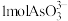 转化为
转化为 至少需要
至少需要
 。
。(4)“沉砷”是将砷元素转化为
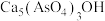 沉淀,发生的主要反应有
沉淀,发生的主要反应有①
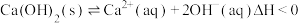
②
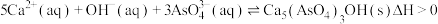
资料表明:“沉砷”的最佳温度是
 ,温度高于
,温度高于 时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是
时,随温度升高,沉淀率减小,从平衡移动角度分析其原因是(5)从绿色化学和综合利用的角度考虑,滤液2需要处理,可将滤液2返回
您最近一年使用:0次
名校
解题方法
10 . 湿法炼锌工业废水中主要阳离子有 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
① 能够在
能够在 为
为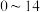 的范围内以离子态稳定存在,不易与
的范围内以离子态稳定存在,不易与 形成沉淀
形成沉淀
② 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示
③部分物质的
④排放标准:Tl的含量低于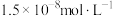
(1)已知“氧化”步骤中 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:___________ 。
(2)“预中和”步骤,加 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少___________ (填化学式)污染物的生成。
(3)“硫化”步骤的主要目的是除去___________ (填离子符号)。
(4)根据 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于___________ ,但是实际工艺流程需在“中和”步骤加 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是___________ 。
(5)“脱钙”步骤的目的是___________ 。
(6)“离子交换”步骤中可用普鲁士蓝{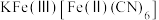 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为___________  (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
①
 能够在
能够在 为
为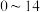 的范围内以离子态稳定存在,不易与
的范围内以离子态稳定存在,不易与 形成沉淀
形成沉淀②
 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示③部分物质的

| 物质 |  |  |  |  |
 | 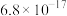 |  |  |  |
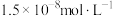
(1)已知“氧化”步骤中
 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:(2)“预中和”步骤,加
 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(3)“硫化”步骤的主要目的是除去
(4)根据
 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是(5)“脱钙”步骤的目的是
(6)“离子交换”步骤中可用普鲁士蓝{
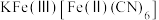 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。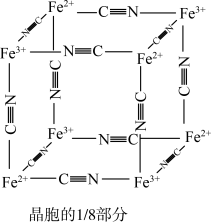
您最近一年使用:0次
2023-07-12更新
|
2338次组卷
|
6卷引用:湖南省长沙市长郡中学2024届高三高考适应性考试(二)化学试题



