名校
1 . 研究一个化学反应时,往往需要关注反应进行的方向、快慢,反应的限度以及反应的能量变化。下面是Na2CO3等常见物质所涉及的性质和反应,请按要求填空:
(1)已知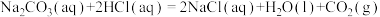
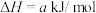
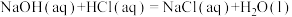
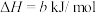
二氧化碳气体通入足量氢氧化钠溶液发生的反应为___________ 反应(填“放热”或“吸热”),其热化学方程式为___________ ( 用含a和b的代数式表示)。
用含a和b的代数式表示)。
(2)Na2CO3和盐酸反应生成CO2的速率非常大,其根本原因是___________ ,为降低反应速率,可采取的措施是___________ 。(任写两点)
(3)向滴有酚酞的Na2CO3溶液中,逐滴滴加盐酸,当溶液恰好为无色时,溶液呈___________ (填“酸性”“碱性”或“中性”),该无色溶液的电荷守恒式可表示为___________ 。(忽略酚酞对溶液中离子的影响)
(4)向Na2CO3溶液中加少量BaSO4固体,发生的离子反应方程式为___________ 。已知: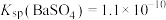 ,
,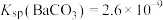 。
。
(1)已知
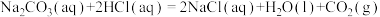
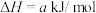
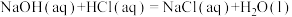
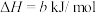
二氧化碳气体通入足量氢氧化钠溶液发生的反应为
 用含a和b的代数式表示)。
用含a和b的代数式表示)。(2)Na2CO3和盐酸反应生成CO2的速率非常大,其根本原因是
(3)向滴有酚酞的Na2CO3溶液中,逐滴滴加盐酸,当溶液恰好为无色时,溶液呈
(4)向Na2CO3溶液中加少量BaSO4固体,发生的离子反应方程式为
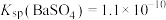 ,
,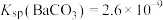 。
。
您最近一年使用:0次
2023-11-09更新
|
128次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 . 银作为一种战略金属,在电子、化工、医药等行业广泛使用。某铅锌矿(含有PbCO3、ZnCO3、ZnO等)中含有低品位的辉银矿(Ag2S与自然Ag共生),可以采用NaCN溶液氰化法提取出银,能耗低,生产工艺简便。其炼制工艺简介如图:
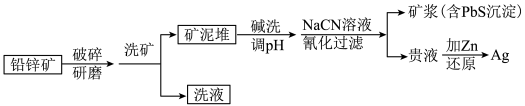
已知:①HCN是一种弱酸,易挥发,有毒性,Ka=6.2×10-10。
②ZnCO3、ZnO易溶解于NaCN溶液中,且NaCN对游离态和化合态的银均能以[Ag(CN)2]-形式浸出。
③调pH过程中,PbCO3已经溶解为Pb(OH) 。
。
(1)NaCN的电子式为_______ 。
(2)铅锌矿破碎研磨的目的是_______ 。
(3)“碱洗”后需调pH,使pH>12,方可进行NaCN溶液喷淋,其目的是_______ 。
(4)“氰化”过程中Ag2S与NaCN溶液反应的化学方程式为_______ ,调pH后不经过“过滤”操作直接加NaCN溶液“氰化”的理由是_______ 。
(5)矿泥堆要有良好的渗透性和孔隙度,其原因是_______ 。
(6)“氰化法”中最终矿浆需要用NaClO溶液消毒处理,发生的离子反应方程式为_______ ,处理100m3含NaCN10.3mg/L的废水,实际至少需NaClO_______ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准。

已知:①HCN是一种弱酸,易挥发,有毒性,Ka=6.2×10-10。
②ZnCO3、ZnO易溶解于NaCN溶液中,且NaCN对游离态和化合态的银均能以[Ag(CN)2]-形式浸出。
③调pH过程中,PbCO3已经溶解为Pb(OH)
 。
。(1)NaCN的电子式为
(2)铅锌矿破碎研磨的目的是
(3)“碱洗”后需调pH,使pH>12,方可进行NaCN溶液喷淋,其目的是
(4)“氰化”过程中Ag2S与NaCN溶液反应的化学方程式为
(5)矿泥堆要有良好的渗透性和孔隙度,其原因是
(6)“氰化法”中最终矿浆需要用NaClO溶液消毒处理,发生的离子反应方程式为
您最近一年使用:0次
3 . 一种废镍催化剂中含有Ni、Al、Cr、Cu、FeS及碳粉,以其为原料制备环烷酸镍[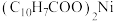 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
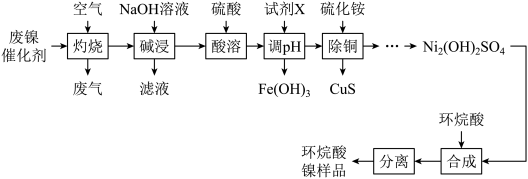
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“灼烧”后Cr转化为 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、___________ 。基态Cr原子的价层电子排布式为___________ 。
(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是___________ 。
(3)“调pH”时,溶液pH的范围为___________ 。
(4)常温下,CuS的 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
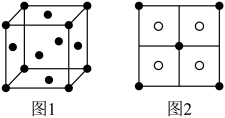
①与 距离最近的
距离最近的 数目为
数目为___________ 。
②CuS的晶胞参数为apm,阿伏加德罗常数的值为 ,则CuS晶体的密度为
,则CuS晶体的密度为___________  。
。
(5)环烷酸的化学式为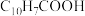 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:___________ 。
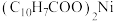 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.9 | 7.0 | 6.4 | 5.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 8.4 | 6.7 |
(1)“灼烧”后Cr转化为
 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是
(3)“调pH”时,溶液pH的范围为
(4)常温下,CuS的
 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与
 距离最近的
距离最近的 数目为
数目为②CuS的晶胞参数为apm,阿伏加德罗常数的值为
 ,则CuS晶体的密度为
,则CuS晶体的密度为 。
。(5)环烷酸的化学式为
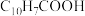 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:
您最近一年使用:0次
2023-10-16更新
|
244次组卷
|
2卷引用:湖南省长沙市第一中学2023-2024学年高三上学期月考卷(三)化学试题
名校
解题方法
4 . 烟道灰中含有 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:

已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
② 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。

回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为___________ 。
(2)试剂X可能为___________。
(3)步骤M的目的是___________ ;
(4)步骤M后应调节 的范围为
的范围为___________ ;不同 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为___________ 。
(5) 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为___________ 。
(6)某实验室设计了如图b所示装置,通过通入 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为___________ 。

 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
| 金属离子 |  |  |  |
| 开始沉淀的pH | 7.0 | 1.9 | 8.1 |
| 完全沉淀的pH | 9.0 | 3.2 | 10.1 |
 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为
(2)试剂X可能为___________。
A. 溶液 溶液 | B.氨水 | C. 溶液 溶液 | D.稀 |
(3)步骤M的目的是
(4)步骤M后应调节
 的范围为
的范围为 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为(5)
 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为(6)某实验室设计了如图b所示装置,通过通入
 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 通过绿柱石(xBeO•yAl2O3•zSiO2)获取BeO的常用方法有酸浸法和氟化法两种,其操作流程如图:
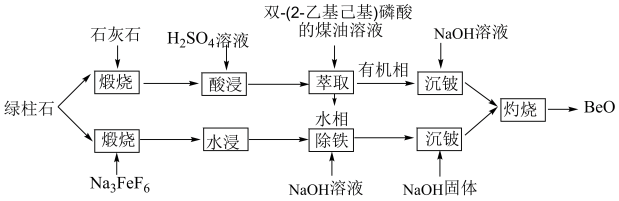
I.酸浸法:
(1)根据元素周期表“对角线原则”,Be与_______ 元素(填元素符号)性质相似。
(2)已知Be在有机相和水相中分配比(即萃取的浓度比)约为2:1,为了使Be2+的萃取率达到99%以上,可采用的有效措施有_______ 。
Ⅱ.氟化法:
(3)加Na3FeF6“煅烧”时,有Na2BeF4生成,其中[BeF4]2-的中心原子杂化方式为________ 。
(4)加入NaOH“除铁”,是为了除去过量的Na3FeF6,则发生反应的离子方程式为_______ 。
(5)常温下,加入NaOH“沉铍”,当pH=12时,沉铍率为________ (计算结果保留三位有效数字){已知:沉铍前,溶液中c(BeF )=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F-
)=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F- BeF
BeF ,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是
,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是________ 。
(6)绿柱石属于硅酸盐材料,其晶体结构中含有[Si6P18]环状硅酸盐单元;z轴方向上,相邻两层[Si6P18]环投影图如图甲,晶胞结构如图乙。
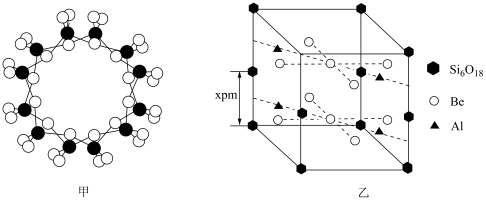

①z轴方向上,晶胞参数 为2xpm,而不是xpm的原因是
为2xpm,而不是xpm的原因是_______ 。
②已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数(一个微粒周围最邻近的微粒的数目)均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1:2。通过计算可确定Al的配位数为________ 。

I.酸浸法:
(1)根据元素周期表“对角线原则”,Be与
(2)已知Be在有机相和水相中分配比(即萃取的浓度比)约为2:1,为了使Be2+的萃取率达到99%以上,可采用的有效措施有
Ⅱ.氟化法:
(3)加Na3FeF6“煅烧”时,有Na2BeF4生成,其中[BeF4]2-的中心原子杂化方式为
(4)加入NaOH“除铁”,是为了除去过量的Na3FeF6,则发生反应的离子方程式为
(5)常温下,加入NaOH“沉铍”,当pH=12时,沉铍率为
 )=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F-
)=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F- BeF
BeF ,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是
,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是(6)绿柱石属于硅酸盐材料,其晶体结构中含有[Si6P18]环状硅酸盐单元;z轴方向上,相邻两层[Si6P18]环投影图如图甲,晶胞结构如图乙。


①z轴方向上,晶胞参数
 为2xpm,而不是xpm的原因是
为2xpm,而不是xpm的原因是②已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数(一个微粒周围最邻近的微粒的数目)均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1:2。通过计算可确定Al的配位数为
您最近一年使用:0次
名校
解题方法
6 . 向 饱和溶液(有足量
饱和溶液(有足量 固体)中滴加氨水,发生反应
固体)中滴加氨水,发生反应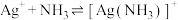 和
和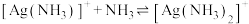 ,
,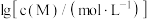 与
与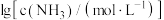 的关系如图所示{其中
的关系如图所示{其中 代表
代表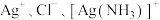 或
或 }。
}。
 饱和溶液(有足量
饱和溶液(有足量 固体)中滴加氨水,发生反应
固体)中滴加氨水,发生反应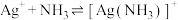 和
和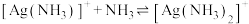 ,
,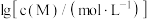 与
与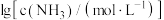 的关系如图所示{其中
的关系如图所示{其中 代表
代表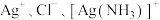 或
或 }。
}。
A.曲线Ⅲ表示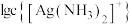 随 随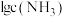 的变化曲线 的变化曲线 |
B.随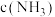 增大, 增大, 先增大后减小 先增大后减小 |
C.反应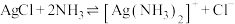 的平衡常数为 的平衡常数为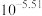 |
D.完全溶解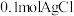 ,至少需要含有 ,至少需要含有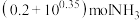 的氨水 的氨水 |
您最近一年使用:0次
2023-10-06更新
|
900次组卷
|
8卷引用:湖南省长沙市雅礼中学2023-2024学年高二下学期期中考试化学试题
7 . 某中学化学社进行沉淀溶解平衡相关实验,操作流程如下。下列说法正确的是
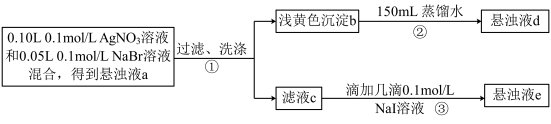
已知:常温下, ,
, ,
,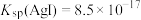

已知:常温下,
 ,
, ,
,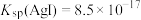
A.悬浊液a中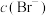 与悬浊液d中 与悬浊液d中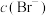 相等 相等 |
B.步骤③可以证明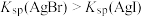 |
| C.向悬浊液e中滴加几滴0.1mol/LNaCl溶液,观察到黄色沉淀转化为白色沉淀 |
D.向悬浊液d中加入少量NaI溶液,沉淀颜色不变时,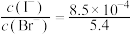 |
您最近一年使用:0次
2023-10-04更新
|
283次组卷
|
2卷引用:湖南省长沙市长郡中学2024届高三上学期月考(2)化学试题
8 . 某温度时,可用 沉淀
沉淀 、
、 、
、 三种离子(用
三种离子(用 表示),所需
表示),所需 最低浓度的对数值
最低浓度的对数值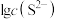 与
与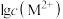 的关系如图所示。下列说法正确的是。
的关系如图所示。下列说法正确的是。
 沉淀
沉淀 、
、 、
、 三种离子(用
三种离子(用 表示),所需
表示),所需 最低浓度的对数值
最低浓度的对数值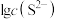 与
与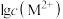 的关系如图所示。下列说法正确的是。
的关系如图所示。下列说法正确的是。
A.三种离子对应的硫化物中 (CuS)最小,约为 (CuS)最小,约为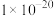 |
B.向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动, 增大 增大 |
C.可用MnS除去 溶液中混有的少量杂质 溶液中混有的少量杂质 |
D.向浓度均为 mol/L的 mol/L的 、 、 、 、 混合溶液中逐滴加入 混合溶液中逐滴加入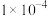 mol/L的 mol/L的 溶液, 溶液, 先沉淀 先沉淀 |
您最近一年使用:0次
2023-09-17更新
|
616次组卷
|
3卷引用:湖南省长沙市实验中学2023-2024学年高二上学期期中考试化学试题
9 . 下列过程不涉及化学变化的是
| A.含氯消毒剂杀灭病毒 | B.利用石油裂解得到化工原料 |
| C.利用皮渗透膜从海水中分离出淡水 | D.含氟牙膏能预防龋齿 |
您最近一年使用:0次
2023-09-12更新
|
263次组卷
|
3卷引用:湖南师范大学附属中学2023-2024学年高三上学期第一次月考化学试题
名校
10 . 综合利用粉煤灰既有利于环境保护,又有利于资源节约。某种粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:

(1)“酸浸”时Fe2O3发生反应的离子方程式为___________ 。
(2)当硫酸浓度大于9.2molL1时,铝、铁的浸出率下降。可能原因是___________ 。
(3)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。“还原”操作加入的试剂为___________ 。“沉铝”过程中加入氨水调pH的范围是___________ ,“沉铝”反应的方程式为___________ 。

(4)“再生”过程中,[Fe(NO)2]2在微生物的作用下与C6H12O6发生反应,生成N2与CO2的物质的量之比为___________ 。

(1)“酸浸”时Fe2O3发生反应的离子方程式为
(2)当硫酸浓度大于9.2molL1时,铝、铁的浸出率下降。可能原因是
(3)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。“还原”操作加入的试剂为

(4)“再生”过程中,[Fe(NO)2]2在微生物的作用下与C6H12O6发生反应,生成N2与CO2的物质的量之比为
您最近一年使用:0次
2023-09-06更新
|
112次组卷
|
2卷引用:湖南省长沙麓山国际实验学校2023-2024学年高二上学期入学考试化学试题



