名校
1 . 下列实验中,能达到实验目的是
| A | B | C | D |
| 实现将反应Cu+2Fe3+=Cu2++2Fe2+的化学能转变为电能 | 验证非金属性强弱:Cl>C>Si | 证明:相同温度下的溶解度:Mg(OH)2>Fe(OH)3 | 探究浓度对化学平衡的影响规律: +H2O +H2O 2 2 +2H+ +2H+ |
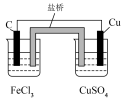 |  |  | 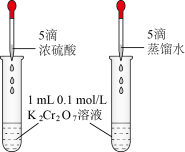 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 锶与钙位于同一主族,其化合物应用广泛,SrSO4常用于陶瓷工业。以青石精矿(主要含SrSO4)为原料制备高纯硫酸锶的部分工艺流程如图所示:

A.气体 可以循环利用 可以循环利用 |
B.“转化”的总离子方程式为 |
| C.“转化”中反应温度不宜过高且控制氨水过量 |
| D.流程中涉及分解反应和化合反应 |
您最近一年使用:0次
2024-01-13更新
|
403次组卷
|
3卷引用:2024届湖南省长沙市雅礼中学高三下学期4月综合测试化学试题
2024届湖南省长沙市雅礼中学高三下学期4月综合测试化学试题山西省大同市教育局2023-2024学年高三上学期冬季检测化学试卷(已下线)第01讲 物质的分类及转化(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
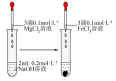
3 .  时,用
时,用 溶液分别滴定等物质的量浓度的
溶液分别滴定等物质的量浓度的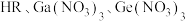 三种溶液pM[p表示负对数,
三种溶液pM[p表示负对数, 表示
表示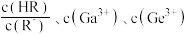 ]随溶液
]随溶液 变化的关系如图所示。已知:常温下,
变化的关系如图所示。已知:常温下,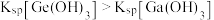 。下列推断正确的是
。下列推断正确的是
 时,用
时,用 溶液分别滴定等物质的量浓度的
溶液分别滴定等物质的量浓度的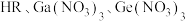 三种溶液pM[p表示负对数,
三种溶液pM[p表示负对数, 表示
表示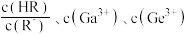 ]随溶液
]随溶液 变化的关系如图所示。已知:常温下,
变化的关系如图所示。已知:常温下,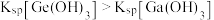 。下列推断正确的是
。下列推断正确的是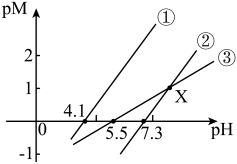
A.曲线③代表 与 与 的关系曲线 的关系曲线 |
B.调节 时,可将废水中 时,可将废水中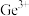 完全沉淀 完全沉淀 |
C.滴定 溶液至X点时,溶液中: 溶液至X点时,溶液中: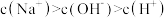 |
D.经计算,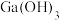 能完全溶于HR溶液 能完全溶于HR溶液 |
您最近一年使用:0次
2024-01-13更新
|
540次组卷
|
8卷引用:湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题
湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题山东省齐鲁名校2022-2023学年高三下学期3月大联考化学试题黑龙江省哈尔滨市重点三校(哈九中、哈六中、哈一中)2023-2024学年高三上学期期末联考化学试题题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)黑龙江省哈尔滨市重点三校(哈九中、哈六中、哈一中)2023-2024学年高三上学期 期末化学试卷河南省信阳高级中学2023-2024学年高三下学期3月月考理综试题-高中化学(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届河南省许昌市部分学校高三下学期高考冲刺(一)理科综合试题-高中化学
名校
解题方法
4 . 某锂离子电池正极由钴酸锂(LiCoO2)、铝箔、石墨等组成。某研究小组利用该锂离子电池正极材料回收制备Co3O4,同时回收锂,流程如下:

某些物质的溶解度(s)如下表所示:
请回答下列问题:
(1)写出钴元素基态原子的价层电子排布式___________ ,Co在周期表中的位置为___________ ,Co3+中有多少种运动状态的电子___________ 。
(2)过程Ⅰ浸出液产生气泡,钴酸锂发生反应的化学方程式为___________ 。
(3)过程Ⅱ中,不同pH下金属离子的去除效果如图所示。该过程加碱调节pH的范围是___________ 。

(4)过程Ⅳ中操作方法为:向滤液中加入稍过量的___________ ,充分搅拌,加热浓缩,___________ ,用热水洗涤后干燥。
(5)过程Ⅴ中,常温下CoC2O4开始转化为Co(OH)2的pH为___________ 。(已知:Ksp[Co(OH)2]=2.0×10-15,Ksp[CoC2O4]=4.0×10-8)

某些物质的溶解度(s)如下表所示:
| t/℃ | 20 | 40 | 60 | 80 |
| s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)写出钴元素基态原子的价层电子排布式
(2)过程Ⅰ浸出液产生气泡,钴酸锂发生反应的化学方程式为
(3)过程Ⅱ中,不同pH下金属离子的去除效果如图所示。该过程加碱调节pH的范围是

(4)过程Ⅳ中操作方法为:向滤液中加入稍过量的
(5)过程Ⅴ中,常温下CoC2O4开始转化为Co(OH)2的pH为
您最近一年使用:0次
5 . 常温下,分别向体积均为10mL、浓度均为0.1mol/L的FeCl2和MnCl2溶液中滴加0.1mol/L的K2S溶液,滴加过程中溶液-1gc(Fe2+)和-1gc(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知:Ksp(MnS)>Ksp(FeS),lg3≈0.5,忽略溶液混合时温度和体积的变化],下列说法正确的是
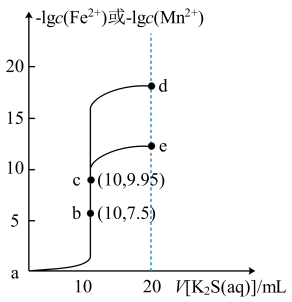

| A.a-b-e为MnCl2溶液的滴定曲线 |
| B.加入过量难溶的FeS可除去FeCl2溶液中混有的Mn2+ |
| C.e点纵坐标约为12.5 |
| D.溶液的pH:c>d>a |
您最近一年使用:0次
2024-01-13更新
|
105次组卷
|
2卷引用:湖南省长沙市麓山国际实验学校2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
6 . 绿矾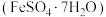 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为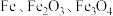 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下:

回答下列问题:
(1)“焙烧”的目的是___________ ;“碱煮水洗”可除去的物质为___________ 。
(2)提高“酸溶”反应速率的措施是___________ (任写一条)。“反应”时发生反应的离子方程式为___________ 。
(3)隔绝空气的目的是___________ ;一系列操作包括___________ 、干燥。
(4)“酸溶”后,若溶液中 为
为 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于___________  已知:
已知: 。
。
(5)纯度测定:取 绿矾,配成
绿矾,配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液滴定,三次滴定消耗标准液的平均值为
溶液滴定,三次滴定消耗标准液的平均值为 。取硫酸亚铁溶液的仪器名称为
。取硫酸亚铁溶液的仪器名称为___________ ;绿矾的纯度为___________  (用含a的代数式表示)。
(用含a的代数式表示)。
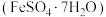 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为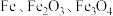 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下:
回答下列问题:
(1)“焙烧”的目的是
(2)提高“酸溶”反应速率的措施是
(3)隔绝空气的目的是
(4)“酸溶”后,若溶液中
 为
为 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于 已知:
已知: 。
。(5)纯度测定:取
 绿矾,配成
绿矾,配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液滴定,三次滴定消耗标准液的平均值为
溶液滴定,三次滴定消耗标准液的平均值为 。取硫酸亚铁溶液的仪器名称为
。取硫酸亚铁溶液的仪器名称为 (用含a的代数式表示)。
(用含a的代数式表示)。
您最近一年使用:0次
名校
解题方法
7 . 莫尔法测定生理盐水浓度的过程如下:移取 稀释后的生理盐水置于
稀释后的生理盐水置于 锥形瓶中,加入3滴
锥形瓶中,加入3滴 指示剂,用
指示剂,用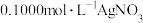 标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为
标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为 ,然后计算出
,然后计算出 的浓度。已知:
的浓度。已知: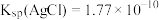 ;
;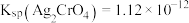 ;
; 为砖红色沉淀。下列关于本实验的说法正确的是
为砖红色沉淀。下列关于本实验的说法正确的是
 稀释后的生理盐水置于
稀释后的生理盐水置于 锥形瓶中,加入3滴
锥形瓶中,加入3滴 指示剂,用
指示剂,用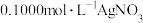 标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为
标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为 ,然后计算出
,然后计算出 的浓度。已知:
的浓度。已知: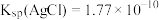 ;
;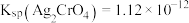 ;
; 为砖红色沉淀。下列关于本实验的说法正确的是
为砖红色沉淀。下列关于本实验的说法正确的是A.可用酸式滴定管装 标准溶液 标准溶液 |
B.该稀释后的生理盐水浓度为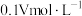 |
| C.实验中若用生理盐水润洗锥形瓶将导致测定结果偏低 |
D.在相同浓度的 和 和 混合溶液中滴入 混合溶液中滴入 溶液,先出现砖红色沉淀 溶液,先出现砖红色沉淀 |
您最近一年使用:0次
2024-01-11更新
|
163次组卷
|
2卷引用:湖南省长沙市长郡中学2024届高三上学期期末适应性考试化学试题
名校
解题方法
8 . 三氯化钌( )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从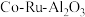 催化剂废料中分离制各
催化剂废料中分离制各 和
和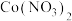 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“焙烧”后所得固体主要成分为 、
、 、
、 和
和___________ 。
(3)“还原”过程会产生 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为______________________ 。
(4)“酸溶”过程中,先加入盐酸溶解 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为___________ 。
(5)“蒸发结晶”在真空度为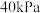 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是___________ 。
(6)若维持 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于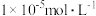 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: ,
,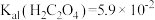 ,
, 结果保留三位小数]
结果保留三位小数]
(7)“沉钴”时,若得到的是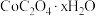 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为______________________ 。
(8)该流程中,还有一种重要成分 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:___________ 。
 )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从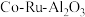 催化剂废料中分离制各
催化剂废料中分离制各 和
和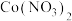 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“焙烧”后所得固体主要成分为
 、
、 、
、 和
和(3)“还原”过程会产生
 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为(4)“酸溶”过程中,先加入盐酸溶解
 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为(5)“蒸发结晶”在真空度为
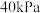 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是(6)若维持
 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于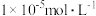 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于 ,
,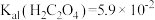 ,
, 结果保留三位小数]
结果保留三位小数](7)“沉钴”时,若得到的是
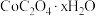 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为(8)该流程中,还有一种重要成分
 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:
您最近一年使用:0次
2024-01-09更新
|
1296次组卷
|
6卷引用:2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题
2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题湖南省株洲市2024届高三上学期教学质量统一检测化学试题湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届江西省贵溪市实验中学高三下学期5月模拟考试压轴(三)化学试卷
名校
解题方法
9 . 下列指定反应的离子方程式正确的是
A.饱和氯水中通入 至溶液颜色褪去: 至溶液颜色褪去: |
B.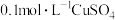 溶液中加入过量浓氨水: 溶液中加入过量浓氨水: |
C.向滴有酚酞的 溶液中滴入盐酸至红色恰好褪去: 溶液中滴入盐酸至红色恰好褪去: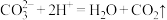 |
D. 溶液中加入足量石灰乳: 溶液中加入足量石灰乳: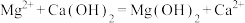 |
您最近一年使用:0次
2024-01-07更新
|
132次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期月考试卷(六)化学试题
10 . 草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
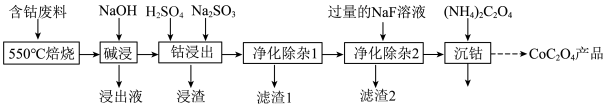
(1)“550℃焙烧”的目的是_________ 。
(2)“碱浸”过程中发生反应的化学方程式______ 。
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为________ 。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5.滤渣1的主要成分是_______ 。金属离子与H2O2反应的离子方程式为________ 。
(5)“净化除杂2”过程中,加入NaF以除去原溶液中Ca2+(浓度为1.0×10﹣3mol⋅L﹣1)和Mg2+,若控制溶液中c(F﹣)=2.0×10﹣3mol⋅L﹣1,则Ca2+的去除率准确值为________ 。[已知某温度下,Ksp(CaF2)=4.0×10﹣11]
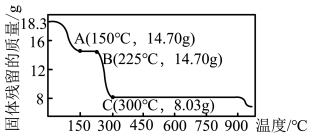
(6)如图为二水合草酸钴(CoC2O4⋅2H2O摩尔质量为183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。写出B点物质与O2在一定温度下发生反应生成C点物质的化学方程式_________ 。

(1)“550℃焙烧”的目的是
(2)“碱浸”过程中发生反应的化学方程式
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5.滤渣1的主要成分是
(5)“净化除杂2”过程中,加入NaF以除去原溶液中Ca2+(浓度为1.0×10﹣3mol⋅L﹣1)和Mg2+,若控制溶液中c(F﹣)=2.0×10﹣3mol⋅L﹣1,则Ca2+的去除率准确值为
(6)如图为二水合草酸钴(CoC2O4⋅2H2O摩尔质量为183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。写出B点物质与O2在一定温度下发生反应生成C点物质的化学方程式

您最近一年使用:0次
2024-01-07更新
|
196次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期月考试卷(六)化学试题



