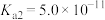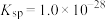名校
1 . 室温下,将Na2CO3溶液与过量CaSO4固体混合,溶液pH随时间变化如图所示。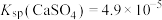 、
、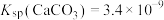
下列说法不正确 的是

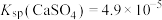 、
、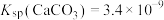
下列说法
A.室温下,反应 的 的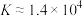 |
B.随着反应的进行,溶液pH下降的原因是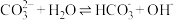 逆向移动 逆向移动 |
C.0~600s内上层清液中存在: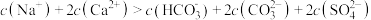 |
D.反应过程中,溶液中始终存在: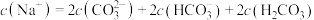 |
您最近一年使用:0次
2024-05-13更新
|
534次组卷
|
4卷引用:湖南省长沙市雅礼中学2024届高三下学期模拟卷(一)化学试题
湖南省长沙市雅礼中学2024届高三下学期模拟卷(一)化学试题浙江省宁波市2024届高三下学期二模化学试题(已下线)押题卷02(15+4题型) -2024高考化学考点必杀300题(新高考通用)(已下线)选择题11-16
名校
解题方法
2 . 下列离子方程式书写错误的是
A.向硫化钠溶液中通入足量二氧化硫: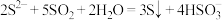 |
B.已知酸性: ,将少量 ,将少量 通入 通入 溶液中: 溶液中: |
C.用盐酸处理铜器表面的铜锈: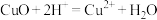 |
D.利用 与 与 制备 制备 沉淀: 沉淀: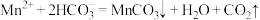 |
您最近一年使用:0次
2024-05-11更新
|
398次组卷
|
4卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题湖南省长沙市第一中学2024届高三下学期三模化学试题2024届河南省郑州外国语学校高三下学期最后一卷理科综合试题-高中化学(已下线)第02讲 离子反应、离子方程式(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
3 . 研究从含锌资源中获取 的途径具有重要意义。
的途径具有重要意义。
I.工业上酸浸提锌
氧化锌矿中含有 等。
等。 如下:
如下:
ii.浸出液中主要金属阳离子浓度如下:
(1)浸出渣的主要成分有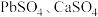 和
和 。
。 和
和 反应的离子方程式为
反应的离子方程式为_____ 。
(2)加入试剂a的目的是_______ 。
(3)电解前,含 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于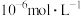 ,应调节
,应调节 的范围是
的范围是_______ (忽略①和②导致的体积变化)。
(4)工业上采用惰性电极作阳极电解 溶液可实现湿法炼锌,电解过程中总反应的离子方程式为
溶液可实现湿法炼锌,电解过程中总反应的离子方程式为_______ 。
Ⅱ.实验室中氨浸提锌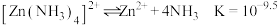 ;
;
iv.M的结构简式如图所示,R为 ,两个羟基中,酚羟基酸性较强。
,两个羟基中,酚羟基酸性较强。 和
和 中
中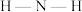 键角大小是
键角大小是_______ (填“前者大”或“后者大”)。
(6) 和
和 浸取
浸取 发生反应的离子方程式是
发生反应的离子方程式是_______ 。
(7)M能与 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。X的结构如图所示。X中形成氢键有利于
。X的结构如图所示。X中形成氢键有利于 的萃取,原因可能是
的萃取,原因可能是_______ 。 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:_______ 。
 的途径具有重要意义。
的途径具有重要意义。I.工业上酸浸提锌
氧化锌矿中含有
 等。
等。
 如下:
如下:| 难溶电解质 |  |  |  |  |
 |  |  | 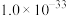 |  |
| 金属阳离子 |  |  和 和 |  |
浓度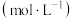 | 0.3 | 0.1 | 0.1 |
(1)浸出渣的主要成分有
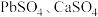 和
和 。
。 和
和 反应的离子方程式为
反应的离子方程式为(2)加入试剂a的目的是
(3)电解前,含
 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于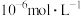 ,应调节
,应调节 的范围是
的范围是(4)工业上采用惰性电极作阳极电解
 溶液可实现湿法炼锌,电解过程中总反应的离子方程式为
溶液可实现湿法炼锌,电解过程中总反应的离子方程式为Ⅱ.实验室中氨浸提锌

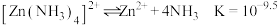 ;
;iv.M的结构简式如图所示,R为
 ,两个羟基中,酚羟基酸性较强。
,两个羟基中,酚羟基酸性较强。
 和
和 中
中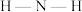 键角大小是
键角大小是(6)
 和
和 浸取
浸取 发生反应的离子方程式是
发生反应的离子方程式是(7)M能与
 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。X的结构如图所示。X中形成氢键有利于
。X的结构如图所示。X中形成氢键有利于 的萃取,原因可能是
的萃取,原因可能是
 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:
您最近一年使用:0次
2024-05-07更新
|
203次组卷
|
2卷引用:湖南省长沙市雅礼中学2024届高三下学期模拟卷(一)化学试题
名校
4 . 二元有机酸(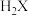 )的电离常数
)的电离常数 、
、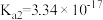 。BaX难溶于水,常温下,将BaX溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中
。BaX难溶于水,常温下,将BaX溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是 易溶于水。
易溶于水。
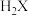 )的电离常数
)的电离常数 、
、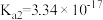 。BaX难溶于水,常温下,将BaX溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中
。BaX难溶于水,常温下,将BaX溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是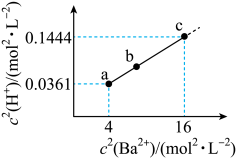
 易溶于水。
易溶于水。| A.NaHX溶液显碱性 |
B.溶度积 |
C.b点: |
D.若0.01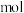 BaX溶于1L BaX溶于1L 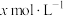 HY溶液中得到氢离子浓度与c点相等,则 HY溶液中得到氢离子浓度与c点相等,则 |
您最近一年使用:0次
5 . 25℃时,用NaOH溶液分别滴定HX、 、
、 三种溶液,
三种溶液, [M表示
[M表示 、
、 、
、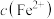 ]随pH变化关系如图所示,其中③的M代表
]随pH变化关系如图所示,其中③的M代表 。已知
。已知 ,下列有关分析不正确的是
,下列有关分析不正确的是
 、
、 三种溶液,
三种溶液, [M表示
[M表示 、
、 、
、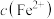 ]随pH变化关系如图所示,其中③的M代表
]随pH变化关系如图所示,其中③的M代表 。已知
。已知 ,下列有关分析不正确的是
,下列有关分析不正确的是
A.①代表滴定 溶液的变化关系 溶液的变化关系 |
B.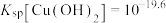 |
C.a点时,③中 与②中M的关系为 与②中M的关系为 |
D. 、 、 固体均易溶解于HX溶液 固体均易溶解于HX溶液 |
您最近一年使用:0次
名校
解题方法
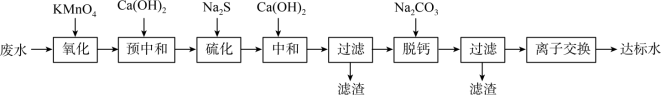
6 . 湿法炼锌的工业废水中主要阳离子有Zn2+、H+、Tl+、Tl3+,废水除铊的工艺流程如图。 能够在pH为0~14的范围内以离子态稳定存在,不易与
能够在pH为0~14的范围内以离子态稳定存在,不易与 形成沉淀。
形成沉淀。
②部分物质的 如表:
如表:
③排放标准:Tl的含量低于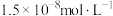 。
。
回答下列问题:
(1)Tl的原子序数为81,在元素周期表中的位置为___________ ,价电子排布式为___________ 。
(2)已知“氧化”步骤中 被还原为
被还原为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:___________ ,反应后仍存在少量的 。
。
(3)“预中和”步骤中加入 至溶液的pH约为7,可减少“硫化”步骤中
至溶液的pH约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少___________ (填化学式)污染物的生成。
(4)“硫化”步骤的主要目的是除去___________ (填离子符号)。
(5)在“中和”步骤中,若要使溶液中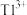 的含量低于排放标准,请根据
的含量低于排放标准,请根据 计算溶液的pH应大于
计算溶液的pH应大于___________ 。
(6)“离子交换”步骤中可用普鲁士蓝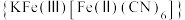 (其摩尔质量为
(其摩尔质量为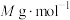 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[ 未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为
未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为___________ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 能够在pH为0~14的范围内以离子态稳定存在,不易与
能够在pH为0~14的范围内以离子态稳定存在,不易与 形成沉淀。
形成沉淀。②部分物质的
 如表:
如表:| 物质 |  | 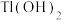 | ZnS |  |
 | 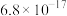 |  |  |  |
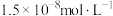 。
。回答下列问题:
(1)Tl的原子序数为81,在元素周期表中的位置为
(2)已知“氧化”步骤中
 被还原为
被还原为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式: 。
。(3)“预中和”步骤中加入
 至溶液的pH约为7,可减少“硫化”步骤中
至溶液的pH约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(4)“硫化”步骤的主要目的是除去
(5)在“中和”步骤中,若要使溶液中
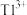 的含量低于排放标准,请根据
的含量低于排放标准,请根据 计算溶液的pH应大于
计算溶液的pH应大于(6)“离子交换”步骤中可用普鲁士蓝
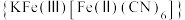 (其摩尔质量为
(其摩尔质量为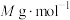 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[ 未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为
未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。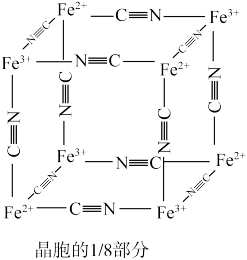
您最近一年使用:0次
名校
解题方法
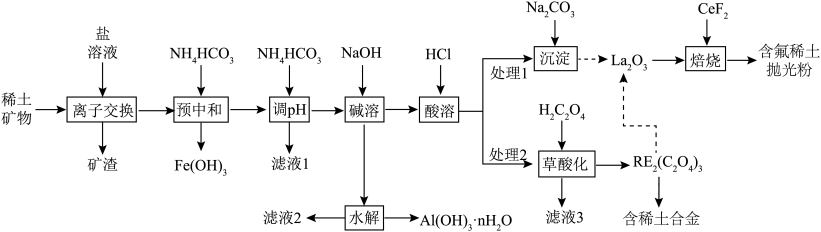
7 . 稀土(RE)包括镧(La)、铈(Ce)等元素,是重要的战略资源,从离子型稀土矿(含Fe、Al等元素)中提取稀土元素并获得高附加值产品的一种工艺流程如图所示。
回答下列问题:
(1)“预中和”工序中:
①该工序适宜的pH范围是________ 。
②胶状 的X射线衍射图谱中,
的X射线衍射图谱中,________ (填“能”或“不能”)观察到明锐的衍射峰。
(2)“调pH”工序中, 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(3)滤液3可返回“________ ”工序循环使用。
(4)“沉淀”工序产物为________ [填“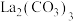 ”或“
”或“ ”],理由是
”],理由是________ {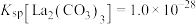 }。(当反应的
}。(当反应的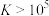 时可认为反应完全)
时可认为反应完全)
(5)含氟稀土抛光粉的主要成分为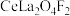 ,“焙烧”时发生反应的化学方程式为
,“焙烧”时发生反应的化学方程式为________ 。
(6)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强。下列离子对 交换能力最强的是________。
交换能力最强的是________。
离子 |
|
|
|
开始沉淀时的pH | 1.5 | 4.3 | 5.6( |
沉淀完全时的pH | 3.2 | 5.5 | /( |
(1)“预中和”工序中:
①该工序适宜的pH范围是
②胶状
 的X射线衍射图谱中,
的X射线衍射图谱中,(2)“调pH”工序中,
 发生反应的离子方程式为
发生反应的离子方程式为(3)滤液3可返回“
(4)“沉淀”工序产物为
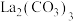 ”或“
”或“ ”],理由是
”],理由是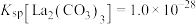 }。(当反应的
}。(当反应的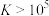 时可认为反应完全)
时可认为反应完全)(5)含氟稀土抛光粉的主要成分为
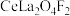 ,“焙烧”时发生反应的化学方程式为
,“焙烧”时发生反应的化学方程式为(6)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强。下列离子对
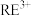 交换能力最强的是________。
交换能力最强的是________。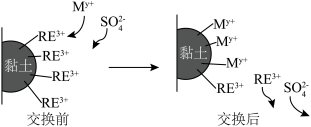
A. | B. | C. | D. |
您最近一年使用:0次
2024-04-16更新
|
277次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2023-2024学年高二下学期第一次大练习化学试题
名校
解题方法
8 . 碳酸铈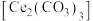 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示:
①“酸浸”后铈元素主要以 的形式存在;
的形式存在;
② 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。
(1)“焙烧”时,从焙烧室的底部通入空气的目的是____________________ 。
(2)“滤渣1”的主要成分为__________ 。
(3)“还原”时,加入硫脲( )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为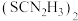 。
。
①该反应的离子方程式为____________________ 。
②硫脲属于__________ (填“极性”或“非极性”)分子,该分子中键角
__________ 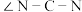 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为______________________________________________________________________ 。
(5)若“沉淀”后,溶液的pH为6,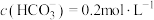 ,此时
,此时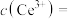
__________ 。已知常温下:
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示: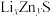 中,
中,
__________ 。
②ZnS晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为__________  (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为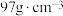 )。
)。
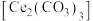 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示:
①“酸浸”后铈元素主要以
 的形式存在;
的形式存在;②
 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。(1)“焙烧”时,从焙烧室的底部通入空气的目的是
(2)“滤渣1”的主要成分为
(3)“还原”时,加入硫脲(
 )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为 。
。①该反应的离子方程式为
②硫脲属于

 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(5)若“沉淀”后,溶液的pH为6,
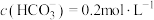 ,此时
,此时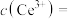
|
| |
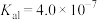 |
|
|
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示:
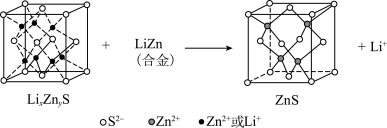
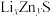 中,
中,
②ZnS晶胞中,
 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为 (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为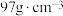 )。
)。
您最近一年使用:0次
2024-04-15更新
|
322次组卷
|
3卷引用:湖南省长沙市第一中学2023-2024学年高三下学期4月月考化学试题
名校
9 . 下列为达到实验目的所用实验操作或原理解释存在错误的是
| 实验目的 | 实验操作 | 原理解释 | |
| A | 探究 有氧化性 有氧化性 | 钠在燃烧匙中点燃,迅速伸入盛满 的集气瓶中 的集气瓶中 |  被还原成碳单质 被还原成碳单质 |
| B | 探究硫的酒精溶液属于胶体 | 用激光笔照射硫的酒精溶液 | 硫的酒精溶液中分散质粒子的直径在 之间 之间 |
| C | 除去 酸性溶液中的 酸性溶液中的 | 在加热搅拌的条件下向溶液中加入足量的 固体,过滤后,再向滤液中加入适量的稀盐酸 固体,过滤后,再向滤液中加入适量的稀盐酸 | 溶解度: |
| D | 探究温度对 水解程度的影响 水解程度的影响 | 用 计测 计测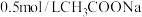 溶液的 溶液的 随温度变化 随温度变化 | 随温度升高,溶液中 水解程度增大 水解程度增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-13更新
|
205次组卷
|
10卷引用:2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题
2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)卷03 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)仿真卷06-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)四川省成都市第七中学林荫校区2023-2024学年高三下学期4月月考理科综合试卷-高中化学安徽省六安第一中学2024届高三下学期质量检测化学试卷(四)2024届四川省眉山市仁寿县四川省仁寿第一中学校(北校区)模拟预测理综试题-高中化学
10 . 已知 属于难溶于水、可溶于酸的盐。常温下,用
属于难溶于水、可溶于酸的盐。常温下,用 调节
调节 浊液的
浊液的 ,测得在不同
,测得在不同 条件下,体系中
条件下,体系中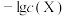 (X为
(X为 或
或 )与
)与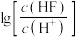 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 属于难溶于水、可溶于酸的盐。常温下,用
属于难溶于水、可溶于酸的盐。常温下,用 调节
调节 浊液的
浊液的 ,测得在不同
,测得在不同 条件下,体系中
条件下,体系中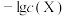 (X为
(X为 或
或 )与
)与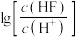 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.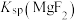 的数量级为 的数量级为 |
B. 代表 代表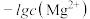 与 与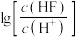 的变化曲线 的变化曲线 |
C. 、 、 两点的溶液中均存在 两点的溶液中均存在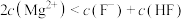 |
D. 点的溶液中存在 点的溶液中存在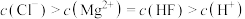 |
您最近一年使用:0次
2024-04-08更新
|
158次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2023-2024学年高三下学期第七次月考化学试题

 为6.2)
为6.2)