名校
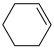
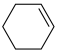
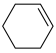
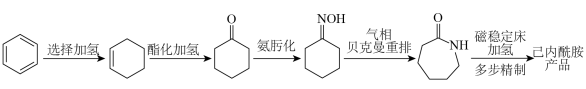
1 . 2023年12月具有完全知识产权、全球首套己内酰胺的绿色生产线正式在中国石化岳阳巴陵石化子公司投产。其生产流程如下:
(1)已知:①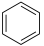
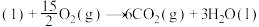
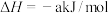
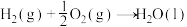

 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
___________ 。(填写计算式)
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):___________ 。
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下: 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
(4)有关该反应过程,说法不正确的是___________(填标号)。
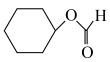
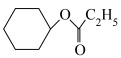
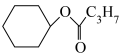
(5)已知环己烯与羧酸发生加成反应的机理如下:
8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
从表格中得出,环己烯与不同羧酸加成,其中与HCOOH反应的产率最高,最有可能的原因是___________ (从分子结构的角度解释)。而环己烯与环戊烯相比,在同样的催化剂条件下,相同温度下,环戊烯加成的产率更高的原因可能是___________ 。
(6)已知在标准状况下,AgCl的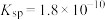 ,
, 的
的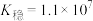 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为___________ mol/L(已知: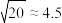 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
(1)已知:①

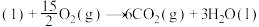
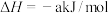
②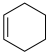
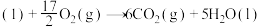
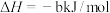
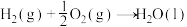

则:
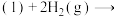

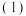

①
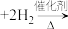
 、
、
②
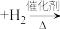
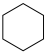 。
。
 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下:
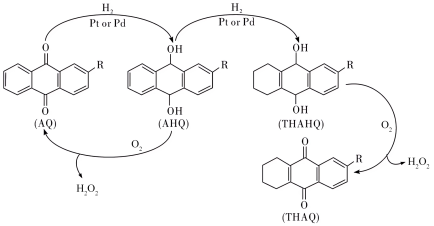
 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。(4)有关该反应过程,说法不正确的是___________(填标号)。
A.从AQ到AHQ的反应中,发生变化的碳原子的杂化类型由 到 到 |
B.由THAHQ制备 的反应方程式为 的反应方程式为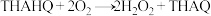 |
C.在AHQ的氧化过程中,生成的 和有机物AQ、AHQ的分离方法为蒸馏 和有机物AQ、AHQ的分离方法为蒸馏 |
| D.我国采用的浆态蒽醌氢化法,使用更高效的Pd基细颗粒催化剂,有利于提高催化的效率 |
(5)已知环己烯与羧酸发生加成反应的机理如下:

8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
| 序号 | 羧酸 | 环烯烃 | 温度/℃ | 产物 | 产率/% |
| 1 | HCOOH |
| 95 |
| 90 |
| 2 |  |
| 110 |
| 82 |
| 3 |  |
| 120 |
| 62 |
| 4 | 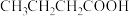 |
| 130 |
| 51 |
| 5 | HCOOH |
| 95 |
| 93 |
(6)已知在标准状况下,AgCl的
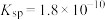 ,
, 的
的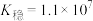 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为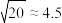 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
您最近一年使用:0次
名校
2 . 湖南稀土资源丰富,其中红土钪矿富含钪元素。钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从红土钪矿(含钪、钛、铁、锰等元素)中提取氧化钪( )的一种流程如下:
)的一种流程如下: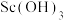 为两性氢氧化物,可与强碱反应生成
为两性氢氧化物,可与强碱反应生成 。
。
②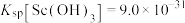 。
。
③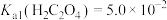 ,
,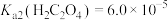 。
。
(1)为提高酸浸速率,可通过研磨、___________ 等措施(举2例)。请从原子结构的角度解释加入双氧水易将酸浸液中某种金属阳离子氧化的原因:___________ 。该步骤中选用足量的 ,理由是
,理由是___________ 。
(2)25℃时加入NaOH溶液调节 以除去
以除去 ,沉锰过程中钪也会经历沉淀的过程,
,沉锰过程中钪也会经历沉淀的过程, 完全沉淀的
完全沉淀的
___________ (已知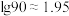 )。
)。
(3)向含 的溶液中加入草酸后可以将其沉淀,
的溶液中加入草酸后可以将其沉淀, 的草酸溶液中
的草酸溶液中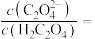
___________ 。
(4)草酸钪在空气中灼烧的化学方程式为___________ 。
(5)Y、Sc(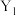 /NC,
/NC,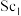 /NC)单原子催化剂可用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。使用
/NC)单原子催化剂可用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。使用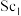 /NC单原子催化剂的反应历程中,决速步的方程式为
/NC单原子催化剂的反应历程中,决速步的方程式为___________ 。
 )的一种流程如下:
)的一种流程如下:
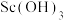 为两性氢氧化物,可与强碱反应生成
为两性氢氧化物,可与强碱反应生成 。
。②
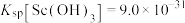 。
。③
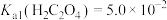 ,
,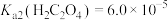 。
。(1)为提高酸浸速率,可通过研磨、
 ,理由是
,理由是(2)25℃时加入NaOH溶液调节
 以除去
以除去 ,沉锰过程中钪也会经历沉淀的过程,
,沉锰过程中钪也会经历沉淀的过程, 完全沉淀的
完全沉淀的
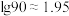 )。
)。(3)向含
 的溶液中加入草酸后可以将其沉淀,
的溶液中加入草酸后可以将其沉淀, 的草酸溶液中
的草酸溶液中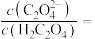
(4)草酸钪在空气中灼烧的化学方程式为
(5)Y、Sc(
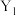 /NC,
/NC,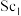 /NC)单原子催化剂可用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。使用
/NC)单原子催化剂可用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。使用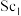 /NC单原子催化剂的反应历程中,决速步的方程式为
/NC单原子催化剂的反应历程中,决速步的方程式为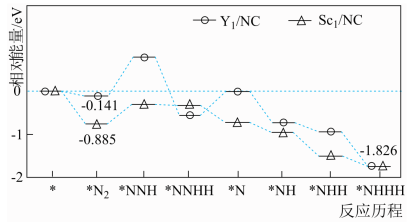
您最近一年使用:0次
名校
解题方法
3 . 下列实验装置或操作能达到实验目的的是
|
|
A.蒸干 溶液制备 溶液制备 | B.验证沉淀转化 |
|
|
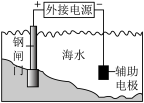
| C.检验乙炔 | D.钢闸门电化学防腐 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、 等)回收Se。
等)回收Se。 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。
②Se难溶于水,沸点684.9℃,易与 反应。
反应。
③反应的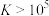 ,代表可完全转化。室温下
,代表可完全转化。室温下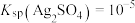 ,
,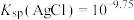 。
。
下列说法正确的是
 等)回收Se。
等)回收Se。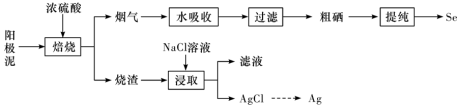
 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。②Se难溶于水,沸点684.9℃,易与
 反应。
反应。③反应的
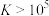 ,代表可完全转化。室温下
,代表可完全转化。室温下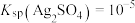 ,
,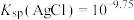 。
。下列说法正确的是
A.理论上,发生反应的 和 和 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.在真空中可进行粗硒提纯,可降低体系中硒的沸点 |
C.“滤液”为 溶液 溶液 |
D.加入NaCl溶液浸取时发生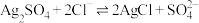 ,该反应过程不可完全转化 ,该反应过程不可完全转化 |
您最近一年使用:0次
名校
5 . 由下列实验操作及现象能得出的且正确的结论是
| 选项 | 实验操作及现象 | 结论 |
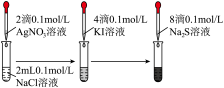
| A | 向20mL0.1mol·L-1AgNO3溶液中滴加10mL0.1mol·L-1NaCl溶液,出现白色沉淀,继续滴加10 mL 0. 1 mol·L-1NaBr溶液,白色沉淀变成浅黄色沉淀 | Ksp(AgBr)< Ksp(AgCl) |
| B | 在试管中加入2mL10%NaOH溶液,再加入5滴5%CuSO4溶液,振荡后加入0.5mL物质B的水溶液,加热,出现砖红色沉淀 | 物质B有还原性 |
| C | 向某溶液中加入足量的NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,试纸变蓝 | 该溶液中一定含有铵盐 |
| D | 将20 mL 0.2 mol·L-1FeCl3溶液与30 mL 0. 1 mol·L-1KI溶液混合,滴入几滴KSCN溶液,溶液变红 |  为可逆反应 为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 碱式硫酸铁[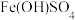 ,黄褐色固体]是一种新型高效絮凝剂和污泥处理剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
,黄褐色固体]是一种新型高效絮凝剂和污泥处理剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
下列说法不正确的是
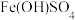 ,黄褐色固体]是一种新型高效絮凝剂和污泥处理剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
,黄褐色固体]是一种新型高效絮凝剂和污泥处理剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
| 金属阳离子 |  |  |  |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
A.“搅拌”时加入少量 将溶液的pH调节在 将溶液的pH调节在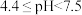 |
B.生成滤渣的方程式为 |
| C.该工艺流程不符合绿色化学的理念 |
D.“反应Ⅱ”中若用 代替 代替 ,当11.2L(标准状况) ,当11.2L(标准状况) 参与反应,则相当于节约了2mol 参与反应,则相当于节约了2mol |
您最近一年使用:0次
名校
解题方法
7 . 化学与生活联系紧密。下列说法错误的是
| A.碳酸钠和碳酸氢钠均可作食用碱或工业用碱 |
| B.抗坏血酸(维生素C)能被氧化为脱氢抗血酸而发挥抗氧化作用 |
| C.水果中因含有低级酯类物质而具有特殊香味 |
| D.牙齿釉质层的主要成分是难溶的羟基磷灰石,属于有机物 |
您最近一年使用:0次
名校
解题方法
8 . 锗酸铋是一种闪烁晶体材料,可用于空间物理等领域。
(1)锗是半导体材料,基态Ge原子核外电子排布式为_________________ 。
(2)锗酸铋可用锗和铋的氧化物形式表示,其中锗显最高价,铋的价态与其氯化物中的价态相同,在其氯化物中铋原子最外层满足8电子结构,氧原子平分在两种氧化物中,则锗酸铋的化学式用氧化物的形式可写成_________________ 。
(3)可用铋矿(主要成分为硫化铋、氧化铋及少量SiO2、铅、砷等杂质)按图流程冶炼得到粗铋。
①浸出时采用40℃的温度,可能的原因为_______________ ,浸出时加入盐酸调节pH可提高Fe3+的利用效率,若加入的Fe3+为l6.8mg·L-1,则为了使Fe3+的利用效率达到最佳,酸化浸出时应将pH调至小于_______________ (已知lg2=0.3,lg5=0.7)。
②浸出渣中除SiO2外,还有少量淡黄色固体,则浸出时产生淡黄色固体反应的离子方程式为_______________ 。
(4)FeO立方晶胞的结构如图所示,设晶胞参数为apm。则与O2-紧邻的Fe2+构成的空间结构为_______________ ,两个O2-之间最近的距离为_______________ pm。
(1)锗是半导体材料,基态Ge原子核外电子排布式为
(2)锗酸铋可用锗和铋的氧化物形式表示,其中锗显最高价,铋的价态与其氯化物中的价态相同,在其氯化物中铋原子最外层满足8电子结构,氧原子平分在两种氧化物中,则锗酸铋的化学式用氧化物的形式可写成
(3)可用铋矿(主要成分为硫化铋、氧化铋及少量SiO2、铅、砷等杂质)按图流程冶炼得到粗铋。

| Ksp[Fe(OH)3] | Ksp(PbCl2) | Ksp(PbC2O4) | Ka1(H2C2O4) | Ka2(H2C2O4) |
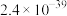 | 25℃时: 19℃时:  | 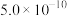 |  | 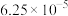 |
②浸出渣中除SiO2外,还有少量淡黄色固体,则浸出时产生淡黄色固体反应的离子方程式为
(4)FeO立方晶胞的结构如图所示,设晶胞参数为apm。则与O2-紧邻的Fe2+构成的空间结构为

您最近一年使用:0次
名校
解题方法
9 . 新能源汽车工业飞速发展依赖于锂离子电池的新型电极材料的研究取得的重大成果。 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。
(1)“浸锰”时, 生成
生成 的离子方程式为
的离子方程式为___________ 。
(2)步骤Ⅱ中, 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是___________ 。 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为___________ {已知该条件下,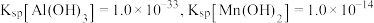 }。
}。
(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为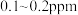 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。
①以 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧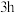 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到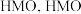 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为___________ ;
②用酸处理 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是___________ 。这一副反应对再生后的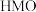 的锂富集性能的影响是
的锂富集性能的影响是___________ 。
(5)利用高纯 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
步骤1:向 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成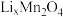 ;
;
步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使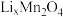 中的
中的 脱出进入腔室2。
脱出进入腔室2。 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入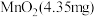 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在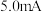 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
___________ (已知 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。
②电源2工作时, 电极上发生的电极反应为
电极上发生的电极反应为___________ 。
 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。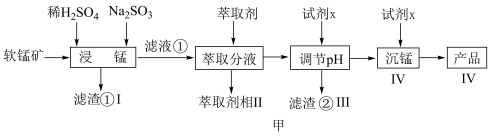
(1)“浸锰”时,
 生成
生成 的离子方程式为
的离子方程式为(2)步骤Ⅱ中,
 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是
 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为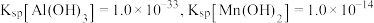 }。
}。(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为
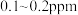 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。①以
 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧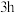 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到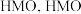 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为②用酸处理
 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是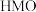 的锂富集性能的影响是
的锂富集性能的影响是(5)利用高纯
 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:步骤1:向
 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成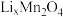 ;
;步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使
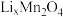 中的
中的 脱出进入腔室2。
脱出进入腔室2。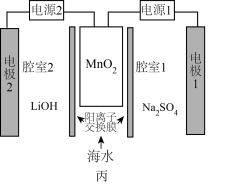
 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入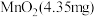 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在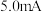 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。②电源2工作时,
 电极上发生的电极反应为
电极上发生的电极反应为
您最近一年使用:0次
2024-05-14更新
|
204次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
10 . 氮化镓(GaN)是具有优异光电性能的第三代半导体材料。利用炼锌矿渣[主要含铁酸锌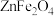 、铁酸镓
、铁酸镓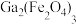 、
、 ]制备GaN并回收金属元素的一种工艺流程如下图:
]制备GaN并回收金属元素的一种工艺流程如下图: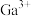 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
(1)下列镓原子或者离子电离一个电子所需能量最高的是___________(填标号)。
(2)“酸浸”所得浸出液中 、
、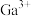 浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取
浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取 同时确保不混入
同时确保不混入 ,“调pH”时须:
,“调pH”时须: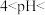
___________ (假设调pH时溶液体积不变)。已知常温下,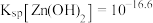 ,
,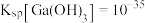 。(通常认为残留在溶液中的离子浓度小于
。(通常认为残留在溶液中的离子浓度小于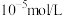 即为沉淀完全)。
即为沉淀完全)。
(3)“反萃取”时,所用盐酸的浓度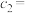
___________ 。
(4)由Ga制备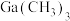 的部分工艺如下图:
的部分工艺如下图: (乙醚)和
(乙醚)和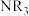 (三正辛胺)均为配体;
(三正辛胺)均为配体;
(ii)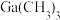 沸点:55.7℃,
沸点:55.7℃, 沸点:34.6℃,
沸点:34.6℃,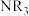 沸点:365.8℃。
沸点:365.8℃。
①比较分子中的C—Ga—C键角大小: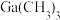
___________ 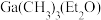 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
②直接分解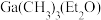 不能制备超纯
不能制备超纯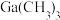 ,采用“配体交换”工艺制备超纯
,采用“配体交换”工艺制备超纯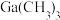 的理由是
的理由是___________ 。
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的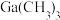 为原料,使其与
为原料,使其与 发生系列反应得到GaN和另一种产物,该过程的化学方程式为
发生系列反应得到GaN和另一种产物,该过程的化学方程式为___________ 。
(6)GaN晶体的一种立方晶胞如图所示。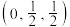 ,则B原子坐标为
,则B原子坐标为___________ 。
②若 为阿伏加德罗常数的值,GaN晶胞中Ga原子与Ga原子之间最短的核间距离是a pm,则该GaN晶体的密度为
为阿伏加德罗常数的值,GaN晶胞中Ga原子与Ga原子之间最短的核间距离是a pm,则该GaN晶体的密度为___________  (只列算式,不用计算结果)。
(只列算式,不用计算结果)。
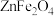 、铁酸镓
、铁酸镓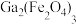 、
、 ]制备GaN并回收金属元素的一种工艺流程如下图:
]制备GaN并回收金属元素的一种工艺流程如下图:
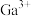 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。| 盐酸浓度(mol/L) | 反萃取率(%) | |
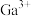 |  | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)下列镓原子或者离子电离一个电子所需能量最高的是___________(填标号)。
A. | B. | C.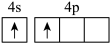 | D.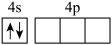 |
(2)“酸浸”所得浸出液中
 、
、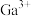 浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取
浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取 同时确保不混入
同时确保不混入 ,“调pH”时须:
,“调pH”时须: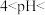
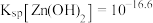 ,
,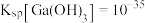 。(通常认为残留在溶液中的离子浓度小于
。(通常认为残留在溶液中的离子浓度小于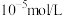 即为沉淀完全)。
即为沉淀完全)。(3)“反萃取”时,所用盐酸的浓度
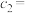
(4)由Ga制备
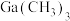 的部分工艺如下图:
的部分工艺如下图: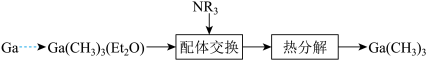
 (乙醚)和
(乙醚)和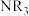 (三正辛胺)均为配体;
(三正辛胺)均为配体;(ii)
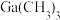 沸点:55.7℃,
沸点:55.7℃, 沸点:34.6℃,
沸点:34.6℃,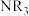 沸点:365.8℃。
沸点:365.8℃。①比较分子中的C—Ga—C键角大小:
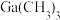
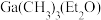 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。②直接分解
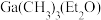 不能制备超纯
不能制备超纯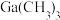 ,采用“配体交换”工艺制备超纯
,采用“配体交换”工艺制备超纯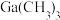 的理由是
的理由是(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的
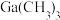 为原料,使其与
为原料,使其与 发生系列反应得到GaN和另一种产物,该过程的化学方程式为
发生系列反应得到GaN和另一种产物,该过程的化学方程式为(6)GaN晶体的一种立方晶胞如图所示。
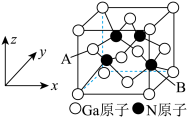
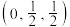 ,则B原子坐标为
,则B原子坐标为②若
 为阿伏加德罗常数的值,GaN晶胞中Ga原子与Ga原子之间最短的核间距离是a pm,则该GaN晶体的密度为
为阿伏加德罗常数的值,GaN晶胞中Ga原子与Ga原子之间最短的核间距离是a pm,则该GaN晶体的密度为 (只列算式,不用计算结果)。
(只列算式,不用计算结果)。
您最近一年使用:0次