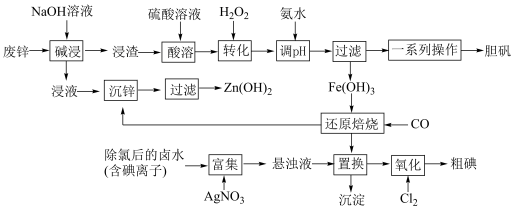
1 . 某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: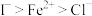
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为____________________ 。
(2)“转化”中,加入足量H2O2的目的是____________________ 。
(3)“调pH”时需控制该溶液的pH范围为______ 之间。“调pH”之后,需要加热煮沸10 min,冷却后再“过滤”。煮沸10 min的作用是____________________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为____________________ 。
(5)“氧化”过程中若反应物用量比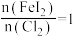 时,氧化产物为
时,氧化产物为______ (填化学式)
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
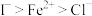
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量H2O2的目的是
(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“氧化”过程中若反应物用量比
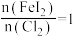 时,氧化产物为
时,氧化产物为
您最近一年使用:0次
2 . 磷酸亚铁锂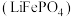 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图.
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图.

常温下各种硫化物溶度积常数如下:
回答下列问题:
(1)为提高硫酸亚铁浸取速率,可以采取的措施是___________ (答一点即可)。
(2)基态亚铁离子的电子排布式为__________________________ 。
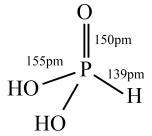
(3)磷元素可以形成多种含氧酸,亚磷酸 结构如图所示,则亚磷酸属于
结构如图所示,则亚磷酸属于___________ 元酸。
(4)在滤液2中加入磷酸需控制 ,其目的是①磷酸根过量,可以减少铁的其他形式的沉淀,提高
,其目的是①磷酸根过量,可以减少铁的其他形式的沉淀,提高 的纯度;②
的纯度;②______________________ 。
(5)聚丙烯的作用是___________________________________ 。
(6)已知当溶液中 时视为沉淀完全,又知
时视为沉淀完全,又知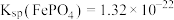 ,
, ,则要使滤液2中铁离子沉淀完全且不生成
,则要使滤液2中铁离子沉淀完全且不生成 沉淀,应控制
沉淀,应控制
___________ 。[已知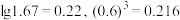 ]
]
(7)科研人员新研发了一种 可充电电池,工作原理如图,电池总反应为
可充电电池,工作原理如图,电池总反应为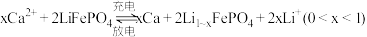
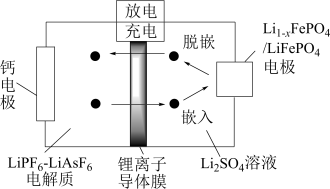
①充电时,钙电极与电源___________ 相连。
②放电时的正极反应式为___________________________ 。
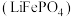 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图.
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图.
常温下各种硫化物溶度积常数如下:
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)为提高硫酸亚铁浸取速率,可以采取的措施是
(2)基态亚铁离子的电子排布式为
(3)磷元素可以形成多种含氧酸,亚磷酸
 结构如图所示,则亚磷酸属于
结构如图所示,则亚磷酸属于
(4)在滤液2中加入磷酸需控制
 ,其目的是①磷酸根过量,可以减少铁的其他形式的沉淀,提高
,其目的是①磷酸根过量,可以减少铁的其他形式的沉淀,提高 的纯度;②
的纯度;②(5)聚丙烯的作用是
(6)已知当溶液中
 时视为沉淀完全,又知
时视为沉淀完全,又知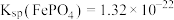 ,
, ,则要使滤液2中铁离子沉淀完全且不生成
,则要使滤液2中铁离子沉淀完全且不生成 沉淀,应控制
沉淀,应控制
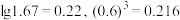 ]
](7)科研人员新研发了一种
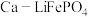 可充电电池,工作原理如图,电池总反应为
可充电电池,工作原理如图,电池总反应为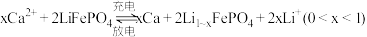

①充电时,钙电极与电源
②放电时的正极反应式为
您最近一年使用:0次
解题方法
3 . 根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有等体积、等浓度的 溶液的两支试管中分别加入 溶液的两支试管中分别加入 等浓度 等浓度 溶液和 溶液和 溶液 溶液 | 加 溶液的试管中产生气泡速率更快 溶液的试管中产生气泡速率更快 |  比 比 的催化效果好 的催化效果好 |
| B | 向盛有 溶液的试管中滴加 溶液的试管中滴加 溶液,再向其中滴加 溶液,再向其中滴加 滴 滴 溶液. 溶液. | 先有白色沉淀生成,后又产生黄色沉淀 |  |
| C | 向苯酚浊液中滴加少量 溶液 溶液 | 浊液变澄清 | 酸性:苯酚> |
| D | 向某溶液中滴加 溶液并将湿润的红色石蕊试纸置于试管口 溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色无明显变化 | 原溶液中无 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 灵感是在劳动时候产生的。下列劳动项目涉及反应的离子方程式书写正确的是
A.用铝和氢氧化钠作管道疏通剂: |
B.用醋酸洗涤铜锣上的铜绿: |
C.用石膏改良盐碱地: |
D.用热的纯碱溶液除去盘碟油污: |
您最近一年使用:0次
名校
5 . 碳酸锶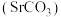 主要用于制造磁性材料、电子元件等。利用锶渣(主要成分
主要用于制造磁性材料、电子元件等。利用锶渣(主要成分 ,含少量
,含少量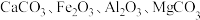 杂质),工业上制备超细碳酸锶的工艺如图1所示:
杂质),工业上制备超细碳酸锶的工艺如图1所示:
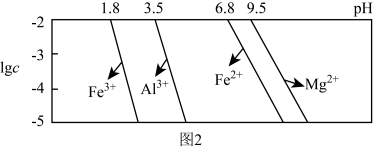
已知:①室温下,溶液中金属离子物质的量浓度 与溶液pH的关系如图2所示:
与溶液pH的关系如图2所示:
② 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:
回答下列问题:
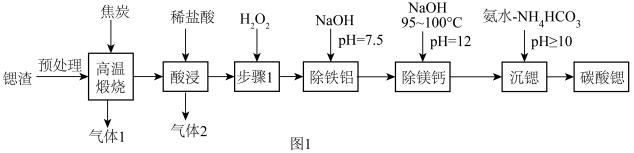
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为____________ 。
(2)“步骤1”的目的是____________ 。
(3)“除铁铝”后溶液温度降至室温,溶液中 为
为______  。
。
(4)“除镁钙”过程温度控制在95~100℃的目的是_____________________________________________ 。
(5)“沉锶”的离子反应方程式为_________________________ 。
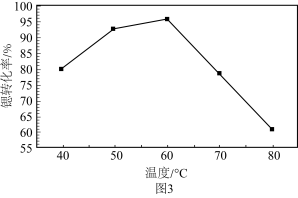
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为_____________________________________
(7)如图为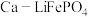 可充放电电池的工作原理示意图,锂离子导体膜只允许
可充放电电池的工作原理示意图,锂离子导体膜只允许 通过,充电时,钙电极为
通过,充电时,钙电极为______ (“阳极”或“阴极”),放电时,正极上发生 的嵌入的电极反应是
的嵌入的电极反应是______ 。
 主要用于制造磁性材料、电子元件等。利用锶渣(主要成分
主要用于制造磁性材料、电子元件等。利用锶渣(主要成分 ,含少量
,含少量 杂质),工业上制备超细碳酸锶的工艺如图1所示:
杂质),工业上制备超细碳酸锶的工艺如图1所示:
已知:①室温下,溶液中金属离子物质的量浓度
 与溶液pH的关系如图2所示:
与溶液pH的关系如图2所示:
②
 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | 0.07 |
 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 | 91.20 |
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为
(2)“步骤1”的目的是
(3)“除铁铝”后溶液温度降至室温,溶液中
 为
为 。
。(4)“除镁钙”过程温度控制在95~100℃的目的是
(5)“沉锶”的离子反应方程式为
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为

(7)如图为
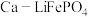 可充放电电池的工作原理示意图,锂离子导体膜只允许
可充放电电池的工作原理示意图,锂离子导体膜只允许 通过,充电时,钙电极为
通过,充电时,钙电极为 的嵌入的电极反应是
的嵌入的电极反应是
您最近一年使用:0次
名校
解题方法
6 . 根据下列实验操作和现象能得出相应实验结论的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 往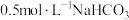 溶液中加入盐酸,将产生的气体通入 溶液中加入盐酸,将产生的气体通入 溶液中, 溶液中, 溶液中有沉淀生成 溶液中有沉淀生成 | 非金属性: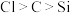 |
| B | 向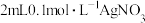 溶液中先滴加4滴 溶液中先滴加4滴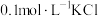 溶液,再滴加4滴 溶液,再滴加4滴 溶液,先产生白色沉淀,再产生黄色沉淀 溶液,先产生白色沉淀,再产生黄色沉淀 |  |
| C | 以 为电极,以酸化的 为电极,以酸化的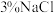 溶液作电解质溶液,用导线连接形成闭合回路。一段时间后,取 溶液作电解质溶液,用导线连接形成闭合回路。一段时间后,取 电极区域少量溶液于试管中,滴入2滴 电极区域少量溶液于试管中,滴入2滴 溶液,未出现蓝色沉淀 溶液,未出现蓝色沉淀 | 牺牲阳极法保护金属 |
| D | 用 试纸分别测定饱和的 试纸分别测定饱和的 溶液和 溶液和 溶液, 溶液, 依次为9和8 依次为9和8 |  电离出 电离出 的能力比 的能力比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 工业生产中利用方铅矿(主要成分为 ,含有
,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如图:
晶体的工艺流程如图: ;
; ,
,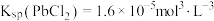 。
。
下列说法错误的是
 ,含有
,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如图:
晶体的工艺流程如图: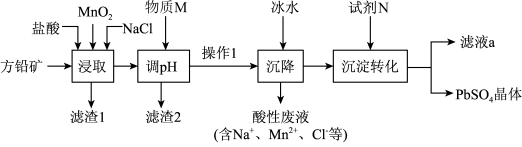
 ;
; ,
,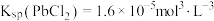 。
。下列说法错误的是
A.“浸取”时发生反应: |
B.物质M可以为 ,试剂N可以为 ,试剂N可以为 |
C.由该工艺可知, 反应放热 反应放热 |
D.“沉淀转化”过程达平衡时,溶液中 |
您最近一年使用:0次
2024-03-01更新
|
849次组卷
|
3卷引用:湖南省长沙市雅礼中学2024届高三下学期模拟考卷(二)化学试题
名校
8 .  作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
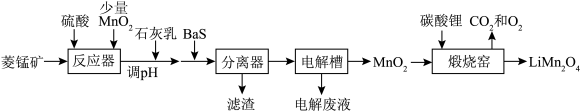
已知常温下部分物质的 如表。
如表。
回答下列问题:
(1)基态Mn原子的价电子轨道表示式为______ 。
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是______ ;若测得溶液中 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于______ 。(已知:离子浓度小于等于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)
(3)加入少量BaS溶液除去 ,生成的沉淀有
,生成的沉淀有______ (填化学式)。
(4)具有强氧化性的过一硫酸( )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ (已知: 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。
(5)煅烧窑中,生成 反应的化学方程式是
反应的化学方程式是______ 。
(6) 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。
由此可以确定,在上述温度范围内,锰元素的平均价态的变化情况是______ 。
 作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的
 如表。
如表。物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)基态Mn原子的价电子轨道表示式为
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是
 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)(3)加入少量BaS溶液除去
 ,生成的沉淀有
,生成的沉淀有(4)具有强氧化性的过一硫酸(
 )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。(5)煅烧窑中,生成
 反应的化学方程式是
反应的化学方程式是(6)
 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。T/℃ |
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 44.40 | 49.38 |
您最近一年使用:0次
2024-02-25更新
|
835次组卷
|
3卷引用:湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题
湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
9 .  在水溶液中主要以
在水溶液中主要以 、
、 的形式存在。方解石(主要成分
的形式存在。方解石(主要成分 )在天然水体中会逐渐溶解并释放
)在天然水体中会逐渐溶解并释放 ,与水体中的
,与水体中的 形成
形成 难溶物。体系中
难溶物。体系中 与
与 关系如下图所示,
关系如下图所示, 为
为 、
、 、
、 、
、 的浓度,单位为
的浓度,单位为 。已知天然水体表面
。已知天然水体表面 的分压保持恒定,
的分压保持恒定, 的电离方程式可写成
的电离方程式可写成 。下列说法错误的是
。下列说法错误的是
 在水溶液中主要以
在水溶液中主要以 、
、 的形式存在。方解石(主要成分
的形式存在。方解石(主要成分 )在天然水体中会逐渐溶解并释放
)在天然水体中会逐渐溶解并释放 ,与水体中的
,与水体中的 形成
形成 难溶物。体系中
难溶物。体系中 与
与 关系如下图所示,
关系如下图所示, 为
为 、
、 、
、 、
、 的浓度,单位为
的浓度,单位为 。已知天然水体表面
。已知天然水体表面 的分压保持恒定,
的分压保持恒定, 的电离方程式可写成
的电离方程式可写成 。下列说法错误的是
。下列说法错误的是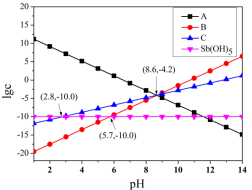
A.直线 代表的粒子为 代表的粒子为 |
B. 难溶物的 难溶物的 的数量级为 的数量级为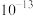 |
C. 的电离平衡常数的数值为 的电离平衡常数的数值为 |
D.溶液中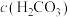 随着 随着 的增大而减小 的增大而减小 |
您最近一年使用:0次
2024-02-23更新
|
118次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2023-2024学年高二下学期第一次大练习化学试题
名校
10 . 常温下,向 和
和 的混合液中加入
的混合液中加入 固体(忽略溶液体积变化),
固体(忽略溶液体积变化), 与
与 的部分关系如图所示。已知:
的部分关系如图所示。已知: 代表
代表 或
或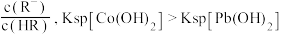 。下列叙述错误的是
。下列叙述错误的是
 和
和 的混合液中加入
的混合液中加入 固体(忽略溶液体积变化),
固体(忽略溶液体积变化), 与
与 的部分关系如图所示。已知:
的部分关系如图所示。已知: 代表
代表 或
或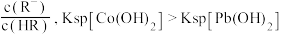 。下列叙述错误的是
。下列叙述错误的是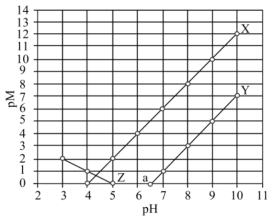
A. 代表 代表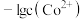 与 与 的关系 的关系 |
B.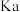 为弱酸 为弱酸 的电离常数,则常温下 的电离常数,则常温下 |
C.常温下, 和 和 共存时: 共存时: |
D.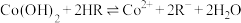 的平衡常数 的平衡常数 |
您最近一年使用:0次
2024-02-21更新
|
411次组卷
|
3卷引用:湖南省长沙市雅礼中学2023-2024学年高三下学期月考(七)化学试题










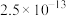
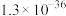
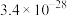







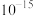

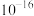
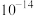
 /%
/% /%
/% /%
/%

