解题方法
1 . 已知常温下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水电离出的c水(OH-)随加入NaOH溶液的体积V的变化如图所示,下列分析正确的是
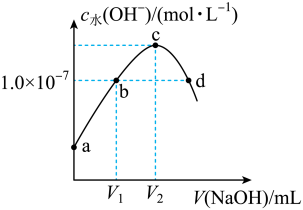

| A.V1<10,V2=20 |
| B.a点溶液的pH=3 |
| C.c点溶液c水(H+)≈1.0×10-4mol·L-1 |
| D.b、d点溶液均呈中性 |
您最近一年使用:0次
名校
解题方法
2 . 下列说法正确的是
| A.常温下,pH=2的HCl溶液中水电离的H+浓度为0.01 mol/L |
| B.0.1 mol/L 醋酸溶液中c(H+) + c(CH3COO-) + c(CH3COOH)= 0.1 mol/L |
| C.已知0.1 mol/L KHC2O4溶液呈酸性,则该溶液中存在如下关系:c(K+) >c(HC2O4-)> c(H2C2O4) >c(C2O42-) |
| D.在Na2CO3溶液中存在如下守恒关系:c(H+)-c(HCO3-)-2c(H2CO3) = c(OH-) |
您最近一年使用:0次
3 . 常温下,向20mL0.1mol•L-1NH4HSO4溶液中逐滴加入0.1mol•L-1的NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是( )
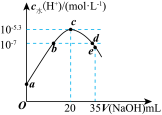

| A.c点之前,主要的反应为NH4++OH-═NH3•H2O |
| B.b点和d点对应溶液的pH均为7 |
| C.常温下,Kb(NH3•H2O)=5×10-5.4mol•L-1 |
| D.d点溶液中,c(Na+)+c(NH4+)=c(SO42-) |
您最近一年使用:0次
2020·山东·模拟预测
解题方法
4 . 用AG表示溶液的酸度,其表达式为AG=lg[ ],298K时,向10 mL 0.l mol•L﹣1HX溶液中滴加0.1 mol•L﹣1 NaOH溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是( )
],298K时,向10 mL 0.l mol•L﹣1HX溶液中滴加0.1 mol•L﹣1 NaOH溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是( )
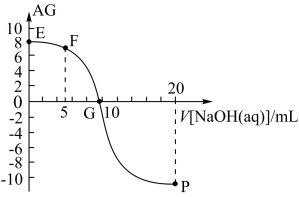
 ],298K时,向10 mL 0.l mol•L﹣1HX溶液中滴加0.1 mol•L﹣1 NaOH溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是( )
],298K时,向10 mL 0.l mol•L﹣1HX溶液中滴加0.1 mol•L﹣1 NaOH溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是( )
| A.溶液pH和AG的关系式为AG=14﹣2pH |
| B.对G点溶液加水稀释,溶液pH增大 |
| C.溶液中水电离的C(OH﹣):F点<P点 |
| D.298K时HX的电离常数Ka≈1.0×10﹣5 |
您最近一年使用:0次
5 . T℃时,在20.00mL0.10mol·L-1的一元酸HR溶液中滴入0.10mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。
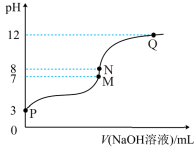
下列说法不正确的是( )

下列说法不正确的是( )
| A..T℃时,HR电离常数Ka≈1.0×10-5 |
| B.M点对应的NaOH溶液体积为20.00mL |
| C.N点与Q点所示溶液中水的电离程度:N>Q |
| D.M点所示溶液中c(Na+)=c(R-) |
您最近一年使用:0次
2020-03-26更新
|
670次组卷
|
6卷引用:广东省兴宁一中2020届高三年级3月质量检测考试(全国I卷)理综化学试题
6 . 25℃时,体积均为100mL、浓度均为的两种一元碱MOH和ROH的溶液中,分别通入HCl气体, 随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
 随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )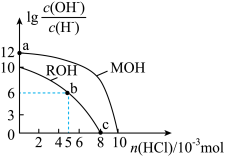
| A.MOH是强碱,ROH是弱碱 |
| B.a点由水电离产生的c(H+)和c(OH-)的乘积为1×10-26 |
| C.b点溶液中:c(Cl-)>c(R+)>c(H+)>c(OH-) |
| D.c点溶液的pH=7,且所含溶质为ROH和RCl |
您最近一年使用:0次
2020-05-19更新
|
185次组卷
|
5卷引用:【校级联考】湖北省七市州教科研协作体2019届高三下学期三月联合考试理科综合化学试题
【校级联考】湖北省七市州教科研协作体2019届高三下学期三月联合考试理科综合化学试题天津市红桥区2020届高三下学期居家学习线上检测第一次模拟化学试题第26讲 水的电离和溶液的pH (精讲)-2021年高考化学一轮复习讲练测(已下线)第22讲 水的电离与溶液的pH(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)
7 . 已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__ 。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=__ 。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__ ,溶液中离子浓度大小关系为__ 。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=__ 。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__ 。(已知lg2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
2019-12-19更新
|
100次组卷
|
2卷引用:江西省抚州市南城县第二中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
8 . 在某温度下的水溶液中,c(H+)=10xmol·L﹣1,c(OH﹣)=10ymol·L﹣1。x与y的关系如图所示:(已知lg2=0.3)___________________ 。
(2)0.01mol·L-1 H2SO4溶液的pH=________ 。
(3)pH=7的溶液呈________ (填“酸性”、“中性”或“碱性”)。
(4) 若测得某溶液中,水电离出来的c(OH-)=1.0×10-12 mol·L-1,且溶液为强碱溶液,则该溶液的pH=______ 。中和100 mL该溶液需消耗HCl的物质的量为______ mol。
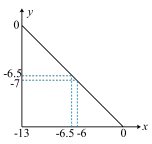
(2)0.01mol·L-1 H2SO4溶液的pH=
(3)pH=7的溶液呈
(4) 若测得某溶液中,水电离出来的c(OH-)=1.0×10-12 mol·L-1,且溶液为强碱溶液,则该溶液的pH=
您最近一年使用:0次
19-20高三上·福建福州·期末
名校
9 . 已知: pH=-lgc(H+), pOH=-lgc(OH-)。 常温下,向某浓度的盐酸溶液中滴加氢氧化钠溶液,所得溶液pOH和pH变化如图所示。 下列说法正确的是
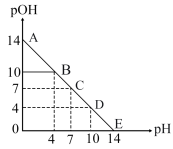

| A.盐酸与NaOH溶液的浓度相等 |
| B.B点和D点水的电离程度相同 |
| C.滴加NaOH溶液改为滴加氨水溶液,该图曲线不变 |
| D.升高温度,滴定过程中pOH+pH>14 |
您最近一年使用:0次
2019-01-08更新
|
124次组卷
|
3卷引用:福建省福州市2019届高三年上学期期末质量抽测化学试卷
(已下线)福建省福州市2019届高三年上学期期末质量抽测化学试卷重庆市乌江新高考协作体2023-2024学年高二上学期1月期末化学试题云南省大理市下关第一中学2023-2024学年高二下学期开学化学试题
名校
解题方法
10 . 现有浓度均为0.01mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水。请回答下列问题:
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是_________ (填序号)。
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是_______ (填序号)。
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是_______ 。
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=______________ ;该温度下,将pH之和为13的NaOH溶液和醋酸溶液等体积混合后,所得溶液呈____ (填“酸”“碱”或“中”)性。T℃时,将aL pH=11的NaOH溶液与bL pH=1的H2SO4溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________ 。
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=
您最近一年使用:0次



