名校
1 . 已知:常温下,用 的NaOH溶液滴定20.00mL
的NaOH溶液滴定20.00mL 的某一元酸HR的溶液,滴定过程中加入NaOH溶液的体(V)与溶液中
的某一元酸HR的溶液,滴定过程中加入NaOH溶液的体(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 的NaOH溶液滴定20.00mL
的NaOH溶液滴定20.00mL 的某一元酸HR的溶液,滴定过程中加入NaOH溶液的体(V)与溶液中
的某一元酸HR的溶液,滴定过程中加入NaOH溶液的体(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.HR为强酸 |
B.a点溶液中存在关系: |
C.常温下,HR的电离常数约为 |
D. 时,溶液中存在 时,溶液中存在 |
您最近一年使用:0次
2023-11-11更新
|
552次组卷
|
4卷引用:四川省达州外国语学校2023-2024学年高二上学期12月月考化学试题
名校
解题方法
2 . 0.1 mol/L 的① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④NaCl溶液,按pH由大到小的顺序,排列正确的是
溶液 ④NaCl溶液,按pH由大到小的顺序,排列正确的是
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④NaCl溶液,按pH由大到小的顺序,排列正确的是
溶液 ④NaCl溶液,按pH由大到小的顺序,排列正确的是| A.①②④③ | B.②①③④ | C.③④②① | D.④③②① |
您最近一年使用:0次
2023-11-11更新
|
803次组卷
|
11卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第二次月考试化学试卷
新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第二次月考试化学试卷宁夏六盘山高级中学2023-2024学年高二上学期第二次月考化学试题陕西省汉中市南郑区铁佛中学2023-2024学年高二上学期12月月考化学试题山东省济宁市微山县第二中学2023-2024学年高二上学期12月月考化学试题河南省开封市2023-2024学年高二上学期11月期中考试化学试题江西省抚州市资溪县第一中学2023-2024学年高二上学期11月期中化学试题宁夏育才中学2023-2024学年高二上学期1月期末化学试题甘肃省兰州市第五十五中学2023-2024学年高二下学期开学测试化学试卷黑龙江省哈尔滨师范大学青冈实验中学2023-2024学年高二上学期期中考试化学试题新疆乌鲁木齐第六十一中学2023-2024学年高二上学期期中考试化学试题新疆乌鲁木齐市六校联考2023-2024学年高二上学期期末考试化学试题
3 . 常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入等浓度的NaOH溶液或盐酸,CH3COOH和CH3COO-的分布分数δ与pH的关系如图所示。已知:分布分数δ(X)= ,X为CH3COOH和CH3COO-。
,X为CH3COOH和CH3COO-。

下列说法错误的是
 ,X为CH3COOH和CH3COO-。
,X为CH3COOH和CH3COO-。
下列说法错误的是
| A.曲线Ⅱ是CH3COO-的分布分数曲线 |
| B.Ka(CH3COOH)=10-4.76 |
| C.将等体积等浓度的CH3COOH与CH3COONa溶液混合后,溶液的pH=4.76 |
| D.X点溶液中c(CH3COO-)=c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
您最近一年使用:0次
2023-11-10更新
|
476次组卷
|
3卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第二次月考试化学试卷
名校
解题方法
4 . 下列实验探究方案能达到探究目的是
| 选项 | 探究方案 | 探究目的 |
| A | 分别向4mL  溶液中加2mL 溶液中加2mL  溶液和2mL 溶液和2mL 的 的 溶液 溶液 | 探究反应物浓度对化学反应速率的影响 |
| B | 分别向浓度均为 的含有 的含有 、 、 和 和 的三种溶液中逐滴加入 的三种溶液中逐滴加入 的 的 溶液,观察产生沉淀的先后顺序 溶液,观察产生沉淀的先后顺序 | 比较 、 、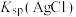 、 、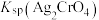 大小 大小 |
| C | 分别测浓度均为 的 的 和 和 溶液的pH值 溶液的pH值 | 比较 和 和 的水解常数 的水解常数 |
| D | 用量筒量取50mL 的NaOH溶液迅速倒入盛有50mL 的NaOH溶液迅速倒入盛有50mL 盐酸的量热计内筒,立即盖上杯盖 盐酸的量热计内筒,立即盖上杯盖 | 测定中和热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸常温下的电离常数如下表:
①常温下pH相同的三种溶液HA、 、
、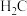 ,物质的量浓度最大的是
,物质的量浓度最大的是___________ (填化学式)。
②将过量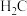 通入
通入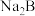 溶液,反应的离子方程式是
溶液,反应的离子方程式是___________ 。
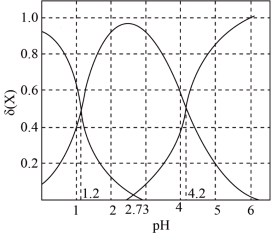
(2)二元弱酸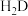 溶液中
溶液中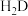 、
、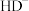 、
、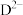 的物质的量分数
的物质的量分数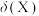 随pH的变化如图所示。
随pH的变化如图所示。
[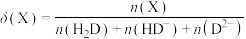 ,X为
,X为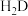 、
、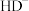 或
或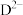 ]。
]。
则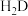 的电离平衡常数
的电离平衡常数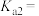
___________ 。
(3)常温下,用 的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,盐酸滴加至20.00mL时与氨水恰好完全中和(d点,pH约为5)。
的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,盐酸滴加至20.00mL时与氨水恰好完全中和(d点,pH约为5)。
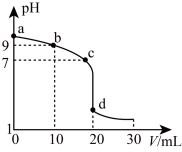
①依据变色pH范围判断下列试剂不适合 作该实验终点指示剂的是:___________ 。
A.甲基橙(变色pH范围3.1-4.4) B.甲基红(变色pH范围3.4-6.2)
C.酚酞(变色pH范围8.2-10.0) D.刚果红(变色pH范围3.0~5.2)
②___________ (填序号)溶液中的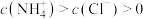 。
。
A.a点 B.b点 C.c点 D.d点
(4)滴淀法常用于物质含量的测定,以下为测量市售食醋总酸含量的方法(食醋总酸含量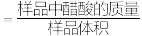 ,单位
,单位 )。
)。
取25mL市售食醋(假设其中酸均为醋酸)配成250mL溶液。每次取25.00mL于锥形瓶中,滴加2~3滴酚酞,在碱式滴定管中装入 的NaOH溶液进行滴定至终点,三次滴定的数据记录如表。(均在常温下测定)
的NaOH溶液进行滴定至终点,三次滴定的数据记录如表。(均在常温下测定)
滴定终点的现象为_____ 。求算食醋总酸含量______ 。(要求:写出计算过程,结果单位为 )
)
(1)已知部分弱酸常温下的电离常数如下表:
| 化学式 | HA |  | 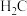 |
| 电离常数K | 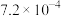 | 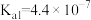 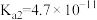 | 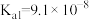 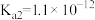 |
 、
、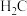 ,物质的量浓度最大的是
,物质的量浓度最大的是②将过量
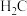 通入
通入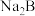 溶液,反应的离子方程式是
溶液,反应的离子方程式是(2)二元弱酸
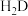 溶液中
溶液中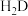 、
、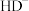 、
、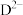 的物质的量分数
的物质的量分数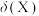 随pH的变化如图所示。
随pH的变化如图所示。
[
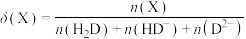 ,X为
,X为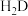 、
、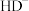 或
或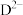 ]。
]。则
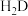 的电离平衡常数
的电离平衡常数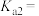
(3)常温下,用
 的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,盐酸滴加至20.00mL时与氨水恰好完全中和(d点,pH约为5)。
的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,盐酸滴加至20.00mL时与氨水恰好完全中和(d点,pH约为5)。
①依据变色pH范围判断下列试剂
A.甲基橙(变色pH范围3.1-4.4) B.甲基红(变色pH范围3.4-6.2)
C.酚酞(变色pH范围8.2-10.0) D.刚果红(变色pH范围3.0~5.2)
②
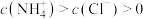 。
。A.a点 B.b点 C.c点 D.d点
(4)滴淀法常用于物质含量的测定,以下为测量市售食醋总酸含量的方法(食醋总酸含量
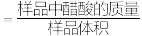 ,单位
,单位 )。
)。取25mL市售食醋(假设其中酸均为醋酸)配成250mL溶液。每次取25.00mL于锥形瓶中,滴加2~3滴酚酞,在碱式滴定管中装入
 的NaOH溶液进行滴定至终点,三次滴定的数据记录如表。(均在常温下测定)
的NaOH溶液进行滴定至终点,三次滴定的数据记录如表。(均在常温下测定)| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.22 | 25.20 |
| 2 | 2.24 | 27.26 |
| 3 | 0.14 | 27.08 |
 )
)
您最近一年使用:0次
2023-11-10更新
|
341次组卷
|
2卷引用:江苏省苏州大学附属中学2023-2024学年高二上学期12月月考化学试题
6 . 下列水溶液呈碱性的盐是
A. | B. | C. | D. |
您最近一年使用:0次
2023-11-10更新
|
237次组卷
|
3卷引用:广东省普宁市勤建学校2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
7 . 利用平衡移动原理,分析一定温度下 在不同pH的
在不同pH的 体系中的可能产物。
体系中的可能产物。
已知:
ⅰ.下图中曲线表示 体系中各含碳粒子的物质的量分数与pH的关系。
体系中各含碳粒子的物质的量分数与pH的关系。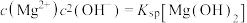 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合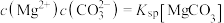 [注:起始
[注:起始 ,不同pH下
,不同pH下 由上图得到]。
由上图得到]。
 在不同pH的
在不同pH的 体系中的可能产物。
体系中的可能产物。已知:
ⅰ.下图中曲线表示
 体系中各含碳粒子的物质的量分数与pH的关系。
体系中各含碳粒子的物质的量分数与pH的关系。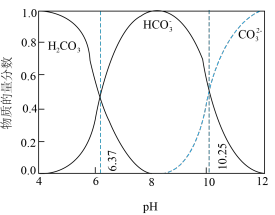
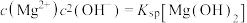 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合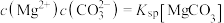 [注:起始
[注:起始 ,不同pH下
,不同pH下 由上图得到]。
由上图得到]。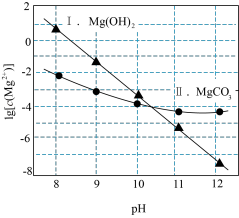
A.由第1个图,pH=9时,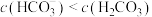 |
B.由第2个图,初始状态pH=9、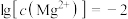 ,平衡后溶液中存在: ,平衡后溶液中存在: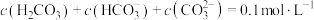 |
C.由第2个图,初始状态pH=11、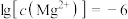 ,有沉淀生成 ,有沉淀生成 |
D.由两个图分析,初始状态pH=8、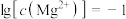 ,发生反应: ,发生反应: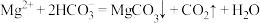 |
您最近一年使用:0次
2023-11-10更新
|
878次组卷
|
7卷引用:山东省青岛第一中学2023-2024学年高二上学期第二次月考化学试卷
山东省青岛第一中学2023-2024学年高二上学期第二次月考化学试卷浙江省绍兴市2024届高三上学期11月选考科目诊断性考试化学试题北京市第五中学2023-2024学年高三上学期12月月考化学试题浙江省杭州第四中学2023-2024学年高二上学期期末考试化学试题浙江省杭州学军中学2023-2024学年高二下学期期中考试化学试卷北京市第二中学2023-2024学年高三上学期期中测试化学试题(已下线)专题07 水溶液中的离子反应与平衡(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
解题方法
8 . 室温下,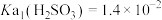 ,
, ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质。
溶液的性质。
实验1:用pH试纸测量0.1
 溶液的pH,测得pH约为5。
溶液的pH,测得pH约为5。
实验2:向0.1
 溶液中通入少量
溶液中通入少量 ,测得溶液pH约为8。
,测得溶液pH约为8。
实验3:向 溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向 溶液中滴加少量
溶液中滴加少量 溶液,产生白色沉淀。
溶液,产生白色沉淀。
下列所得结论正确的是
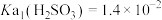 ,
, ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质。
溶液的性质。实验1:用pH试纸测量0.1

 溶液的pH,测得pH约为5。
溶液的pH,测得pH约为5。实验2:向0.1

 溶液中通入少量
溶液中通入少量 ,测得溶液pH约为8。
,测得溶液pH约为8。实验3:向
 溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
溶液中滴几滴酚酞,加水稀释,溶液红色变浅。实验4:向
 溶液中滴加少量
溶液中滴加少量 溶液,产生白色沉淀。
溶液,产生白色沉淀。下列所得结论正确的是
A.实验1可知0.1  溶液中存在: 溶液中存在: |
B.实验2得到的溶液中存在: |
C.实验3中随着水不断加入,溶液中 的值逐渐变小 的值逐渐变小 |
D.实验4中发生反应的离子方程式为 |
您最近一年使用:0次
2023-11-10更新
|
444次组卷
|
3卷引用:江苏省常州市第一中学2023-2024学年高二上学期12月月考化学试题
名校
9 . 分析化学中“滴定分数”的定义为:所加滴定剂与被滴定组分的物质的量之比。常温下以0.10mol·L-1的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法不 正确的是


| A.该酸碱中和滴定过程应该选用甲基橙做指示剂 |
| B.从x点到z点的整个过程中,y点的水的电离程度最大 |
| C.x点处的溶液中满足:c(MOH)+c(OH-)<c(M+)+c(H+) |
| D.根据y点坐标可以算得Kb(MOH)=9×10-7 |
您最近一年使用:0次
2023-11-10更新
|
459次组卷
|
5卷引用:江西省上饶市广丰中学2023-2024学年高二上学期12月考试化学试卷
名校
10 . 25℃时,用 高氯酸溶液分别滴定20.00mL
高氯酸溶液分别滴定20.00mL 溶液和20.00mL
溶液和20.00mL 氨水,两溶液的pH与所加高氯酸体积(V)的关系如图所示。下列说法正确的是
氨水,两溶液的pH与所加高氯酸体积(V)的关系如图所示。下列说法正确的是

 高氯酸溶液分别滴定20.00mL
高氯酸溶液分别滴定20.00mL 溶液和20.00mL
溶液和20.00mL 氨水,两溶液的pH与所加高氯酸体积(V)的关系如图所示。下列说法正确的是
氨水,两溶液的pH与所加高氯酸体积(V)的关系如图所示。下列说法正确的是
A.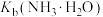 的数量级为 的数量级为 |
| B.高氯酸溶液滴定氨水选择酚酞作指示剂,且10<a<20 |
C.Q点所示溶液中有: |
| D.水的电离程度:P>M>Q>N |
您最近一年使用:0次
2023-11-09更新
|
247次组卷
|
2卷引用:四川省射洪中学校2023-2024学年高二上学期第三次月考化学试题



