1 . 下列有关说法正确的是
A. 乙二醛( 乙二醛(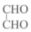 )和足量银氨溶液反应最多可得到 )和足量银氨溶液反应最多可得到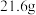 银 银 |
| B.醋酸钠溶液加水稀释时,溶液中所有离子浓度都减小 |
C.用稀硫酸和锌粒制取 时,加几滴 时,加几滴 溶液以加快反应速率 溶液以加快反应速率 |
D.已知:2 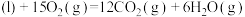 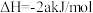 ,则苯的标准燃烧热为 ,则苯的标准燃烧热为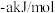 |
您最近一年使用:0次
21-22高二上·浙江·阶段练习
2 . 25℃时,浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液,测得c(NH )分别为a、b、c(mol·L-1),下列判断正确的是
)分别为a、b、c(mol·L-1),下列判断正确的是
 )分别为a、b、c(mol·L-1),下列判断正确的是
)分别为a、b、c(mol·L-1),下列判断正确的是| A.a=b=c | B.c>a>b | C.b>a>c | D.a>c>b |
您最近一年使用:0次
21-22高三上·湖南长沙·阶段练习
名校
解题方法
3 . 设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1mol的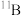 中,含有0.6NA个中子 中,含有0.6NA个中子 |
B.0℃、101kPa下,0.1mol乙炔和甲醛(HCHO)的混合物中含有 键的数目为0.2NA 键的数目为0.2NA |
C.将1mol 通入足量水中,所得溶液中 通入足量水中,所得溶液中 、HClO、 、HClO、 、 、 三种微粒数目之和为2NA 三种微粒数目之和为2NA |
D.常温下,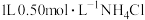 溶液与 溶液与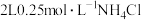 溶液所含 溶液所含 的物质的量后者小 的物质的量后者小 |
您最近一年使用:0次
4 . 在常温下,下列五种溶液:
①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4 ④1 L含0.1 mol NH3·H2O和0.1mol NH4Cl混合液 ⑤0.1 mol·L-1 NH3·H2O
请根据要求填写下列空白:
(1)①、③、④、⑤pH由小到大的顺序为___________ ;(填序号,下同)
(2)①、②、③、⑤中c(NH )由小到大的顺序为
)由小到大的顺序为___________ 。
(3)写出④中c(NH3) +c(NH3•H2O) +c(NH )=
)=___________ 。
(4)常温下,测得溶液②的pH=7,此溶液中水的电离程度___________ 该温度下纯水的电离程度(填“>”、“<”或“=”)
(5)取适量溶液⑤,加入少量氯化铵固体,此时溶液中的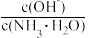 值
值___________ (填“增大”、“减小”或“不变”)
(6)常温下,将⑤与a mol/L盐酸等体积混合(不考虑溶液体的变化),反应后溶液恰好呈中性,用a表示NH3·H2O的电离平衡常数为___________ 。
①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4 ④1 L含0.1 mol NH3·H2O和0.1mol NH4Cl混合液 ⑤0.1 mol·L-1 NH3·H2O
请根据要求填写下列空白:
(1)①、③、④、⑤pH由小到大的顺序为
(2)①、②、③、⑤中c(NH
 )由小到大的顺序为
)由小到大的顺序为(3)写出④中c(NH3) +c(NH3•H2O) +c(NH
 )=
)=(4)常温下,测得溶液②的pH=7,此溶液中水的电离程度
(5)取适量溶液⑤,加入少量氯化铵固体,此时溶液中的
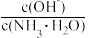 值
值(6)常温下,将⑤与a mol/L盐酸等体积混合(不考虑溶液体的变化),反应后溶液恰好呈中性,用a表示NH3·H2O的电离平衡常数为
您最近一年使用:0次
10-11高二下·福建福州·期末
5 . 在一定条件下,Na2CO3溶液存在水解平衡: +H2O⇌
+H2O⇌ +OH-。下列说法正确的是
+OH-。下列说法正确的是
 +H2O⇌
+H2O⇌ +OH-。下列说法正确的是
+OH-。下列说法正确的是| A.稀释溶液,水解平衡常数增大 | B.通入CO2,平衡朝正反应方向移动 |
C.升高温度,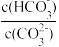 减小 减小 | D.加入NaOH固体,溶液pH减小 |
您最近一年使用:0次
2020-12-23更新
|
2122次组卷
|
48卷引用:解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)浙江省杭州第十一中学2023-2024学年高二上学期期末考试化学试题(已下线)2010-2011年福建省福州八中高二下学期期末考试化学试卷(已下线)2012-2013学年福建省福州八县一中高二上学期期末联考化学试卷(已下线)2013-2014学年山东省山师附中高二上学期期中考试化学试卷2014-2015学年甘肃省武威市六中高二上学期期中化学(理)试卷2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷2015届天津市津南区高三4月模拟练习理科综合化学试卷2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷2016-2017学年辽宁省鞍山一中高二上期中化学试卷山东省曲阜师范大学附属中学2017-2018学年高二上学期期中考试化学试题福建省福州市2016-2017学年高二上学期期中考试化学试题甘肃省兰州市第四中学2017-2018学年高二上学期期末考试化学试题安徽省滁州市定远县民族中学2018-2019学年高二上学期12月月考化学试题甘肃省靖远四中2018-2019学年高二第二学期开学检测化学试题(已下线)专题8.3 盐类水解(讲)-《2020年高考一轮复习讲练测》山东省德州市陵城区第一中学2019-2020学年高二12月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——盐类水解平衡的影响因素及探究(强化练习)湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题7 盐类水解的基础知识复习题黑龙江省牡丹江市东部地区四校联考2019-2020学年高二上学期期末考试化学试题河北省石家庄市元氏县第四中学2020-2021学年高二上学期第一次月考化学试题河北省石家庄市辛集市第一中学2020-2021学年高二上学期第一次考试化学试题(已下线)第27讲 盐类水解(精讲)——2021年高考化学一轮复习讲练测(已下线)3.3.2 影响盐类水解的主要因素 盐类水解的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)安徽省泗县第一中学2020-2021学年高二上学期第二次月考化学试题贵州省安顺市大洋实验学校2020-2021学年高二上学期期中考试化学试题江西省赣县第三中学2020-2021学年高二上学期12月月考化学试题江西省吉安县立中学2020-2021学年高二上学期期中考试化学试题河南省鹤壁市高中2020-2021学年高二年级上学期尖子生联赛调研(三)化学试题宁夏吴忠中学2020-2021学年高二上学期期末考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时42 盐类的水解影响因素及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题3.3.2 影响盐类水解的主要因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.3.2 影响盐类水解的主要因素(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)湖南省长沙市南雅中学2018-2019学年高二上学期期中考试化学试题甘肃省张掖市第二中学2021-2022学年高二上学期11月月考化学试题江西省抚州市南城县第二中学2021-2022年高二上学期第二次月考化学试题贵州省毕节市第一中学2021-2022学年高二上学期第二次阶段性考试化学试题四川省乐山市峨眉第二中学校2021-2022学年高二下学期3月月考化学试题(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)河南省三门峡市渑池县第二高级中学2021-2022学年高二上学期第二次月考化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题陕西省延安市富县高级中学2021-2022学年高二上学期期中考试化学试题3.3.2影响盐类水解的因素 课前安徽省芜湖市无为襄安中学2022-2023学年高二上学期12月月考化学试题
19-20高二·浙江·期中
6 . I.请回答下列问题:
(1)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1 mol 硼酸(H3BO3)晶体中含有___ mol 氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:__________________ 。

(2)比较酸性的相对强弱:H2SO4__ HClO4 (填“>”“=”或“<”),已知能发生反应:H2SO4(浓)+NaClO4 HClO4+NaHSO4,说明该反应能发生的理由
HClO4+NaHSO4,说明该反应能发生的理由_______________ 。
Ⅱ.氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝。查阅资料:①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2
NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
(1)氮化铝的制备

①实验中使用的装置如上图所示,请按照氮气流方向将各仪器接口连接:c→_____________ 。 (根据实验需要,上述装置可使用多次)
②D装置内氯化钯溶液的作用可能是_________________ 。
(2) AlN粉末会缓慢发生水解反应,粒径为100 nm的AlN粉末水解时溶液pH的变化如下图所示。

①AlN粉末水解的化学方程式是________________________ 。
②相同条件下,请在图中画出粒径为40 nm的AlN粉末水解的变化曲线__________ 。
(1)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1 mol 硼酸(H3BO3)晶体中含有

(2)比较酸性的相对强弱:H2SO4
 HClO4+NaHSO4,说明该反应能发生的理由
HClO4+NaHSO4,说明该反应能发生的理由Ⅱ.氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝。查阅资料:①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl
 NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2
NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。(1)氮化铝的制备

①实验中使用的装置如上图所示,请按照氮气流方向将各仪器接口连接:c→
②D装置内氯化钯溶液的作用可能是
(2) AlN粉末会缓慢发生水解反应,粒径为100 nm的AlN粉末水解时溶液pH的变化如下图所示。

①AlN粉末水解的化学方程式是
②相同条件下,请在图中画出粒径为40 nm的AlN粉末水解的变化曲线
您最近一年使用:0次
2020-12-18更新
|
524次组卷
|
3卷引用:【浙江新东方】105
19-20高三·浙江·期中
解题方法
7 . 25℃时100 mL1 mol/L的三种盐溶液NaX、NaY、NaZ、pH分别为7、8、9下列说法正确的是
| A.HX、HY、HZ的酸性依次增强,电离平衡常数依次减小 |
| B.三种溶液所含阴、阳离子的总数依次增多 |
| C.三种溶液均加水稀释到1000 mL,pH分别变为8、9、10 |
| D.2c(X-)-c(Y- )=c(HY)+c(Z-)+c(HZ) |
您最近一年使用:0次
20-21高二上·浙江·期中
名校
解题方法
8 . 已知NaHSO3溶液常温时显酸性,溶液中存在以下平衡:
 +H2O
+H2O H2SO3+OH-①
H2SO3+OH-① 
 H++
H++ ②
②
向0.1 mol/L的NaHSO3溶液中分别加入以下物质, 下列有关说法正确的是
 +H2O
+H2O H2SO3+OH-①
H2SO3+OH-① 
 H++
H++ ②
②向0.1 mol/L的NaHSO3溶液中分别加入以下物质, 下列有关说法正确的是
A.加入少量金属钠,平衡①左移,平衡②右移,溶液中c( )增大 )增大 |
B.加入少量 Na2SO3固体,则c(H+)+c(Na+)=c( )+c(OH-)+c( )+c(OH-)+c( ) ) |
C.加入少量 NaOH溶液,则 、 、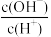 的值均增大 的值均增大 |
D.加入氨水至中性。则2c(Na+)=c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
您最近一年使用:0次
2020-12-11更新
|
287次组卷
|
5卷引用:【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】
(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题(已下线)课时42 盐类的水解影响因素及应用-2022年高考化学一轮复习小题多维练(全国通用)湖南省张家界市慈利县第一中学2023-2024学年高二上学期第二次月考化学试题
2020·浙江宁波·一模
9 . (1)已知酸性H2CO3>HClO> ,用一个离子方程式表示ClO-和
,用一个离子方程式表示ClO-和 结合H+的相对强弱
结合H+的相对强弱___________ 。
(2) NaNH2是离子化合物,各原子均满足稳定结构。写出NaNH2的电子式___________ 。
(3)在常压下,金刚石的硬度比足球烯(C60) 高。主要原因是___________ 。
 ,用一个离子方程式表示ClO-和
,用一个离子方程式表示ClO-和 结合H+的相对强弱
结合H+的相对强弱(2) NaNH2是离子化合物,各原子均满足稳定结构。写出NaNH2的电子式
(3)在常压下,金刚石的硬度比足球烯(C60) 高。主要原因是
您最近一年使用:0次
名校
10 . 常温下,下列说法不正确 的是
| A.在0.1mol·L-1的醋酸溶液中,加0.1mol/L的葡萄糖溶液,醋酸的电离程度增大 |
B.向 0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中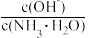 增大 增大 |
C.0.1mol·L-1的Na2CO3溶液中加入少量CaCl2晶体(碳酸钠没有被沉淀完全),CO 水解程度增大,但溶液的pH 减小 水解程度增大,但溶液的pH 减小 |
| D.pH=5的下列3种溶液:①HCl ②CH3COOH和CH3COONa混合溶液③NH4Cl溶液,水电离的程度:①=②<③ |
您最近一年使用:0次
2020-12-08更新
|
361次组卷
|
3卷引用:浙江省山水联盟2021届高三12月联考化学试题
浙江省山水联盟2021届高三12月联考化学试题(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)宁夏青铜峡市高级中学2020-2021学年高二上学期期末考试化学试题



