名校
1 . 按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因______ 。
(2)常温下,浓度均为0.1mol/L的下列五种溶液的PH值如下表所示:
①根据表中数据,将浓度均为0.01mol· L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是________ 。
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是___________ 。
A CH3COOH+Na2CO3═NaHCO3+CH3COONa
B CH3COOH+NaCN═CH3COONa+HCN
C CO2+H2O+2NaClO═Na2CO3+2HClO
D NaHCO3+HCN═NaCN+H2O+CO2
III.已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
(1)若向该溶液中滴加NaOH溶液,则离子沉淀先后顺序是 ______ (填离子符号),
(2)已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH=________ 时,溶液中Cu2+沉淀完全。[已知1g2=0.3]
(3)下列说法不正确的是_________ (填序号)。
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
③对于Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因
(2)常温下,浓度均为0.1mol/L的下列五种溶液的PH值如下表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是
A CH3COOH+Na2CO3═NaHCO3+CH3COONa
B CH3COOH+NaCN═CH3COONa+HCN
C CO2+H2O+2NaClO═Na2CO3+2HClO
D NaHCO3+HCN═NaCN+H2O+CO2
III.已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
(2)已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH=
(3)下列说法不正确的是
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
③对于Al(OH)3(s)
 Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡④除去溶液中的Mg2+,用OH-沉淀比用CO
 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
您最近一年使用:0次
2020-11-14更新
|
592次组卷
|
4卷引用:河北省石家庄市第一中学东校区2021-2022学年高二上学期第二次质量检测化学试题
河北省石家庄市第一中学东校区2021-2022学年高二上学期第二次质量检测化学试题吉林省长春北师大附属学校2021-2022学年高二上学期期中考试化学试题内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)
名校
2 . 下列说法正确的是
| A.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw |
| B.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
| C.FeCl3和MnO2均可催化H2O2分解,且催化效果相同 |
| D.向含有BaSO4沉淀的溶液中加入Na2SO4固体,溶液中c(Ba2+)增大 |
您最近一年使用:0次
2020-09-19更新
|
167次组卷
|
2卷引用:河北省祖冲之中学2020-2021学年高二上学期期末考试化学试题
3 . 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。请回答下列问题:
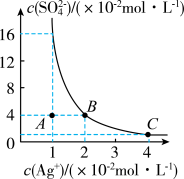
(1)A 点表示Ag2SO4是_____ ( 填“过饱和”“饱和”或“不饱和”)溶液。
(2)该温度下Ag2SO4的溶度积常数 Ksp=_____ 。(列式带入数据并计算出结果)
(3)现将足量的Ag2SO4 固体分别加入:
a.40mL0.01mol·L-1K2SO4溶液
b.10 mL 蒸馏水
c.10mL0.02mol·L-1H2SO4溶液。
则Ag2SO4的溶解程度由大到小的顺序为_____ (填字母)。
(4)向Ag2SO4悬浊液中加入足量Na2CrO4固体,可观察到有砖红色沉淀生成(Ag2CrO4为砖红色),写出沉淀转化的离子方程式:_____ 。

(1)A 点表示Ag2SO4是
(2)该温度下Ag2SO4的溶度积常数 Ksp=
(3)现将足量的Ag2SO4 固体分别加入:
a.40mL0.01mol·L-1K2SO4溶液
b.10 mL 蒸馏水
c.10mL0.02mol·L-1H2SO4溶液。
则Ag2SO4的溶解程度由大到小的顺序为
(4)向Ag2SO4悬浊液中加入足量Na2CrO4固体,可观察到有砖红色沉淀生成(Ag2CrO4为砖红色),写出沉淀转化的离子方程式:
您最近一年使用:0次
2020-07-04更新
|
104次组卷
|
4卷引用:河北省唐县第一中学2021-2022学年高二上学期12月考试化学试题
名校
4 . 已知25℃时,Mg(OH)2的溶度积常数KSP=5.6×10-12,MgF2的溶度积常数KSP=7.4×10-11。下列说法正确的是
| A.25℃时,向饱和MgF2溶液中加入饱和NaOH溶液后,不可能有Mg(OH)2生成 |
| B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 |
| C.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| D.25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的KSP相比较,前者小 |
您最近一年使用:0次
2020-03-05更新
|
382次组卷
|
5卷引用:河北省盐山中学2021-2022学年高二12月月考化学试题
2010·黑龙江哈尔滨·一模
名校
解题方法
5 . 已知 时,
时, 在水中的沉淀溶解平衡曲线如图所示,向
在水中的沉淀溶解平衡曲线如图所示,向 该条件下的
该条件下的 饱和溶液中加入
饱和溶液中加入 溶液,针对此过程的下列叙述正确的是
溶液,针对此过程的下列叙述正确的是
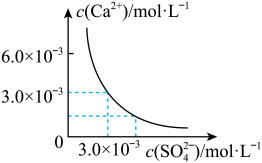
 时,
时, 在水中的沉淀溶解平衡曲线如图所示,向
在水中的沉淀溶解平衡曲线如图所示,向 该条件下的
该条件下的 饱和溶液中加入
饱和溶液中加入 溶液,针对此过程的下列叙述正确的是
溶液,针对此过程的下列叙述正确的是 
A.溶液中析出 沉淀,最终溶液中 沉淀,最终溶液中 较原来的大 较原来的大 |
B.溶液中无沉淀析出,溶液中 、 、 都变小 都变小 |
C.溶液中析出 沉淀,溶液中 沉淀,溶液中 、 、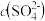 都变小 都变小 |
D.溶液中无沉淀析出,但最终溶液中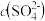 较原来的大 较原来的大 |
您最近一年使用:0次
2020-02-08更新
|
1289次组卷
|
21卷引用:河北省唐县第一中学2021-2022学年高二上学期12月考试化学试题
河北省唐县第一中学2021-2022学年高二上学期12月考试化学试题2015-2016学年河北省定州中学高二下期末化学试卷12015-2016学年河北省定州中学高二下期末化学试卷2(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)黑龙江省哈尔滨市第六中学2010届高三一模(理科综合)化学部分(已下线)2013届黑龙江省哈尔滨九中高三第四次(12月)月考化学试卷(已下线)2014高考名师推荐化学Ksp概念及简单应用(已下线)2013-2014江西省上饶市重点中学高三六校第二次联考理综化学试卷2014-2015湖南省益阳市箴言中学高二4月月考化学试卷2016届云南省玉溪一中高三下第七次月考理综化学试卷2016-2017学年黑龙江哈尔滨六中高二上期末化学卷【全国百强校】广东省汕头市金山中学2017-2018学年高二下学期期末考试化学试题步步为赢 高二化学暑假作业:作业十 水溶液中的离子平衡宁夏回族自治区银川市长庆高级中学2019-2020学年高二上学期第二次月考化学试题江西省山江湖协作体2019-2020学年高二上学期第三次月考(统招班)化学试题2019年秋高三化学复习强化练习—— 与浓度积的相关计算(强化练)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——沉淀溶解平衡的曲线分析四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)(已下线)湖南省邵东县第一中学2018-2019学年高二上学期第三次月考化学(理)试题(已下线)电离 水解 溶解平衡图像
名校
6 . 硫酸钡是一种比碳酸钡更难溶的物质。常温下-lg c(Ba2+)随-lg c(CO32-)或-lg c(SO42-)的变化趋势如图,下列说法正确的是( )
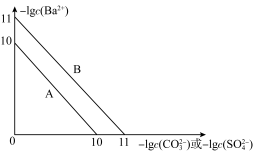

| A.趋势线A表示硫酸钡 |
| B.常温下,Ksp(BaCO3)=1×10-11 |
C.将碳酸钡和硫酸钡固体置于水中,此时溶液中的 =10 =10 |
| D.在硫酸钡悬浊液中,若要使0.1 mol的硫酸钡完全转化成碳酸钡,则需要加入碳酸钠的物质的量至少为0.1 mol |
您最近一年使用:0次
2020-01-03更新
|
1507次组卷
|
11卷引用:河北省保定市徐水综合高级中学2021-2022学年高二上学期第二次月考化学试题
河北省保定市徐水综合高级中学2021-2022学年高二上学期第二次月考化学试题黑龙江省鸡西市第一中学2020-2021学年度高二上学期期末化学试题重庆市南开中学2020-2021学年二上学期期末考试化学试题(已下线)专题3.4.1 难溶电解质的溶解平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)吉林省四平市第一高级中学2019届高三下学期第二次模拟考试化学试题2020届人教版高三化学二轮复习选择题专攻练——水溶液中的离子平衡湖南省长沙市湖南师范大学附属中学2020届高三线上月考理综化学试题四川省成都附属实验中学2021届高三10月月考理综化学试题广西南宁市第二中学2019~2020学年高二上学期期中考试化学(理科)试题第四节 沉淀溶解平衡 第1课时 难溶电解质的沉淀溶解平衡陕西省榆林市府谷中学2022-2023学年高二上学期期末线上考试化学试题
名校
7 . 向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,原理如下:
Cu(s)+Cu2+(aq) 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl-(aq)+Cu+(aq) CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。

下列说法正确的是
Cu(s)+Cu2+(aq)
 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1Cl-(aq)+Cu+(aq)
 CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。

下列说法正确的是
| A.溶液pH越大,Ksp(CuCl)增大 |
| B.反应达到平衡时增大c(Cu2+),c(Cl-)减小 |
| C.向电解液中加入稀硫酸,有利于Cl-的去除 |
D. Cu(s)+ Cu(s)+ Cu2+(aq)+Cl-(aq) Cu2+(aq)+Cl-(aq) CuCl(s) ΔH=(a+2b) kJ·mol-1 CuCl(s) ΔH=(a+2b) kJ·mol-1 |
您最近一年使用:0次
2019-09-04更新
|
997次组卷
|
16卷引用:河北省秦皇岛市抚宁区第一中学2021届高三1月月考理综化学试题
河北省秦皇岛市抚宁区第一中学2021届高三1月月考理综化学试题吉林省长春市东北师范大学附中2020-2021学年高二上学期期末考试化学试题天津市耀华中学2021届高三年级第一次模拟考试化学试题【全国市级联考】江苏省南通市2018年高三第三次调研测试化学试题(已下线)《考前20天终极攻略》6月4日 专项四 化学坐标曲线图分析2018届南通泰州扬州等七市高三化学三模试卷(已下线)2018届高三高考题及模拟题汇编 专题10 水溶液中的离子平衡【全国百强校】江苏省徐州市第一中学2019届高三上学期第一次月考化学试题【全国百强校】湖南省衡阳市第八中学2018-2019学年高二上学期六科联赛试题(12月)化学试题【全国百强校】广西壮族自治区南宁市第三中学2018-2019学年高二下学期期中考试化学试题湖南省衡阳市第八中学2020届高三模拟检测理科综合化学试题广东省中山一中、仲元中学等七校联合体2020届高三第一次联考(8月)理综化学试题重庆市2019-2020学年高三下学期网络考试化学试题江西省南昌市四校联盟2020届高三第二次联考理综化学试题(已下线)本册综合检测(一)——2020-2021学年高二化学选修四同步单元AB卷(人教版)2019-2020广东省广州市广州中学高三10月考试化学试卷
真题
名校
8 . 一定温度下,AgCl(s) Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
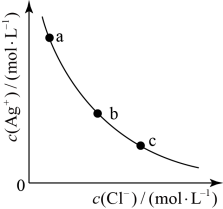
 Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是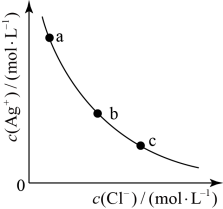
| A.a、b、c三点对应的Ksp相等 |
| B.AgCl在c点的溶解度比b点的大 |
| C.AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-) |
| D.b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化 |
您最近一年使用:0次
2019-06-24更新
|
5328次组卷
|
12卷引用:河北正定中学2020-2021学年高二上学期第一次半月考化学试题
河北正定中学2020-2021学年高二上学期第一次半月考化学试题2019年高考海南卷化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期第二次月考化学试题广西钦州市第一中学2021届高三开学摸底考试理科综合化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)3.4 难溶电解质的溶解平衡(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖北省恩施土家族苗族自治州巴东县第一高级中学2020-2021学年高二上学期第一次月考化学试题(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)2019年高考海南卷化学试题变式题(不定项选择题)山东省菏泽市东明县第一中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
9 . 沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=_____ mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是_______________________ 。(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________ mol·L-1。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是
您最近一年使用:0次
2019-03-27更新
|
120次组卷
|
3卷引用:河北省石家庄市辛集市第一中学2020-2021学年高二月考第四次考试(一)化学试题
河北省石家庄市辛集市第一中学2020-2021学年高二月考第四次考试(一)化学试题【全国百强校】黑龙江省大庆市第一中学2018-2019学年高二下学期开学检测化学试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算
名校
10 . 下列事实不能用平衡移动原理解释的是
| A.Mg(OH)2不溶于水,但能溶于浓NH4Cl溶液中 |
| B.水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去 |
| C.洗涤BaSO4沉淀时,用稀硫酸洗涤BaSO4沉淀比用蒸馏水洗涤损失少 |
| D.FeCl3溶液中混有FeCl2,常加入少量的H2O2,使Fe2+氧化为Fe3+ |
您最近一年使用:0次
2016-12-09更新
|
242次组卷
|
3卷引用:河北省石家庄市第一中学2021-2022学年高二上学期10月月考化学试卷
河北省石家庄市第一中学2021-2022学年高二上学期10月月考化学试卷2015-2016学年湖南省娄底市湘中名校高二上期末理化学试卷(已下线)2018年11月20日 《每日一题》人教选修4-沉淀溶解平衡在物质分离中的应用



