9-10高二下·辽宁锦州·期末
名校
解题方法
1 . 现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高正化合价:④>③=②>① |
您最近一年使用:0次
2022-12-21更新
|
4115次组卷
|
212卷引用:云南省云南省楚雄彝族自治州民族中学2022-2023学年高二下学期6月月考化学试题
云南省云南省楚雄彝族自治州民族中学2022-2023学年高二下学期6月月考化学试题(已下线)09—10年锦州市高二下学期期末考试化学卷(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012学年福建省泉州一中高二下学期期中考试化学试卷(已下线)2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(平行班)(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2012-2013学年黑龙江省牡丹江一中高二下学期期末考试化学试卷(已下线)2012-2013学年福建省四地六校高二下学期第二次联考化学试卷(已下线)2013-2014学年浙江省瑞安中学高二上学期期中化学试卷(实验班)(已下线)2013-2014学年浙江省杭州及周边重点中学高二下学期期中化学试卷(已下线)2013-2014学年辽宁省鞍山市高二下学期期末考试化学(B卷)试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015福建省宁德市五校教学联合体高二下学期期中化学试卷2014-2015学年山东省淄博市高二下学期期末统考化学试卷2015-2016学年四川省雅安市天全中学高二9月月考化学试卷2015-2016学年四川省雅安中学高二上10月月考化学试卷2015-2016学年山西省太原五中高二下3月周练化学试卷2015-2016学年吉林省前郭县五中高二下学期第一次月考化学试卷2015-2016学年山西省康杰中学高二下期中化学试卷2015-2016学年山西省怀仁一中高二下第三次月考化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷2015-2016学年四川省成都市新都一中高二下4月月考化学试卷2015-2016学年新疆哈密二中高二下期末化学试卷2016-2017学年四川省三台中学校高二上月考化学试卷2017届山西省重点中学协作体高三上期中化学试卷2016-2017学年福建省三明市第一中学高二下学期第一次月考化学试卷2016-2017学年山西省太原市外国语学校高二下学期第一次月考化学试卷河北省石家庄市第一中学2016-2017学年高二下学期期中考试化学试题江西省玉山县第一中学2017届高三化学板块复习测试:物质结构与性质2018版化学(苏教版)高考总复习专题十一课时跟踪训练--原子结构与元素的性质宁夏石嘴山市第三中学2016-2017学年高二下学期期末(2018届高三入学)考试化学试题湖北省孝感市八所重点高中教学协作体2016-2017学年高二7月联合考试化学试题(B)安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二12月月考化学试题黑龙江省哈尔滨六中2017-2018学年高二12月月考化学试卷四川省凉山木里中学2017-2018学年高二上学期期中考试化学试卷内蒙古赤峰二中2017-2018学年高二上学期期末考试化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时河南省豫西名校2017-2018学年高二下学期第一次联考化学试题山西省祁县中学2017-2018学年高二4月月考化学试题【全国校级联考】辽宁省抚顺市六校2017-2018学年高二下学期期末考试化学试题内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题陕西省黄陵中学2017-2018学年高二(重点班)下学期期末考试化学试题【全国百强校】福建省厦门外国语学校2018-2019学年高二上学期第一次月考化学试题四川省德阳市第五中学2018-2019学年高二上学期10月月考化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题(已下线)2018年12月2日 《每日一题》 一轮复习-每周一测贵州省息烽县一中2018-2019学年高二11月份考试化学试题山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题云南省玉溪市峨山一中2018-2019学年高二12月份考试化学考试福建省华安县第一中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】山西省实验中学2018-2019学年高二下学期第一次月考化学试题广西蒙山县第一中学2018-2019学年高二下学期第一次月考化学试题福建省罗源市第一中学2018-2019学年高二下学期3月月考化学试题吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高二下学期4月月考化学试题云南省景谷一中2018-2019学年高二下学期第一次月考化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题步步为赢 高二化学暑假作业:作业十四 物质结构与性质(选修3)新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题【全国百强校】天津市静海区第一中学2018-2019学年高二下学期5月月考化学试题福建省莆田第八中学2018-2019学年高二下学期第二次月考化学试题福建省莆田第六中学2018-2019学年高二下学期期中考试(B卷)化学试题吉林省公主岭市范家屯镇第一中学2018-2019学年高二下学期期中考试化学试题辽宁省瓦房店市高级中学2018-2019学年高二下学期期末考试化学试题广西壮族自治区蒙山县第一中学2019-2020学年高二下学期期末考试化学试题广西蒙山一中2018-2019学年高二下学期期末考试化学试题(已下线)2019年11月22日 《每日一题》2020年高考化学一轮复习——电离能和电负性海南省三亚华侨学校2019-2020学年高二上学期期中考试化学试题宁夏石嘴山市第三中学2019-2020学年高二上学期期末考试化学试题四川省广元川师大万达中学2019-2020学年高二上学期期末教学质量检测化学试题四川省绵阳市三台县芦溪中学2017-2018学年高二上学期第五次月考化学试题2020届高三化学二轮物质结构题型专攻——基态原子核外电子排布【选择基础专练】2020届高中化学第一轮复习第十二章《物质结构与性质》测试卷人教化学选修3第一章第二节课时3内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)四川省武胜烈面中学校2019-2020学年高二下学期开学考试化学试题四川省阆中中学2019-2020学年高一(仁智班)下学期开学考试化学试题安徽省蚌埠二中2019-2020学年高二下学期开学检测化学试题甘肃省兰州市第一中学2019-2020学年高二下学期4月月考化学试题安徽省滁州市明光市明光中学2019-2020高二下学期第二次月考化学试题河南省郑州市外国语学校2019-2020学年下学期高二第一次月考化学试题四川省越西中学2019-2020学年高二5月月考化学试题辽宁省营口市部分重点高中2017-2018学年高二下学期期末考试化学试题山西省朔州市第一中学2019-2020高二下学期5月月考化学试题山西省太原市阳曲县第一中学2019-2020学年高二5月复学检测化学试题湖北宜城市第二中学2019-2020学年高二下学期期中考试化学试题江苏省震泽中学2019-2020学年高一下学期期中考试(杨班)化学试题新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题安徽省池州市第一中学2019-2020学年高二下学期期中教学质量检测化学试题河北省沧州市任丘市第一中学2019-2020学年高二下学期开学考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(实验班)贵州省思南中学2019-2020学年高二下学期期中考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题海南省海口市2019-2020学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学等友好学校2019-2020学年高二下学期期末考试化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期末考试化学试题福建省龙岩市一级达标校2019-2020学年高二下学期期末质检化学试题(已下线)第34讲 原子结构与性质-2021年高考化学一轮复习名师精讲练四川省成都外国语学校2019-2020学年高二5月月考化学试题江苏省上冈高级中学2019-2020学年高二上学期期中考试化学(选修)试题湖北省武汉市五校联合体2019-2020学年高一下学期期末考试化学试题江苏宿迁泗阳县众兴中学2021届高三上学期调研考试化学试题四川省乐山沫若中学2020-2021学年高二上学期第一次月考化学试题四川省遂宁市安居区2020-2021学年高二上学期期中考试化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测四川省遂宁市第二中学2020-2021学年高二上学期期中考试化学试题山东潍坊高密一中2020-2021学年高二上学期12月化学月考试题新疆哈密市第八中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质湖北省孝感市高级中学2020—2021学年高二下学期2月调研考试化学试题(已下线)第01章 原子结构与元素性质(B卷能力提升篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)福建省泉州市四校(晋江磁灶中学等)2019-2020学年高二下学期期中联考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题新疆乌苏市第一中学2020-2021学年高二3月月考化学(4-21班)试题福建省福州市福清西山学校2020-2021学年高二下学期3月月考化学试题福建省连城县第一中学2020-2021学年高二下学期第一次月考化学试题福建省莆田第二十五中学2020-2021学年高二下学期第一次月考化学试题四川省成都七中实验学校2020-2021学年高二下学期3月阶段性考试化学试题四川省成都市阳安中学2020-2021学年高二下学期3月月考化学试题福建省永安市第三中学2020-2021学年高二3月月考化学试题黑龙江省齐齐哈尔市第一中学2020-2021学年高二下学期4月月考化学试题湖北省鄂西北六校联考2020-2021学年高二下学期期中考试化学试题贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题湖北省宜城一中等五校联考2020-2021学年高二下学期期中考试化学试题四川省眉山市仁寿县四校2020-2021学年高二5月月考化学试题福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题江苏省常州市礼嘉中学2020-2021学年高二下学期第二次阶段质量调研化学试题(已下线)第36讲 原子结构与性质(精讲)-2022年一轮复习讲练测人教2019选择性必修2第一章 原子结构与性质复习与提高宁夏石嘴山市平罗中学2021-2022学年高二上学期期中考试化学试题天津市和平区2021-2022学年高二上学期线上期末质量检测化学试题山西省名校联考2021-2022学年高二上学期期末考试化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖南省邵阳市邵东市2021-2022学年高二上学期期末统考化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)湖北省鄂州市2021-2022学年高二上学期期末质量监测化学试题河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试西藏班化学试题云南省通海县第一中学2021-2022学年高二下学期3月月考化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期3月份考试化学试题广东省十五校联盟2021-2022学年高二下学期第一次联考化学试题宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题云南省宁蒗彝族自治县第一中学2021-2022学年高二下学期3月考试化学试题重庆市育才中学2021-2022学年上学期高二上学期第六次定时练习化学试题内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期4月月考化学试题海南省东方中学2021-2022学年高二下学期第一次月考化学试题广东省揭阳市榕城区仙桥中学2021-2022学年高二下学期期中考试化学试题河南省开封市五县部分校2021-2022学年高二下学期期中考试化学试题安徽省蚌埠第三中学2021-2022学年高二下学期4月阶段测试化学试题重庆市朝阳中学2021-2022学年高二下学期第一次月考化学试题安徽省亳州市第二中学2021-2022学年高二下学期期末考试化学试题广东省广州市荔湾区2021-2022学年高二下学期期末考试化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题云南省蒙自一中2021-2022学年高二下学期3月份考试化学试题新疆乌苏市第一中学2021-2022学年高二下学期3月月考化学试题(加强班)新疆乌苏市第一中学2021-2022学年高二下学期3月月考化学试题(平行班)浙江省诸暨市海亮高级中学2021-2022学年高二上学期期中考试化学试题湖南省长沙市明达中学2021-2022学年高二上学期期末考试化学试题福建省三明市宁化第六中学2021-2022学年高二下学期第一次月考化学试题海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题陕西省西安市阎良区关山中学2021-2022学年高二下学期期末质量检测化学试题安徽省滁州市定远县育才学校2021-2022学年高二分层班下学期期中考试化学试题上海市建平中学2022-2023学年上学期高二10月月考化学(B卷)试题河北省石家庄市第二中学2022-2023学年高二上学期10月月考化学试题(已下线)第36讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第36讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(全国通用)海南省琼海市嘉积中学2022-2023学年高二上学期第二次月考(期中)化学试题河北省衡水市第二中学2022-2023学年高二上学期期中考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高二上学期12月月考化学试题天津市南开中学2022-2023学年高三上学期第三次月考化学试题吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题天津市天津中学2022-2023学年高二上学期线上期末考试化学试题(已下线)1.2.2 元素周期律-同步学习必备知识广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题江西省九江市濂溪区第一中学2022-2023学年高二上学期期末考试化学试题湖北省十堰市普通高中协作体2022-2023学年高二下学期3月月考化学试题河北省石家庄市辛集市2022-2023学年高二上学期期末教学质量监测化学试题福建省龙岩第一中学2022-2023学年高二下学期第一次月考化学试题福建省永安市第三中学高中校2022-2023学年高三下学期第一次月考(3月)化学试题贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考化学试题江西省抚州市第一中学2022-2023学年高二下学期第一次月考化学试题福建省莆田第十五中学2022-2023学年高二下学期第一次月考(3月)化学试题广东省台山市第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)专题01 原子结构与性质(知识串讲+专题过关)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)河南省洛阳市2022-2023学年高二下学期期中考试化学试题甘肃省高台县第一中学2022-2023学年高二下学期期中考试化学试题广东省佛山市顺德区郑裕彤中学2022-2023学年高二下学期期末模拟化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高二下学期期中考试化学试题内蒙古赤峰二中2022-2023学年高二下学期第二次月考化学试题广东省汕尾市华大实验学校2022-2023学年高二下学期5月月考化学试题河南省驻马店市环际大联考2022-2023学年高二下学期4月期中考试化学试题四川省绵阳中学2022-2023学年高二上学期9月线上测试化学试题甘肃省庆阳第六中学2022-2023学年高二下学期期中考试化学试题海南省海口市第一中学2023-2024学年高二上学期第一次月考化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷贵州省黔西南布依族苗族自治州2023-2024学年高一上学期1月期末化学试题黑龙江省黑河市第一中学2023-2024学年高二下学期4月月考化学试题陕西省汉中市西乡县第一中学2023-2024学年高二下学期3月月考化学试题四川省内江市威远县威远中学校2023-2024学年高二下学期第一次月考化学试卷内蒙古赤峰新城红旗中学2023-2024学年高二下学期4月月考化学试题河北省石家庄市西山学校2023-2024学年高二上学期期末考试化学试题内蒙古自治区赤峰第四中学2023-2024学年高二下学期4月月考化学试题四川省泸州市泸州老窖天府中学2023-2024学年高二下学期5月期中考试化学试题
名校
解题方法
2 . 下列各项叙述错误的是
A.若硫原子核外电子排布图为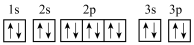 ,则违反了泡利原理 ,则违反了泡利原理 |
B.若21号Sc元素的基态原子电子排布式为 ,则违反了构造原理 ,则违反了构造原理 |
C.铍原子的核外电子排布图为 ,符合洪特规则和泡利原理 ,符合洪特规则和泡利原理 |
D.原子的电子排布式由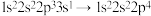 能释放特定能量产生发射光谱 能释放特定能量产生发射光谱 |
您最近一年使用:0次
2022-11-12更新
|
2036次组卷
|
6卷引用:云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题
云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题重庆第八中学2022-2023学年高二上学期期中考试化学试题(已下线)专题01 原子结构与性质(知识串讲+专题过关)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)1.2.1基态原子的核外电子排布(课中)-鲁科版选择性必修2宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题
解题方法
3 . 原子序数依次增大的五种元素A、B、E、F、G,A是周期表中原子半径最小的元素;B的基态原子价层电子排布为 ;E的基态原子
;E的基态原子 能级有3个单电子;F的基态原子L层电子数是K层电子数的3倍;G2+的
能级有3个单电子;F的基态原子L层电子数是K层电子数的3倍;G2+的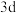 轨道中有6个电子。回答下列问题:
轨道中有6个电子。回答下列问题:
(1)G的基态原子的简化电子排布式为_______ ,价层电子的电子排布图为_______ ,其最外层电子的电子云形状为_______ 。
(2)基态G原子核外电子共占据了_______ 个能级,这些核外电子的空间运动状态有_______ 种。G元素在周期表中位置是_______ ,属于_______ 区元素(选填“s”、“p”、“d”或“ds”)。
(3) A、B、E、F是构成有机物的最重要的四种元素,这四种元素的第一电离能大小顺序为_______ 、电负性大小顺序为_______ 。
(4)基态E原子核外有_______ 种运动状态的电子。
(5)Mg、Al 两种元素中第一电离能较大的是_______ (填元素符号),原因为_______ 。
 ;E的基态原子
;E的基态原子 能级有3个单电子;F的基态原子L层电子数是K层电子数的3倍;G2+的
能级有3个单电子;F的基态原子L层电子数是K层电子数的3倍;G2+的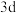 轨道中有6个电子。回答下列问题:
轨道中有6个电子。回答下列问题:(1)G的基态原子的简化电子排布式为
(2)基态G原子核外电子共占据了
(3) A、B、E、F是构成有机物的最重要的四种元素,这四种元素的第一电离能大小顺序为
(4)基态E原子核外有
(5)Mg、Al 两种元素中第一电离能较大的是
您最近一年使用:0次
解题方法
4 . 下列化学用语或图示表达正确的是
A.F-的结构示意图为 | B.苯的实验式:C6H6 |
C. 的电子式: 的电子式: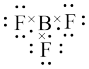 | D.基态氮原子的轨道表示式: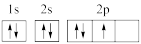 |
您最近一年使用:0次
5 . 已知A、B、C、D、E为原子序数依次增大的前36号元素,A的2p轨道有3个电子;B是地壳中含量最多的元素;C元素的M层有一个电子;D元素形成的单质具有两性;E的基态原子的电子排布为[Ar]3d104S1。回答下列问题(用元素符号或化学式表示):
(1)C的基态原子核外电子排布式为___________ ,E在元素周期表中位于___________ 区。
(2)B、C、D的原子半径由大到小的顺序为___________ (填元素符号)。
(3)A、B的第一电离能的大小关系是___________ (填元素符号)并从结构特点解释原因___________ 。
(4)B、C、D的电负性由大到小的顺序为___________ (填元素符号)。
(1)C的基态原子核外电子排布式为
(2)B、C、D的原子半径由大到小的顺序为
(3)A、B的第一电离能的大小关系是
(4)B、C、D的电负性由大到小的顺序为
您最近一年使用:0次
6 . 下列有关说法不正确的是
| A.基态原子的核外电子排布遵循能量最低原理 |
| B.原子核外电子从基态变成激发态一定需要吸收能量 |
| C.原子核外电子从基态跃迁到激发态时,只能跃迁到稍高的能级,如从2s只能跃迁到2p |
| D.夜幕下的霓虹灯光、军事上使用的激光均与原子核外电子发生跃迁有关 |
您最近一年使用:0次
7 . 下列说法或表达方式中不正确的是
| A.电子从激发态到基态产生的光谱是发射光谱 |
| B.第三、四周期同主族元素的原子序数均相差8 |
| C.第三周期元素中第一电离能介于Mg和S之间的元素只有1种 |
D.基态氯原子的价层电子的轨道表示式为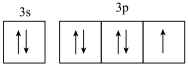 |
您最近一年使用:0次
2022-08-28更新
|
669次组卷
|
2卷引用:云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题
8 . 短周期元素D、E、F、W原子序数依次递增,已知:
①D元素的某种同位素通常用于地质年代的鉴定;
②F元素电负性在周期表所有元素中位列第二;
③W的各级电离能如图。
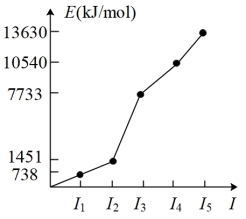
下列判断不正确的是
①D元素的某种同位素通常用于地质年代的鉴定;
②F元素电负性在周期表所有元素中位列第二;
③W的各级电离能如图。

下列判断不正确的是
| A.D、E、F三元素的第一电离能由大到小的顺序是E>F>D |
| B.D、E、F三元素的简单氢化物中可形成氢键的有两种 |
| C.元素W在周期表中的位置是第3周期第IIA族 |
D.基态D原子价电子轨道表示式为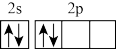 |
您最近一年使用:0次
2022-08-26更新
|
119次组卷
|
2卷引用:云南省云南省楚雄彝族自治州民族中学2022-2023学年高二下学期6月月考化学试题
名校
9 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
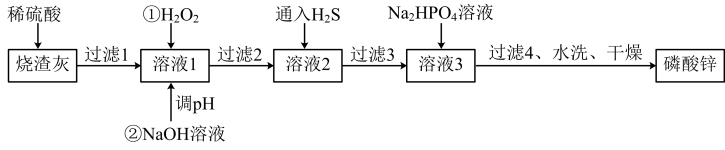
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)基态Zn原子的价电子排布式为______
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是______ (填一条)。
(3)加入H2O2的作用_______
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是______ 。
(5)加入Na2HPO4溶液发生反应的离子方程式为_____ 。
(6)洗涤磷酸锌沉淀时应选用____ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是_____ 。
(7)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=______ (已知:25°C时,H2S的电离平衡常数Ka1=1×10-7,Ka2=1×10-15)。

已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是
(3)加入H2O2的作用
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(5)加入Na2HPO4溶液发生反应的离子方程式为
(6)洗涤磷酸锌沉淀时应选用
(7)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=
您最近一年使用:0次
2022-08-25更新
|
490次组卷
|
3卷引用:云南省楚雄第一中学2022届高三理综化学试题
名校
10 . Ⅰ.双氰胺结构简式如图。
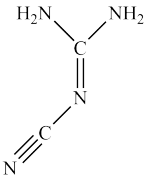
(1)双氰胺的晶体类型为_______ 。
(2)双氰胺所含元素中,_______ (填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_______ 。
Ⅱ.硼的最简单氢化物——乙硼烷球棍模型如下图,由它制取硼氢化锂的反应为2LiH+B2H6=2LiBH4
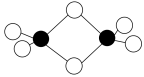
(4)乙硼烷分子中硼原子的杂化轨道类型为_______ 。
(5)BH 为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为_______ (填序号)。
A.离子键 B.金属键 C.氢键 D.配位键 E.极性键 F.非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为_______ (填元素符号)。
(7)碳的最简单氢化物是CH4,而硼的最简单氢化物不是BH3,其原因为_______ 。

(1)双氰胺的晶体类型为
(2)双氰胺所含元素中,
(3)双氰胺分子中σ键和π键数目之比为
Ⅱ.硼的最简单氢化物——乙硼烷球棍模型如下图,由它制取硼氢化锂的反应为2LiH+B2H6=2LiBH4

(4)乙硼烷分子中硼原子的杂化轨道类型为
(5)BH
 为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为A.离子键 B.金属键 C.氢键 D.配位键 E.极性键 F.非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为
(7)碳的最简单氢化物是CH4,而硼的最简单氢化物不是BH3,其原因为
您最近一年使用:0次



