名校
解题方法
1 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子最高能级有3个未成对电子,Z与X形成的化合物 常用于汽车的安全气囊,Y、W处于同一主族,下列说法错误的是
常用于汽车的安全气囊,Y、W处于同一主族,下列说法错误的是
 常用于汽车的安全气囊,Y、W处于同一主族,下列说法错误的是
常用于汽车的安全气囊,Y、W处于同一主族,下列说法错误的是| A.原子的半径:Z>W>X>Y |
| B.简单氢化物的还原性、水溶液的酸性:W>Y |
C.化合物 中存在离子键、非极性共价键 中存在离子键、非极性共价键 |
| D.同周期中第一电离能小于X的元素有4种 |
您最近一年使用:0次
2023-01-12更新
|
334次组卷
|
3卷引用:山东省青岛市胶州市2022-2023学年高三上学期期末学业水平检测化学试题
2 . X、Y、Z、W、Q为原子序数依次增大的短周期主族元素,X的原子半径小于Y的原子半径,Z基态原子核外有3个未成对电子,Y的核外电子数与Z的价层电子数相等,Q2是氧化性最强的单质,下列说法正确的是
| A.键能:Z2<W2<Q2 | B.YQ3、ZQ3 均为非极性分子 |
| C.沸点:X2W<XQ | D.同周期中第一电离能介于Y和Z之间的元素有3种 |
您最近一年使用:0次
2024-03-09更新
|
350次组卷
|
4卷引用:山东省烟台市2023-2024学年高三上学期期末考试化学试题
3 . 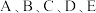 形成简单离子的最外层电子排布均为
形成简单离子的最外层电子排布均为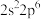 ,且半径依次减小。C、D、E原子中均仅有一个未成对电子。
,且半径依次减小。C、D、E原子中均仅有一个未成对电子。 单质为双原子分子,化学性质稳定。
单质为双原子分子,化学性质稳定。 组成典型的离子化合物
组成典型的离子化合物 ,其晶体结构类似于
,其晶体结构类似于 晶体。下列说法正确的是
晶体。下列说法正确的是
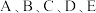 形成简单离子的最外层电子排布均为
形成简单离子的最外层电子排布均为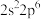 ,且半径依次减小。C、D、E原子中均仅有一个未成对电子。
,且半径依次减小。C、D、E原子中均仅有一个未成对电子。 单质为双原子分子,化学性质稳定。
单质为双原子分子,化学性质稳定。 组成典型的离子化合物
组成典型的离子化合物 ,其晶体结构类似于
,其晶体结构类似于 晶体。下列说法正确的是
晶体。下列说法正确的是A.简单气态氢化物的稳定性: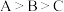 |
B.简单离子的氧化性: |
C.第一电离能: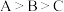 |
D. 单质与 单质与 的最高价氧化物对应的水化物均可发生反应 的最高价氧化物对应的水化物均可发生反应 |
您最近一年使用:0次
2023-08-24更新
|
262次组卷
|
2卷引用:云南省保山市2021-2022学年高二下学期期末考试理综化学试题
4 . 现有四种元素的基态原子的电子排布式如下:① ;②
;②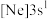 ;③
;③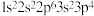 ;④
;④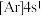 。则下列说法中正确的是
。则下列说法中正确的是
 ;②
;②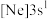 ;③
;③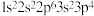 ;④
;④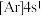 。则下列说法中正确的是
。则下列说法中正确的是| A.①和③元素均为非金属元素,并且位于同一主族 |
| B.②号元素的单质具有强氧化性 |
C.第一电离能: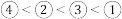 |
D.电负性: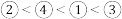 |
您最近一年使用:0次
2024-02-11更新
|
283次组卷
|
2卷引用:内蒙古呼和浩特市2023-2024学年高二上学期期末教学质量检测化学试卷
名校
解题方法
5 . X、Y均为第三周期元素,Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]—的形式存在,下列说法不正确 的是
| A.原子半径:X>Y |
| B.气态简单氢化物的还原性:X>Y |
| C.最高价氧化物对应水化物的酸性:Y>X |
| D.同周期中第一电离能小于X的元素共有4种 |
您最近一年使用:0次
2022-11-08更新
|
1167次组卷
|
6卷引用:江苏省南京外国语学校2022-2023学年高三上学期期末考试化学试题
江苏省南京外国语学校2022-2023学年高三上学期期末考试化学试题江苏省南京外国语学校2022-2023学年高三上学期期末考试化学试题江苏省姜堰中学、如东中学、沭阳如东中学2023届高三上学期三校第一次联考化学试题(已下线)模拟卷01-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)2024届四川省成都市成华区某校高三上学期一诊模拟考试理综试题(已下线)热点12 元素推断与元素周期律
名校
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态Y原子有3个未成对电子,基态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物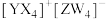 。下列叙述正确的是
。下列叙述正确的是
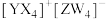 。下列叙述正确的是
。下列叙述正确的是A.氧化性: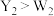 | B.电负性:Y>X>Z |
| C.Y的含氧酸一定是强酸 | D.第一电离能:Y<W |
您最近一年使用:0次
2023-12-30更新
|
479次组卷
|
2卷引用:河北省衡水市武强中学2023-2024学年高二上学期期末考试化学试题
解题方法
7 . 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型非金属元素到典型金属元素的完整过渡。回管下列问题:
(1)羟胺(NH2OH)的水溶液呈碱性,其碱性原理与氨水相似,同浓度两种溶液的碱性较强的是_____ (填“NH2OH”或“NH3”),原因是_____ 。
(2)氢键的形成对物质的密度、熔沸点、粘稠性等产生影响。市售82%磷酸是粘稠状的液体,黏度较大的原因是_____ 。
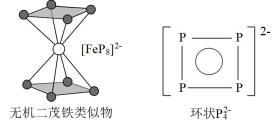
(3)南开大学某课题组成功合成无机二茂铁的类似物[FeP8]2-,结构如图所示,环状 结构与苯相似,
结构与苯相似, 中的大
中的大 键表示为
键表示为_____ 。(分子中的大π键可用 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)
(4)超盐晶体PH4AlBr4由超碱 和超卤素
和超卤素 组成。比较
组成。比较 与PH3键角大小:
与PH3键角大小:
_____ PH3(填“ ”、“<”或“=”),原因是
”、“<”或“=”),原因是_____ 。
(5)钼酸铋(Bi2MoO6)可用于光催化水的分解,其立方晶胞结构(未画出氧原子)如图所示,晶胞参数为a pm、a pm、c pm。
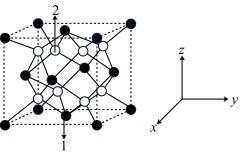
①若原子1的分数坐标为( ,
, ,0),原子2的分数坐标为
,0),原子2的分数坐标为_____ 。
②设NA为阿伏加德罗常数的值,Bi2MoO6的摩尔质量为M。Bi2MoO6晶体的密度为_____ g/cm3 (列计算式)。
(1)羟胺(NH2OH)的水溶液呈碱性,其碱性原理与氨水相似,同浓度两种溶液的碱性较强的是
(2)氢键的形成对物质的密度、熔沸点、粘稠性等产生影响。市售82%磷酸是粘稠状的液体,黏度较大的原因是
(3)南开大学某课题组成功合成无机二茂铁的类似物[FeP8]2-,结构如图所示,环状
 结构与苯相似,
结构与苯相似, 中的大
中的大 键表示为
键表示为 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)
(4)超盐晶体PH4AlBr4由超碱
 和超卤素
和超卤素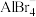 组成。比较
组成。比较 与PH3键角大小:
与PH3键角大小:
 ”、“<”或“=”),原因是
”、“<”或“=”),原因是(5)钼酸铋(Bi2MoO6)可用于光催化水的分解,其立方晶胞结构(未画出氧原子)如图所示,晶胞参数为a pm、a pm、c pm。

①若原子1的分数坐标为(
 ,
, ,0),原子2的分数坐标为
,0),原子2的分数坐标为②设NA为阿伏加德罗常数的值,Bi2MoO6的摩尔质量为M。Bi2MoO6晶体的密度为
您最近一年使用:0次
名校
解题方法
8 . 如图是元素周期表的一部分:
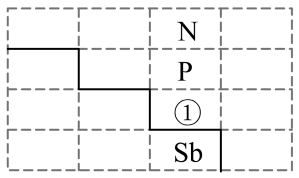
(1)磷原子核外有___________ 个未成对电子,最外层有___________ 种能量不同的电子。白磷在空气中露置时间长了会因温度达到着火点而自燃,使白磷升温的热量主要来自___________ 。
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是___________(填编号)。
(3)已知,氯胺NH2Cl熔点-66℃,NH4Cl熔点340℃,氯胺的电子式为___________ 。
(4)NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为___________ 。
(5)写出元素①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。该周期的某种元素基态原子的核外电子排布式为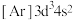 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为___________ 。
(6)基态锑(Sb)原子的价电子排布式为___________ 。

(1)磷原子核外有
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是___________(填编号)。
| A.NH3比PH3稳定性强 | B.Na3PO4溶液与HNO3反应生成H3PO4 |
| C.硝酸显强氧化性,磷酸不显强氧化性 | D.氮气常温是气体,磷单质是固体 |
(4)NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为
(5)写出元素①的元素符号
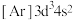 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为(6)基态锑(Sb)原子的价电子排布式为
您最近一年使用:0次
9 . 元素周期表中锑元素的数据如图。

(1)根据锑的价层电子排布式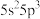 可知,锑在元素周期表中位于第
可知,锑在元素周期表中位于第_______ 周期第_______ 族。
(2)基态锑原子中有_______ 个未成对电子,这些未成对电子具有_______ (填“相同”或“不同”)的自旋状态。
(3)基态锑原子的5s轨道形状为_______ 形;该原子最外层电子占有_______ 个轨道。
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。
①下列推断正确的是_______ 。
a.电负性:Sb>Bi b.原子半径:Sb>Bi c.金属性:Sb>Bi d.氧化性: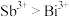
②第一电离能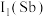
_______ (填“大于”或“小于”) 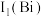 ,原因是
,原因是_______ 。

(1)根据锑的价层电子排布式
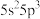 可知,锑在元素周期表中位于第
可知,锑在元素周期表中位于第(2)基态锑原子中有
(3)基态锑原子的5s轨道形状为
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。
①下列推断正确的是
a.电负性:Sb>Bi b.原子半径:Sb>Bi c.金属性:Sb>Bi d.氧化性:
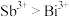
②第一电离能
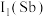
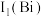 ,原因是
,原因是
您最近一年使用:0次
名校
10 . 下列说法错误的是
| A.不同状态的镁中失去最外层一个电子所需能量:[Ne]3s1<[Ne]3s2 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)只能在高温下自发进行,则该反应的△H>0 |
| C.已知氧化性:Fe2+<Ni2+<Cu2+,粗镍中含有Fe、Zn、Cu、Pt等杂质,则电解精炼镍时阳极泥中含有Cu和Pt |
D.室温下,0.1mol•L-1NH4CN溶液的pH=9.32,说明水解程度:CN->NH |
您最近一年使用:0次
2023-02-11更新
|
372次组卷
|
2卷引用:山东省济南市2022-2023学年高二下学期开学学情检测(期末考)化学试题



