1 . 回收钴废料能有效缓解金属资源浪费、环境污染等问题。一种以含钴催化剂废料(主要含Co、Fe,还含有少量的CoO、FeO、 、CaO、
、CaO、 )制备氧化钴(Co2O3)的工艺流程如下图所示:
)制备氧化钴(Co2O3)的工艺流程如下图所示:

已知:ⅰ.金属钴与铁具有相似的化学性质;
ⅱ.氧化性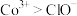 。
。
回答下列问题:
(1)酸浸后,“滤渣”的主要成分有_______ 和_______ (填化学式)。
(2)“除铁”时先加入NaClO溶液,主要反应的离子方程式为_______ ,再加入 溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
(3)基态钴原子的电子排布式为_______ 。
(4) 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为_______ 。 中除氢元素外,其他元素的第一电离能由大到小的顺序为
中除氢元素外,其他元素的第一电离能由大到小的顺序为_______ 。
(5)所得 可用于合成钛酸钴。一种钛酸钴的晶胞结构如图所示,该立方晶胞参数为a pm,每个Co周围等距且紧邻的O共有
可用于合成钛酸钴。一种钛酸钴的晶胞结构如图所示,该立方晶胞参数为a pm,每个Co周围等距且紧邻的O共有_______ 个。设NA为阿伏加德罗常数的值,该钛酸钴晶体的密度为_______  (列出计算式)。
(列出计算式)。

 、CaO、
、CaO、 )制备氧化钴(Co2O3)的工艺流程如下图所示:
)制备氧化钴(Co2O3)的工艺流程如下图所示:
已知:ⅰ.金属钴与铁具有相似的化学性质;
ⅱ.氧化性
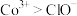 。
。回答下列问题:
(1)酸浸后,“滤渣”的主要成分有
(2)“除铁”时先加入NaClO溶液,主要反应的离子方程式为
 溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。(3)基态钴原子的电子排布式为
(4)
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为 中除氢元素外,其他元素的第一电离能由大到小的顺序为
中除氢元素外,其他元素的第一电离能由大到小的顺序为(5)所得
 可用于合成钛酸钴。一种钛酸钴的晶胞结构如图所示,该立方晶胞参数为a pm,每个Co周围等距且紧邻的O共有
可用于合成钛酸钴。一种钛酸钴的晶胞结构如图所示,该立方晶胞参数为a pm,每个Co周围等距且紧邻的O共有 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-09-13更新
|
344次组卷
|
3卷引用:福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题
福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题湖南省益阳市2022-2023学年高三上学期 9月质量检测化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(结构与性质)
名校
2 . M、W、X、Y、Z是原子序数依次增大的同周期主族元素,基态X原子2p能级上有2个未成对电子,Y元素原子的价电子数是W的两倍,由五种元素组成某电极材料的结构如图所示。下列说法错误的是
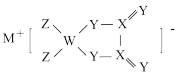
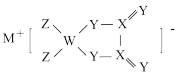
| A.电极材料的结构中存在配位键 | B.简单氢化物沸点:X<Y |
| C.第一电离能:W<X<Y | D.单质的氧化性:Z<Y |
您最近一年使用:0次
2023-01-15更新
|
1073次组卷
|
5卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题
3 . 过渡区金属元素原子或离子易形成配合物,广泛用作催化剂。例如Ni、Fe、Mo三种元素可以合成一种新型高效催化剂,在碱性条件下可展示出优异的OER(电催化析氧)催化活性。回答下列问题:
(1)电催化析氧过程中常用通NH3的方法来调节溶液酸碱性:
I.若溶液中有次氯酸盐,NH3有可能被氧化成NH2-NH2,NH2-NH2中N原子的杂化方式是_______ 。
II.若溶液中含有铜离子,可形成配离子[Cu(NH3)4]2+。
①[Cu(NH3)4]2+具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_______ 。
②Cu2+还可与其他微粒形成配离子,如与乙二胺形成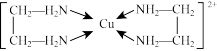 ,此配离子内部不含有的化学键类型是
,此配离子内部不含有的化学键类型是_______ (填标号)。
A.离子键 B.非极性键 C.配位键 D.氢键
③上述乙二胺和三甲胺[N(CH3)3]均属于胺。但乙二胺比三甲胺的沸点高很多,原因是_______ 。
(2)下列状态的铁中,失去最外层的一个电子所需能量最大的是_______(填标号)。
(3)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,是获得高纯度纳米镍的原料,推测Ni(CO)4属于_______ (填“极性”或“非极性”)分子。
(4)立方NiO(氧化镍)晶体的晶胞结构如图所示,晶胞边长为apm,则NiO晶体的密度为_______ g/cm3(NA表示阿伏加德罗常数)。

(1)电催化析氧过程中常用通NH3的方法来调节溶液酸碱性:
I.若溶液中有次氯酸盐,NH3有可能被氧化成NH2-NH2,NH2-NH2中N原子的杂化方式是
II.若溶液中含有铜离子,可形成配离子[Cu(NH3)4]2+。
①[Cu(NH3)4]2+具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
②Cu2+还可与其他微粒形成配离子,如与乙二胺形成
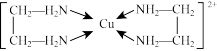 ,此配离子内部不含有的化学键类型是
,此配离子内部不含有的化学键类型是A.离子键 B.非极性键 C.配位键 D.氢键
③上述乙二胺和三甲胺[N(CH3)3]均属于胺。但乙二胺比三甲胺的沸点高很多,原因是
(2)下列状态的铁中,失去最外层的一个电子所需能量最大的是_______(填标号)。
A. | B.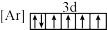 |
C.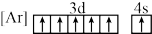 | D.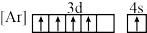 |
(4)立方NiO(氧化镍)晶体的晶胞结构如图所示,晶胞边长为apm,则NiO晶体的密度为

您最近一年使用:0次
解题方法
4 . 镍因其优异的性能广泛应用于军工制造和汽车电池领域,是一种战略资源,与镍有关的信息如下:
Ⅰ.芒德法提炼镍过程(杂质末标出):

Ⅱ.二价镍的检验和分离(Y为红色沉淀):

Ⅲ.碱性爱迪生镍铁电池工作原理: ,据此回答下列问题:
,据此回答下列问题:
(1)基态镍原子的价层电子排布式为_______ 。
(2)Ⅰ中产生的“烟气”可用氯化铁溶液吸收,请写出该吸收反应的离子方程式:_______ 。
(3)沸点为43℃的 属于
属于_______ (填晶体类型)晶体; 中含有σ键数为
中含有σ键数为_______ 。
(4)Ⅱ用到的丁二酮肟(X)中氮原子的价层电子对数为_______ ;Y分子内存在的相互作用为_______ ;Y中配体用氮原子而不用氧原子配位的原因是_______ 。
(5)Ⅲ中爱迪生电池放电时正极的电极反应式为_______ 。
(6)用于古币制造的一种铜镍合金(白铜)晶胞如图,该物质的化学式为_______ ;元素铜与镍的第二电离能分别为: ,
, ,
, 的原因是
的原因是_______ 。

Ⅰ.芒德法提炼镍过程(杂质末标出):

Ⅱ.二价镍的检验和分离(Y为红色沉淀):

Ⅲ.碱性爱迪生镍铁电池工作原理:
 ,据此回答下列问题:
,据此回答下列问题:(1)基态镍原子的价层电子排布式为
(2)Ⅰ中产生的“烟气”可用氯化铁溶液吸收,请写出该吸收反应的离子方程式:
(3)沸点为43℃的
 属于
属于 中含有σ键数为
中含有σ键数为(4)Ⅱ用到的丁二酮肟(X)中氮原子的价层电子对数为
(5)Ⅲ中爱迪生电池放电时正极的电极反应式为
(6)用于古币制造的一种铜镍合金(白铜)晶胞如图,该物质的化学式为
 ,
, ,
, 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
5 . 下列原因分析能正确解释性质差异的是
| 选项 | 性质差异 | 原因分析 |
| A | 碱性: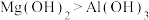 | 第一电离能:Mg>Al |
| B | 沸点: | 键能:H—N>H—P |
| C | 水溶性:丙三醇大于乙醇 | 丙三醇的相对分子质量大于乙醇 |
| D | 酸性: | 电负性氯大于氢,导致 中O—H键极性较大 中O—H键极性较大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-10更新
|
89次组卷
|
2卷引用:安徽省合肥市肥西县2022-2023学年高二下学期期末考试化学试题
名校
解题方法
6 . 如图所示为元素周期表的一部分,其中的编号代表对应的元素。
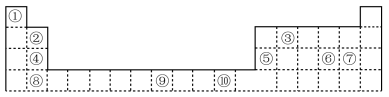
完成下列填空。
(1)表中属于d区的元素是_______ (填编号);④⑤⑥⑦⑧五种元素形成的稳定离子中,离子半径最小的是_______ (填离子符号)。
(2)表中元素③所形成的化合物种类最多,任意写出2种它与元素⑦组成的非极性分子的分子式_______ 。
(3)④⑤⑥三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。
(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是_______ (填化学式),碱性最强的是_______ (填化学式)。
(5)用原子结构的知识解释元素②、④的金属性强弱。______ 。

完成下列填空。
(1)表中属于d区的元素是
(2)表中元素③所形成的化合物种类最多,任意写出2种它与元素⑦组成的非极性分子的分子式
(3)④⑤⑥三种元素的第一电离能由大到小的顺序是
(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是
(5)用原子结构的知识解释元素②、④的金属性强弱。
您最近一年使用:0次
7 . 硫、氮的氧化物是造成大气污染的主要物质,研究他们的相互转化及脱除有重要意义。
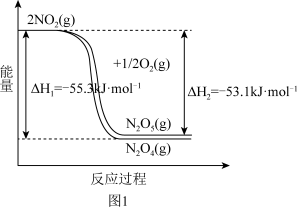
(1)25℃时,N2O5(g)在刚性反应器中发生分解得到N2O4(g)、NO2(g)和O2(g)。其中NO2二聚为N2O4的反应可以迅速达到平衡。N2O5(g)的初始压强为35.8kPa,某时刻,N2O5(g)完全分解,体系达到平衡,反应器总压强为63.1kPa。
①相关反应的能量变化如图1所示,N2O5(g)分解生成N2O4(g)和O2(g)的热化学方程式为___ 。
②25℃时,N2O4(g) 2NO2(g)反应的平衡常量Kp=
2NO2(g)反应的平衡常量Kp=___ kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强大于63.1kPa,原因是___ 。
(2)臭氧可用于脱硫脱硝,利用其强氧化性氧化氮氧化物及二氧化硫。
①O3分子的空间结构与水分子的相似,O3是___ (填“极性”或“非极性”)分子。
②用O3氧化NO2时,使用催化剂可提高氧化效率.研究发现NO2在某催化剂表面被O3氧化时反应机理如图2所示,反应过程中,[M]与NO2按物质的量之比1∶1反应生成N2O5。该催化氧化过程总反应的化学方程式为___ 。

③一定温度下,向一定比例的O3和NO混合物中通入一定浓度的SO2气体,同时进行脱硫脱硝实验。实验结果如图3所示。由图可知SO2对NO的氧化率影响很小,下列选项中能解释该结果的是___ (填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比等物质的量的O3与SO2反应的多
上述脱硫脱硝过程中涉及元素的第一电离能由大到小的顺序是___ (填元素符号)。
(1)25℃时,N2O5(g)在刚性反应器中发生分解得到N2O4(g)、NO2(g)和O2(g)。其中NO2二聚为N2O4的反应可以迅速达到平衡。N2O5(g)的初始压强为35.8kPa,某时刻,N2O5(g)完全分解,体系达到平衡,反应器总压强为63.1kPa。
①相关反应的能量变化如图1所示,N2O5(g)分解生成N2O4(g)和O2(g)的热化学方程式为
②25℃时,N2O4(g)
 2NO2(g)反应的平衡常量Kp=
2NO2(g)反应的平衡常量Kp=③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强大于63.1kPa,原因是

(2)臭氧可用于脱硫脱硝,利用其强氧化性氧化氮氧化物及二氧化硫。
①O3分子的空间结构与水分子的相似,O3是
②用O3氧化NO2时,使用催化剂可提高氧化效率.研究发现NO2在某催化剂表面被O3氧化时反应机理如图2所示,反应过程中,[M]与NO2按物质的量之比1∶1反应生成N2O5。该催化氧化过程总反应的化学方程式为

③一定温度下,向一定比例的O3和NO混合物中通入一定浓度的SO2气体,同时进行脱硫脱硝实验。实验结果如图3所示。由图可知SO2对NO的氧化率影响很小,下列选项中能解释该结果的是
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比等物质的量的O3与SO2反应的多
上述脱硫脱硝过程中涉及元素的第一电离能由大到小的顺序是
您最近一年使用:0次
解题方法
8 . 下列叙述正确的是
| A.每一周期元素都是从碱金属开始,以稀有气体结束 |
| B.f区都是副族元素,s区和p区的都是主族元素 |
| C.已知在20℃1molNa失去1mol电子需吸收650kJ能量,则其第一电离能为650kJ/mol。 |
| D.酸性HClO4>H2SO4,碱性:NaOH>Mg(OH)2 |
您最近一年使用:0次
9 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是
| A.第一电离能:W>X>Y>Z | B.简单离子的还原性:Y>X>W |
| C.简单离子的半径:W>X>Y>Z | D.氢化物水溶液的酸性:Y>W |
您最近一年使用:0次
2020-07-11更新
|
10784次组卷
|
51卷引用:浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题
浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题山东省曹县博雅中学2022-2023学年高二上学期期末考试化学试题2020年山东省高考化学试卷(新高考)(已下线)专题06 物质结构 元素周期律-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题安徽省六安市城南中学2021届高三上学期第一次月考化学试题四川绵阳南山中学双语学校2020-2021学年高二上学期10月月考化学试题辽宁省大连市沙河口区辽宁师范大学附属中学2021届高三上学期10月模块考试化学试题湖北省随州市第一中学2021届高三11月月考化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)河北省石家庄市第二十四中学2021届高三上学期月考化学试卷(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区高二选择性必修2(人教版2019)第一章 原子结构与性质 第一章素养检测(已下线)热点4 物质结构与性质(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)第1章 原子结构与元素性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)(已下线)热点6 物质结构与元素周期律-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记(已下线)重点6 物质结构与元素周期律-2021年高考化学【热点·重点·难点】专练(山东专用)山东省夏津第一中学2020-2021学年高二下学期3月月考化学试题福建省南平市浦城县2020-2021学年高二下学期第一次月考化学试题山东省莘州中学2020-2021学年高二下学期第一次月考化学试题(已下线)押山东卷第03题 元素周期律、元素周期表-备战2021年高考化学临考题号押题(山东卷)河北省河间市第十四中学2020-2021学年高二下学期期中考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】江苏省扬州市扬州中学2022届高三开学考试化学试题江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)(已下线)2020年山东卷化学高考真题变式题1-10(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)专题2 原子结构与元素性质 ★第二单元综合拔高练(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高三上学期第一次月考化学试题 江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题(已下线)专题07 元素周期律与元素周期表(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)山西省太原师范附属中学、太原市师苑中学校2022-2023学年高二下学期第一次月考化学(理)试题北京市第二中学2022-2023学年高二下学期3月月考化学试题湖北省武汉市新洲区部分学校2022-2023学年高二下学期期中考试化学试题陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题(已下线)专题07 元素周期表与元素周期律2.2.2元素第一电离能和电负性的周期性变化 课后福建省永春第一中学2022-2023学年高二下学期6月月考化学试题甘肃省陇南市等3地2022-2023学年高三上学期11月期中考试化学试题甘肃省会宁县第四中学2023-2024学年高二下学期第一次月考化学试卷
名校
解题方法
10 . 根据表中五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列问题:
(1)在周期表中,最可能处于同一族的是_______ (填序号,下同)。
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是______
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是_____
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是_______ 区元素,其氯化物的化学式为_______ 。
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外_______ ,如果U元素是短周期的元素,你估计它的第二次电离能飞跃数据将是第_______ 个。
(6)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是_______ ,其中元素_______ 的第一电离能反常高的原因是_______ 。
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外
(6)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是
您最近一年使用:0次



