名校
1 . 现有A、B、C、D四种元素,A是第五周期第ⅣA族元素,B是第三周期元素,B、C、D的价电子数分别为2、2、7。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子数均为18个。
(1)写出A、B、C、D的元素符号:A________ 、B________ 、C________ 、D________ 。
(2)C位于元素周期表的________ 区,C2+的电子排布式______________________________ 。
(3)最高价氧化物对应水化物中碱性最强的化合物是________ (写化学式,下同);最高价氧化物对应水化物中酸性最强的化合物是________ 。
(4)元素的第一电离能最小的是________ ,元素的电负性最大的是________ 。
(1)写出A、B、C、D的元素符号:A
(2)C位于元素周期表的
(3)最高价氧化物对应水化物中碱性最强的化合物是
(4)元素的第一电离能最小的是
您最近一年使用:0次
2019-07-22更新
|
316次组卷
|
10卷引用:云南省丘北二中2018-2019学年高二下学期期末考试化学试题
云南省丘北二中2018-2019学年高二下学期期末考试化学试题云南省富宁县三中2019-2020学年高二上学期期末考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题(已下线)2019年11月23日 周末培优-学易试题君之每日一题君2020年高考化学一轮复习云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题云南省禄丰县民族中学2019-2020学年高二12月月考化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题云南省施甸县第三中学2019-2020学年高二12月月考化学试题安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题
名校
2 . A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D 同主族,A原子M层电子数是L层的一半,B是同周期第一电离能最小的元素,C在同周期中未成对电子数最多,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的名称:A_____ ,B_____ , C_____ , D______ 。
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是(用化学式表示,下同)_________ ,碱性最强的是________ 。
(3)D所在周期第一电离能最小的元素是_____ ,电负性最大的元素是_____ 。(填元素符号)
(4)D的氢化物比C的氢化物的沸点_____ (填“高”或“低”),原因是_____________________ 。
(5)E元素原子的核电荷数是_____ ,E元素在周期表的位置是_______________ , E元素处于周期表分区中的______ 区。
(6)A、C最高价氧化物的晶体类型是分别是:_______ 晶体、_______ 晶体。
(7)画出D的核外电子排布图_____________________ ,D的原子结构示意图_________ 。
(8)用电子式表示B的硫化物的形成过程:______________________________ 。
(1)写出下列元素的名称:A
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是(用化学式表示,下同)
(3)D所在周期第一电离能最小的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、C最高价氧化物的晶体类型是分别是:
(7)画出D的核外电子排布图
(8)用电子式表示B的硫化物的形成过程:
您最近一年使用:0次
9-10高二下·黑龙江鹤岗·期末
解题方法
3 . 下列说法正确的有____________ 。
(1)每一周期元素都是从碱金属开始,以稀有气体结束
(2)f区都是副族元素,s区和p区的都是主族元素
(3)铝的第一电离能大于K的第一电离能
(4)B电负性和Si相近
(5)Ge的电负性为1.8,则其是典型的非金属
(6)半径:K+>Cl—
(7)酸性 HClO>H2SO4,碱性:NaOH > Mg(OH)2
(8)元素的最高正化合价=其最外层电子数=族序数
(1)每一周期元素都是从碱金属开始,以稀有气体结束
(2)f区都是副族元素,s区和p区的都是主族元素
(3)铝的第一电离能大于K的第一电离能
(4)B电负性和Si相近
(5)Ge的电负性为1.8,则其是典型的非金属
(6)半径:K+>Cl—
(7)酸性 HClO>H2SO4,碱性:NaOH > Mg(OH)2
(8)元素的最高正化合价=其最外层电子数=族序数
您最近一年使用:0次
4 . 黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义,一种酸性条件下催化氧化黄铁矿的物质转化关系如图所示,回答下列问题:
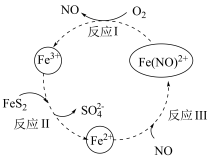
(1)基态氮原子的价层电子排布式为____________ 。
(2)基态氧原子的核外电子有________ 种空间运动状态,其电子占据的最高能级的电子云轮廓图为____ 形。
(3)第一电离能:N________ (填“>”“<”或“=”)O。
(4)反应Ⅱ的离子方程式为____________________ ,Fe3+的半径比Fe2+________ (填“大”或“小”),Fe3+的稳定性比Fe2+更________ (填“强”或“弱”)。

(1)基态氮原子的价层电子排布式为
(2)基态氧原子的核外电子有
(3)第一电离能:N
(4)反应Ⅱ的离子方程式为
您最近一年使用:0次
名校
5 . I.铁镁合金是一种性能优异的储氢材料。关于铁镁两种元素,请回答下列问题:
(1)同周期元素中,第一电离能小于镁的元素有_______ 种。
(2)基态Fe原子的简化电子排布式为_______ ,空间运动状态有_______ 种,Fe位于元周期表的_______ 区,基态原子的电子有_______ 种伸展方向。
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有_______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.[Ar] b.[Ar]
b.[Ar]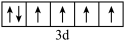
c.[Ar] d.[Ar]
d.[Ar]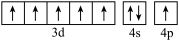
(4)试从结构角度解释 易被氧化为
易被氧化为
_______ 。
(5)对于呋喃: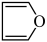 和吡咯:
和吡咯: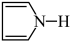 )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是_______ ,最小的是_______ ;第一电离能最大的是_______ 。
Ⅱ. 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:
(6) 可做净水剂,其理由是
可做净水剂,其理由是_______ (用离子方程式表示)。
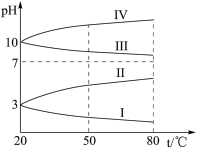
(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L 溶液的是
溶液的是_______ (填罗马数字)。
(8)20℃时,0.1mol/L 溶液中,
溶液中, =
=_______ mol/L(写出准确数值)。
Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为: (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
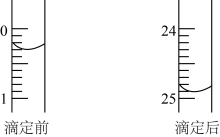
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_______ mL。
(10)此滴定实验达到终点的颜色变化为_______ 。
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
计算上述样品中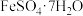 的质量分数为
的质量分数为_______ 。( ,小数点后保留一位)
,小数点后保留一位)
(12)若滴定前平视读数,滴定终点时仰视读数,则所测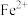 含量:
含量:_______ 。(填“无影响”、“偏高”或“偏低”)。
(1)同周期元素中,第一电离能小于镁的元素有
(2)基态Fe原子的简化电子排布式为
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
a.[Ar]
 b.[Ar]
b.[Ar]
c.[Ar]
 d.[Ar]
d.[Ar]
(4)试从结构角度解释
 易被氧化为
易被氧化为
(5)对于呋喃:
 和吡咯:
和吡咯: )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是Ⅱ.
 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:(6)
 可做净水剂,其理由是
可做净水剂,其理由是(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L
 溶液的是
溶液的是

(8)20℃时,0.1mol/L
 溶液中,
溶液中, =
=Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为:
 (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为
(10)此滴定实验达到终点的颜色变化为
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(KMnO4溶液)/mL | 17.10 | 19.98 | 20.00 | 20.02 |
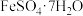 的质量分数为
的质量分数为 ,小数点后保留一位)
,小数点后保留一位)(12)若滴定前平视读数,滴定终点时仰视读数,则所测
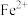 含量:
含量:
您最近一年使用:0次
解题方法
6 . 原子结构与性质
(1)元素As与N同族。As的氢化物沸点比NH3的___ (填“高”或“低”),其判断理由是___ 。
(2)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:___ 。与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系是___ 。某同学所画基态镁原子的核外电子排布图如图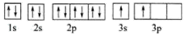 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了___ 。
(3)K元素处于元素周期表的___ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有___ 个。
(4)甲醛HCHO分子空间构型为___ ;分子中碳原子轨道杂化类型为___ ,π键和σ键的个数之比为___ 。
(5)从原子结构角度解释H2SO4酸性强于H3PO4的原因:___ 。
(6)含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO-,然后在酸性条件下将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒分子或离子(写一种)___ 。
(1)元素As与N同族。As的氢化物沸点比NH3的
(2)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(3)K元素处于元素周期表的
(4)甲醛HCHO分子空间构型为
(5)从原子结构角度解释H2SO4酸性强于H3PO4的原因:
(6)含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO-,然后在酸性条件下将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒分子或离子(写一种)
您最近一年使用:0次
解题方法
7 . M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)写出M原子的外围电子排布式_____ 。
(2)画出Y的负一价离子的电子式_____ ,元素Y的含氧酸中,酸性最强的是_____ (写化学式)。
(3)Y的同周期元素中,第一电离能最大的是______ (写元素符号);同周期主族元素从左到右,原子半径逐渐______ ,原因是______ 。
(4)M与Y形成的一种化合物MY,该化合物难溶于水但易溶于氨水,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______ 。
(1)写出M原子的外围电子排布式
(2)画出Y的负一价离子的电子式
(3)Y的同周期元素中,第一电离能最大的是
(4)M与Y形成的一种化合物MY,该化合物难溶于水但易溶于氨水,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为
您最近一年使用:0次
8 . A、B、C、D、E、F六种常见元素且原子序数依次增大:A元素的一种原子的原子核内没有中子,B的基态原子2p轨道中有三个未成对电子,C是所有元素中电负性最大的元素,D是短周期且最外层只有一个未成对电子的非金属元素,E是主族元素且与F同周期,其最外能层上有两个运动状态不同的电子,F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。请回答下列问题:
(1)写出F元素原子基态时价层的电子排布式___
(2)B元素的第一电离能比氧元素的第一电离___ (填“大”或“小”),原因是____
(3)C元素与A元素形成的最简单氢化物比D元素与A元素形成的氢化物沸点高,原因是____ 。
(4)与E元素同周期且未成对电子数最多的元素的价层电子排布图___ 。
(5)A、B、F三种元素可形成[F(BA3)4]2+配离子,其中存在的化学键类型有____ (填字母)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[F(BA3)4]2+配离子具有对称的空间构型, 且当[F(BA3)4]2+中的两个BA3被两个Br-取代时,能得到两种不同结构的产物,则[F(BA3)4]2+的空间构型为___ (填字母)。
a.平面正方形 b.正四面体形 c.三角锥形 d.V形
(6)D元素形成四种常见的含氧酸酸性由小到大的顺序___ ,且原因是___
(7)C和E能够形成化合物M,其晶胞结构如图所示,晶胞参数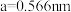 ,求晶体M的密度(
,求晶体M的密度( )
)____ 。(只列表达式即可)

(1)写出F元素原子基态时价层的电子排布式
(2)B元素的第一电离能比氧元素的第一电离
(3)C元素与A元素形成的最简单氢化物比D元素与A元素形成的氢化物沸点高,原因是
(4)与E元素同周期且未成对电子数最多的元素的价层电子排布图
(5)A、B、F三种元素可形成[F(BA3)4]2+配离子,其中存在的化学键类型有
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[F(BA3)4]2+配离子具有对称的空间构型, 且当[F(BA3)4]2+中的两个BA3被两个Br-取代时,能得到两种不同结构的产物,则[F(BA3)4]2+的空间构型为
a.平面正方形 b.正四面体形 c.三角锥形 d.V形
(6)D元素形成四种常见的含氧酸酸性由小到大的顺序
(7)C和E能够形成化合物M,其晶胞结构如图所示,晶胞参数
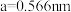 ,求晶体M的密度(
,求晶体M的密度( )
)
您最近一年使用:0次
9-10高二下·吉林·期中
9 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: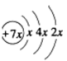 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A_________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________ ,碱性最强的是_________ 。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(4)D的氢化物比C的氢化物的沸点__________ (填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________ ,E元素在周期表的第_______ 周期,第________ 族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区。
(6)A、B、C最高价氧化物的晶体类型是分别是______ 晶体、______ 晶体、_____ 晶体。
(7)画出D的核外电子排布图_____________________ ,这样排布遵循了_______ 规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
(8)用电子式表示B的硫化物的形成过程:
您最近一年使用:0次



