名校
1 . 短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )

| A.Y、Z、W三种元素电负性:W>Z>Y |
| B.Y、Z、W三种元素的第一电离能:W>Z>Y |
| C.Y、Z、W与氢元素均可形成含非极性键的二元化合物 |
| D.由X、Y、Z、W构成的化合物中可能含有离子键 |
您最近一年使用:0次
2020-11-25更新
|
492次组卷
|
5卷引用:山东省济宁市第一中学2022-2023学年高二上学期期末检测化学试题
名校
解题方法
2 . H、C、N、O是常见的非金属元素;Fe、Co、Ni是三种重要的金属元素。回答下列有关它们单质或化合物的问题:
(1)Fe、Co、Ni在周期表中的位置为_______ ,基态Fe原子的价电子排布式为_______ 。
(2)C、N、O、Fe的第一电离能由大到小的顺序为________ ,C、N、O最简单氢化物的沸点由高到低的顺序为____ 。
(3)C2H2分子中空间构型为____ ,N2H4分子中心原子的杂化方式为_____ 。
(4)Fe、Co、Ni能与C12反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为_______ ,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:_____________________ 。
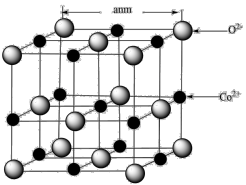
(5)CoO的面心立方晶胞如图所示。三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______ 。设阿伏加 德罗常数的值为NA,则CoO晶体的密度为______ g∙cm-3。
(1)Fe、Co、Ni在周期表中的位置为
(2)C、N、O、Fe的第一电离能由大到小的顺序为
(3)C2H2分子中空间构型为
(4)Fe、Co、Ni能与C12反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
(5)CoO的面心立方晶胞如图所示。三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为

您最近一年使用:0次
名校
解题方法
3 . 短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )


| A.Y、Z、W三种元素电负性:W>Z>Y |
| B.Y、Z、W三种元素第一电离能:Z>W>Y |
| C.L的沸点一定比X、Y组成的化合物沸点高 |
| D.由X、Y、Z、W构成的化合物中只能含有共价键 |
您最近一年使用:0次
2020-06-24更新
|
555次组卷
|
6卷引用:山东省德州市宁津县第一中学2019-2020学年高二下学期期末考试化学试题
4 . 青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________ 。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________ I1(Ne)填"〉”或“<")。
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____ ,硫酸的结构式为_____ 。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________ ,影响△H2递变的因素为________ 。
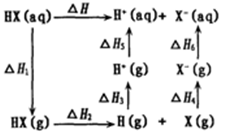
(1)在周期表中,与Si的化学性质最相似的邻族元素是
(2) Na+和 Ne互为等电子体,电离能 I2(Na)
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为
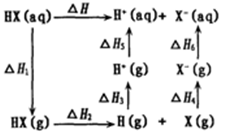
您最近一年使用:0次
解题方法
5 . 下列“最值”描述情况正确的是
| A.第二周期所有元素的第一电离能:最大的是F,最小的是 Li |
| B.第三周期主族元素离子半径:最大的是Clˉ,最小的是Al3+ |
| C.第三周期元素最高价氧化物的水化物:酸性最强的是HClO,碱性最强的是 NaOH |
| D.第VIA族元素的最简单氢化物的沸点,最高的是H2O,最低的是H2S |
您最近一年使用:0次
解题方法
6 . 短周期元素A、B、C、D、E的原子序数依次增大,其最外层电子数与原子半径的大小关系如图所示,请按要求回答下列问题:
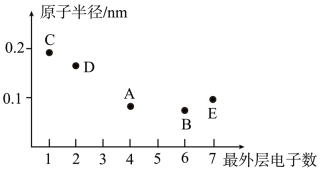
(1)基态E原子中有______ 种不同能量的电子,其中能量最高的电子所占据能级的电子云轮廓图呈______ 形。
(2)五种元素中,非金属元素第一电离能最小的是______ (填元素符号),非金属元素形成的最高价含氧酸的酸性最强的是______ (填化学式)。
(3)五种元素中,金属元素的金属性最强的是______ (填元素符号),设计一个简单的实验,证明金属元素金属性的强弱,简述实验步骤和现象:______ 。
(4)欲鉴定月球上是否有A元素的存在,可以通过______ 的方法。

(1)基态E原子中有
(2)五种元素中,非金属元素第一电离能最小的是
(3)五种元素中,金属元素的金属性最强的是
(4)欲鉴定月球上是否有A元素的存在,可以通过
您最近一年使用:0次
9-10高二下·吉林·期末
名校
7 . 下列四种元素中,其单质氧化性最强的是
| A.原子含有未成对电子最多的第2周期元素 |
| B.位于周期表第3周期ⅢA族的元素 |
| C.原子最外电子层排布式为3s23p5的元素 |
| D.原子最外电子层排布式为2s22p6的元素 |
您最近一年使用:0次
2019-03-16更新
|
516次组卷
|
21卷引用:吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷
(已下线)吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷甘肃省武威市第十八中学2019-2020学年高二下学期期末考试化学试题(已下线)2010—2011学年吉林省吉林一中高二下学期第一次月考化学试卷(已下线)2014年高二鲁科选修3化学训练1.2.2核外电子排布元素周期表练习卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2016-2017学年甘肃省武威市第十八中学高二下学期第一次月考化学试卷2016-2017学年河南省郑州市第一中学高二下学期期中考试化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第1课时福建省三明市第一中学2017-2018学年高二下学期开学考试化学试题云南省新平县一中2018-2019学年高二上学期12月考试化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二下学期开学考试化学试题内蒙古包头市第四中学2018-2019学年高二下学期第一次月考(3月)化学试题四川省平昌县驷马中学2020-2021学年高二上学期10月月考化学试题四川省南充市川绵外国语学校2020-2021学年高二上学期学期中考试化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第2节 原子结构与元素周期表(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)第1章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第1课时 原子核外电子排布的周期性2.2.1原子核外电子排布的周期性 课中1.3.1原子半径及其变化规律(课前)-鲁科版选择性必修2(已下线)第一章章节专项提升
名校
解题方法
8 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号 : B__________ ,C __________ 。
(2)用化学式 表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________ ,碱性最强的是_________ 。
(3)用元素符号 表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(4)E元素的正三价离子的电子排布式为____________________________________ 。
(5)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式____________________ 。
(6)画出D的核外电子排布图 ___________________________________________ ,这样排布遵循了____________ 原理和____________ 规则。
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)写出下列元素的
(2)用
(3)用
(4)E元素的正三价离子的电子排布式为
(5)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式
(6)画出D的核外
您最近一年使用:0次
9 . 请回答以下问题:
(1)在常温下,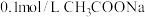 溶液的
溶液的 ,则溶液中由水电离出来的
,则溶液中由水电离出来的
___________ 。
(2)火箭发射可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。
已知: ,
,
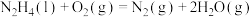 ,
,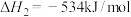
请写出 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(3)常压下,物质的汽化热(液体在恒温下转化为气体时所吸收的热量)见下表:
 汽化热特别大的原因是
汽化热特别大的原因是___________ 。
(4)下表列出了某短周期元素R的各级电离能数据(用 、
、 ……表示)。
……表示)。
关于元素R的下列推断中,正确的是___________ (用相应的编号填写)
①R元素基态原子的电子排布式为
②R元素位于元素周期表中第ⅡA族
③R元素的最高正化合价为 价
价
④R元素的第一电离能高于同周期相邻元素的第一电离能
(5) 溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
已知:反应前后,溶液的比热容均近似为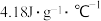 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。则反应放出的热量Q=
,忽略溶液体积、质量变化和金属吸收的热量。则反应放出的热量Q=___________ J。
(6)根据甲醇 在酸性电解质溶液中与氧气反应生成二氧化碳和水,设计了一种原电池,则该电池工作时,负极上反应的电极反应式为
在酸性电解质溶液中与氧气反应生成二氧化碳和水,设计了一种原电池,则该电池工作时,负极上反应的电极反应式为___________ 。
(1)在常温下,
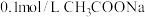 溶液的
溶液的 ,则溶液中由水电离出来的
,则溶液中由水电离出来的
(2)火箭发射可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。已知:
 ,
,
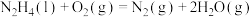 ,
,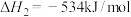
请写出
 与
与 反应的热化学方程式
反应的热化学方程式(3)常压下,物质的汽化热(液体在恒温下转化为气体时所吸收的热量)见下表:
 |  | Ne | |
汽化热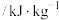 | 548 | 1369 | 105 |
 汽化热特别大的原因是
汽化热特别大的原因是(4)下表列出了某短周期元素R的各级电离能数据(用
 、
、 ……表示)。
……表示)。| 元素 | 电离能 | |||||
 |  |  |  | 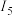 | … | |
| R | 740 | 1500 | 7700 | 10500 | 13630 | … |
关于元素R的下列推断中,正确的是
①R元素基态原子的电子排布式为

②R元素位于元素周期表中第ⅡA族
③R元素的最高正化合价为
 价
价④R元素的第一电离能高于同周期相邻元素的第一电离能
(5)
 溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。已知:反应前后,溶液的比热容均近似为
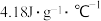 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。则反应放出的热量Q=
,忽略溶液体积、质量变化和金属吸收的热量。则反应放出的热量Q=(6)根据甲醇
 在酸性电解质溶液中与氧气反应生成二氧化碳和水,设计了一种原电池,则该电池工作时,负极上反应的电极反应式为
在酸性电解质溶液中与氧气反应生成二氧化碳和水,设计了一种原电池,则该电池工作时,负极上反应的电极反应式为
您最近一年使用:0次
解题方法
10 . 下表列出了a-g七种元素在周期表中的位置
请用化学用语回答下列问题:
(1)d、e元素常见离子的半径由大到小的顺序为_____ (用离子符号表示);f、g两元素分别与a元素形成的化合物中稳定性较强的是_____ (填化学式)。
(2)c、d元素第一电离能较大的是_____ (填元素符号)。
(3)b基态原子的轨道表示式为:_____ 。

(4)常温下,液态化合物fdg2与水剧烈反应,产生能使品红溶液褪色的fd2气体,向反应后的溶液中加入AgNO3溶液,有不溶于稀硝酸的白色沉淀析出。根据实验现象,写出fdg2与水反应的化学方程式_____ 。
(5)根据ba4在酸性电解质溶液中与d2生成bd2和a2d的反应,设计一种燃料电池。该电池工作时,负极上发生的反应为:_____ 。
| IA | 0 | |||||||
| 1 | a | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | b | c | d | |||||
| 3 | e | f | g |
(1)d、e元素常见离子的半径由大到小的顺序为
(2)c、d元素第一电离能较大的是
(3)b基态原子的轨道表示式为:

(4)常温下,液态化合物fdg2与水剧烈反应,产生能使品红溶液褪色的fd2气体,向反应后的溶液中加入AgNO3溶液,有不溶于稀硝酸的白色沉淀析出。根据实验现象,写出fdg2与水反应的化学方程式
(5)根据ba4在酸性电解质溶液中与d2生成bd2和a2d的反应,设计一种燃料电池。该电池工作时,负极上发生的反应为:
您最近一年使用:0次



