1 . (1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置___________ 。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质含有的化学键类型有___________ (填序号)。
a.离子键 b.极性键 c.非极性键 d.金属键e.配位键f.氢键
②基态铜原子的核外电子排布式为___________ 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:



①晶体Q中各种微粒间的作用力不涉及___________ (填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为___________ ,阴离子的中心原子轨道采用___________ 杂化。
(4)已知苯酚( )具有弱酸性,其Ka=1.1 ×10-10;水杨酸离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸离子 能形成分子内氢键。据此判断,相同温度下酸性强弱比较:水杨酸离子
能形成分子内氢键。据此判断,相同温度下酸性强弱比较:水杨酸离子___________ 苯酚(填“>”或“<”),其原因是___________ 。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2
 NF3+3NH4F
NF3+3NH4F①上述化学方程式中的5种物质含有的化学键类型有
a.离子键 b.极性键 c.非极性键 d.金属键e.配位键f.氢键
②基态铜原子的核外电子排布式为
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:



①晶体Q中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为
(4)已知苯酚(
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸离子 能形成分子内氢键。据此判断,相同温度下酸性强弱比较:水杨酸离子
能形成分子内氢键。据此判断,相同温度下酸性强弱比较:水杨酸离子
您最近一年使用:0次
名校
2 . 太阳能的开发利用在新能源研究中占据重要地位,单品硅太阳能电池片在加工时,一般掺杂微量的铜、铁、钴、硼、镓、硒等。其中某种重要的含铜的化合物结构如图。请回答下列问题:
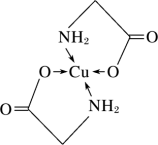
(1)铜位于周期表中___________ 区,最外层原子轨道呈___________ 形。
(2)基态二价铜离子的电子排布式为___________ ,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释___________ 。
(3)硼核外电子的运动状态的概率密度分布可用___________ 形象化描述。在基态硼原子中,核外存在___________ 个运动状态不同的电子。
(4)Fe3+的价电子排布图为___________ 。
(5)根据元素周期律,电负性O___________ Se(选填“大于”、“小于”、“等于”),N、O、Se三种元素中的第一电离能最大的为:___________ 。

(1)铜位于周期表中
(2)基态二价铜离子的电子排布式为
(3)硼核外电子的运动状态的概率密度分布可用
(4)Fe3+的价电子排布图为
(5)根据元素周期律,电负性O
您最近一年使用:0次
2021-04-15更新
|
536次组卷
|
2卷引用:四川省成都市新津中学高2020-2021学年高二下学期4月月考试题
21-22高三上·全国·阶段练习
名校
3 . 第四周期的元素砷(As)和镍(Ni)具有广泛的应用。回答下列问题:
(1)基态As原子的核外电子排布式为___________ ,As、Ni的第一电离能:I1(As)___________ I1(Ni)(填“大于”“小于”或“等于”)。
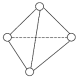
(2)砷单质的气态分子构型如图所示,在其中4条棱上各插入1个硫原子,形成As4S4,俗称雄黄,则雄黄可能有___________ 种不同的结构;0.5 mol As4S4中含有___________ mol As—S键。
(3)亚砷酸(H3AsO3)形成的盐可用作长效杀虫剂和除草剂, 的空间构型为
的空间构型为___________ ;磷和砷同主族,亚磷酸(H3PO3)中心原子磷配位数为4,则亚磷酸为___________ 元酸。
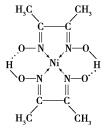
(4)一种Ni2+配合物的结构如图所示,该配合物中的配位数为___________ ,C原子的杂化方式为___________ 。
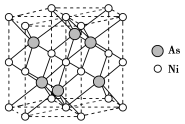
(5)As和Ni形成的一种晶体晶胞中原子堆积方式如图所示,晶体中As原子围成的空间构型为___________ (填 “三角形”“四面体”或“八面体”),图中六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数为NA,则该晶体的密度ρ=___________ g·cm−3。
(1)基态As原子的核外电子排布式为
(2)砷单质的气态分子构型如图所示,在其中4条棱上各插入1个硫原子,形成As4S4,俗称雄黄,则雄黄可能有

(3)亚砷酸(H3AsO3)形成的盐可用作长效杀虫剂和除草剂,
 的空间构型为
的空间构型为(4)一种Ni2+配合物的结构如图所示,该配合物中的配位数为

(5)As和Ni形成的一种晶体晶胞中原子堆积方式如图所示,晶体中As原子围成的空间构型为

您最近一年使用:0次
名校
4 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图如图,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:_______ 。
(2)用元素符号表示D所在周期第一电离能最大的元素是_______ ,电负性最大的元素是_______ 。
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区,已知E3+离子比E2+离子稳定,解释其原因_______ E元素原子的核电荷数是_______ ,E元素在周期表中位于第_______ 周期第_______ 族;
(4)已知D氢化物比C的氢化物沸点高,原因是_______ 。

(2)用元素符号表示D所在周期第一电离能最大的元素是
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在
(4)已知D氢化物比C的氢化物沸点高,原因是
您最近一年使用:0次
2021-04-12更新
|
84次组卷
|
2卷引用:吉林省长春市第二十九中学2020-2021学年高二下学期第一学程考试化学试题
名校
解题方法
5 . (1)短周期某主族元素,M的电离能情况如图A所示,则M在元素周期表的第_______ 族。

(2)如图B所示,每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ (写化学式)。a点所在折线元素氢化物的沸点变化规律如图B,呈现这种变化关系的原因是_______

(3)用氢键表示式写出氨水中NH3分子与水分子间可能存在的氢键_______ 。
(4)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系。
亚磷酸 (H3PO3) 也是中强酸,它的结构式为_______ ;亚磷酸 (H3PO3)为_______ 元酸。

(2)如图B所示,每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(3)用氢键表示式写出氨水中NH3分子与水分子间可能存在的氢键
(4)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系。
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
您最近一年使用:0次
2021-04-07更新
|
157次组卷
|
2卷引用:山西省太原市第五中学2020-2021学年高二下学期4月阶段性检测化学试题
6 . 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)镓是与铝同主族的第四周期元素,Ga基态原子核外电子排布式为__ 。
(2)Ga、As、Se的第一电离能由大到小的顺序是__ ,电负性由大到小的顺序是__ 。
(3)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是__ (填编号)。
a..CH4的稳定性比SiH4强
b.SiH4的沸点比CH4高
c.碳酸的酸性大于硅酸
d.SiO2+Na2CO3=Na2SiO3+CO2↑
(4)AsH3的沸点比NH3低;其原因是__ 。
(5)二水合草酸镓的结构如图所示,其中镓原子的配位数为__ ,二水合草酸镓π键的个数为__ ,草酸根离子中碳原子的杂化轨道类型为___ 。

(1)镓是与铝同主族的第四周期元素,Ga基态原子核外电子排布式为
(2)Ga、As、Se的第一电离能由大到小的顺序是
(3)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是
a..CH4的稳定性比SiH4强
b.SiH4的沸点比CH4高
c.碳酸的酸性大于硅酸
d.SiO2+Na2CO3=Na2SiO3+CO2↑
(4)AsH3的沸点比NH3低;其原因是
(5)二水合草酸镓的结构如图所示,其中镓原子的配位数为

您最近一年使用:0次
7 . 回答下列问题:
(1)与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是_______ 。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:_______ 。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子排布式:_______ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
| 元素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子排布式:
您最近一年使用:0次
名校
解题方法
8 . (1) 26Fe的简化电子排布式___________ 按电子排布式它属于___________ 区
(2)C、 N、O三种元素的第一电离能有大到小的排序为___________
(3)价电子排布式为3d54s2的原子,其原子结构示意图为___________
(4)指出配合物K3[Co(CN)6]中的配体___________
(5)判断BF3分子的立体构型、中心原子成键时采取的杂化轨道类型___________ 、___________
(2)C、 N、O三种元素的第一电离能有大到小的排序为
(3)价电子排布式为3d54s2的原子,其原子结构示意图为
(4)指出配合物K3[Co(CN)6]中的配体
(5)判断BF3分子的立体构型、中心原子成键时采取的杂化轨道类型
您最近一年使用:0次
2021高三·全国·专题练习
9 . (1)C、N、O、Al、Si、Cu是常见的六种元素。
①Si位于元素周期表第______ 周期第______ 族。
②N的基态原子核外电子排布式为______ ;Cu的基态原子最外层有______ 个电子。
③用“>”或“<”填空:
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是______ (填写元素符号)。
②基态锗(Ge)原子的电子排布式是______ 。Ge的最高价氯化物的分子式是______ 。
③Ge元素可能的性质或应用有______ 。
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
①Si位于元素周期表第
②N的基态原子核外电子排布式为
③用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al | N | 金刚石 | CH4 |
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/(kJ·mol-1) | 578 | 1817 | 2745 | 11578 | …… |
则该元素是
②基态锗(Ge)原子的电子排布式是
③Ge元素可能的性质或应用有
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
您最近一年使用:0次
20-21高二·全国·课时练习
10 . 不同元素的气态原子失去最外层一个电子所需要的最低能量I1如图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。

(1)同主族内不同元素原子的I1变化的特点是_________ ,各主族中I1的这种变化特点体现了元素性质的________ 变化规律。
(2)同周期内,随原子序数增大,I1增大。但个别元素的I1出现反常,试预测下列关系中正确的是________ (填序号)。
①I1(砷)>I1(硒) ②I1(砷)<I1(硒)
③I1(溴)>I1(硒) ④I1(溴)<I1(硒)
(3)第10号元素I1较大的原因是_____________________________
_____________________________________________________________ 。

(1)同主族内不同元素原子的I1变化的特点是
(2)同周期内,随原子序数增大,I1增大。但个别元素的I1出现反常,试预测下列关系中正确的是
①I1(砷)>I1(硒) ②I1(砷)<I1(硒)
③I1(溴)>I1(硒) ④I1(溴)<I1(硒)
(3)第10号元素I1较大的原因是
您最近一年使用:0次



