名校
解题方法
1 . 氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为__________ 。氧元素与氟元素能形成OF2分子,该分子的空间构型为__________ 。
(2)根据等电子体原理,在 中氮原子轨道杂化类型是
中氮原子轨道杂化类型是__________ ;1 mol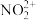 中含有的π键数目为
中含有的π键数目为__________ 个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________ 。
(4)下列物质的分子与O3分子的结构最相似的是__________ 。
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?__________ 。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为
(2)根据等电子体原理,在
 中氮原子轨道杂化类型是
中氮原子轨道杂化类型是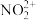 中含有的π键数目为
中含有的π键数目为(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为
(4)下列物质的分子与O3分子的结构最相似的是
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?
您最近一年使用:0次
2018-02-12更新
|
236次组卷
|
4卷引用:模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)
(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第二章 综合检测2山西省平遥中学校2018-2019学年高二下学期第二次月考化学试题
10-11高二下·吉林长春·期末
名校
解题方法
2 . 某元素的激发态原子的电子排布式为1s22s22p63s23p34s1,则该元素基态原子的电子排布式为____________ ;元素符号为________ ;其最高价氧化物对应的水化物的化学式是________ 。
您最近一年使用:0次
2018-02-11更新
|
106次组卷
|
3卷引用:河南省渑池高级中学2021-2022学年高二上学期期中考试化学试题
河南省渑池高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2010—2011学年吉林省长春外国语学校高二下学期期末考试化学试卷理宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1
3 . 填写下列空白[第(1)~(4)小题用元素符号填写]。
(1)第三周期原子半径最小的元素________ 。
(2)第一电离能最大的元素________ 。
(3)电负性最大的元素________ 。
(4)第四周期中第一电离能最小的元素________ 。
(5)含有8个质子,10个中子的原子的化学符号________ 。
(6)最外层电子排布为4s24p1的原子的核电荷数为________ 。
(7)周期表中最活泼的非金属元素原子的轨道表示式为___________________ 。
(8)某元素核外有三个电子层,最外层电子数是核外电子总数的 ,写出该元素原子的电子排布式是
,写出该元素原子的电子排布式是__________________ 。
(9)写出铜元素在周期表中的位置________________ ,它位于________ 区。
(1)第三周期原子半径最小的元素
(2)第一电离能最大的元素
(3)电负性最大的元素
(4)第四周期中第一电离能最小的元素
(5)含有8个质子,10个中子的原子的化学符号
(6)最外层电子排布为4s24p1的原子的核电荷数为
(7)周期表中最活泼的非金属元素原子的轨道表示式为
(8)某元素核外有三个电子层,最外层电子数是核外电子总数的
 ,写出该元素原子的电子排布式是
,写出该元素原子的电子排布式是(9)写出铜元素在周期表中的位置
您最近一年使用:0次
2017-06-09更新
|
516次组卷
|
6卷引用:模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)
(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷陕西省黄陵中学2016-2017学年高二(重点班)下学期第三学月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题江苏省苏州市2021-2022学年高二上学期期末模块测评化学试题陕西省西安市周至县第四中学2022-2023学年高二下学期期末考试化学试题
名校
4 . 硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____ ,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________ 。硫所在周期中,第一电离能最大的元素是___________ 。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________ 。
(3)H2S中S原子的杂化类型是__________ ;H2S的VSEPR模型名称为_________ ;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________ 。
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有________ 个配位键,___________ 个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________ 。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____ 个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____ cm。
(1)当基态原子的电子吸收能量后,电子会发生
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式
(3)H2S中S原子的杂化类型是
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为
您最近一年使用:0次
2017-05-10更新
|
1410次组卷
|
3卷引用:2021年高考全国甲卷化学试题变式题
名校
5 . 由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子占有的原子轨道数为______ 个,P、S、Cl的第一电离能由大到小顺序为_______ 。
(2)PCl3分子中的中心原子杂化轨道类型是______ ,该分子构型为_______ 。
(3)PH4Cl的电子式为______ ,Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为________ 。
⑷已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 Pm和 69 pm,则熔点:MgO___ NiO(填“>”、“<”或“=”),理由是______ 。
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______ 。
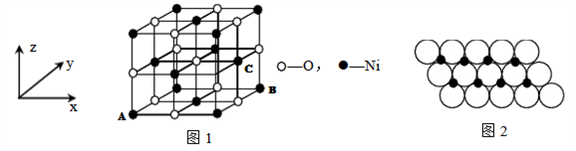
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为____ g。(用a、NA表示)
(1)基态Cl原子核外电子占有的原子轨道数为
(2)PCl3分子中的中心原子杂化轨道类型是
(3)PH4Cl的电子式为
⑷已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 Pm和 69 pm,则熔点:MgO
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为
您最近一年使用:0次
2017-04-07更新
|
396次组卷
|
3卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高三上学期第一次月考化学试题
名校
6 .
(1)17Cl的电子排布式___________ ;价层电子排布图_________ ;Cl-的电子排布式_______________ 。
(2)26Fe的电子排布式__________ ;26Fe2+ 电子排布式_________ ;26Fe3+电子排布式_____________ 。
(3)第三周期中,第一电离能最小的元素是_________ ,第一电离能最大的元素是_________ 。
(4)在元素周期表中,电负性最大的元素是_________ ,第二、三周期P 轨道半充满的元素是_________ 。
(1)17Cl的电子排布式
(2)26Fe的电子排布式
(3)第三周期中,第一电离能最小的元素是
(4)在元素周期表中,电负性最大的元素是
您最近一年使用:0次
7 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
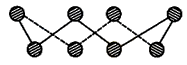
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______ ;_______________ ;
(3)Se原子序数为_______ ,其核外M层电子的排布式为___________________ ;
(4)H2Se的酸性比H2S_________ (填“强”或“弱”)。气态SeO3分子的立体构型为______________ ,SO32-离子的立体构型为___________________ ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_____________________________________ ;
② H2SeO4比 H2SeO3酸性强的原因:______________________________________________________________
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是
(3)Se原子序数为
(4)H2Se的酸性比H2S
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
② H2SeO4比 H2SeO3酸性强的原因:
您最近一年使用:0次
2016-12-09更新
|
587次组卷
|
3卷引用:山西省晋中市新一双语学校2020-2021学年高二下学期3月月考化学试题
8 . 五种元素的原子电子层结构如下:A.1s22s1;B.1s22s22p4;C.1s22s22p6;D.1s22s22p63s23p2;E.[Ar]3d104s1。(用元素符号作答)
(1)元素的第一电离能最大的是______________ ;
(2)属于过渡元素的是__________________ ;
(3)元素的电负性最大的是________________ ;
(4)上述元素之间能形成X2Y型化合物的化学式是__________ 、___________ 。
(1)元素的第一电离能最大的是
(2)属于过渡元素的是
(3)元素的电负性最大的是
(4)上述元素之间能形成X2Y型化合物的化学式是
您最近一年使用:0次
2016-12-08更新
|
406次组卷
|
4卷引用:(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 章末综合检测卷
(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 章末综合检测卷(已下线)2011-2012学年山西大同实验中学高二下学期期中考试化学试卷(已下线)2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题



