解题方法
1 . 按要求完成下列问题.
(1)写出基态Fe的电子排布式和Mg2+的电子排布图:__________ 、_________ .
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_______ 、________ 、_________ .
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:___________ 、___________ 、_____________ .
(4)CO2俗称干冰,CO2的分子中存在__________ 个σ键.在H-S、H-Cl两种共价键中,键的极性较强的是___________ ,键长较长的是___________ .
(5)向 溶液中加入过量
溶液中加入过量 溶液可生成
溶液可生成  。不考虑空间构型,
。不考虑空间构型,  的结构可用示意图表示为
的结构可用示意图表示为__________ 。
(1)写出基态Fe的电子排布式和Mg2+的电子排布图:
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:
(4)CO2俗称干冰,CO2的分子中存在
(5)向
 溶液中加入过量
溶液中加入过量 溶液可生成
溶液可生成  。不考虑空间构型,
。不考虑空间构型,  的结构可用示意图表示为
的结构可用示意图表示为
您最近一年使用:0次
解题方法
2 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____________ (填元素符号)。
(2)单质A有两种同素异形体,其中沸点高的是______ (填分子式),原因是___________ ;A和B的氢化物所属的晶体类型分别为______________ 和____________________ 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为__________ ,中心原子的杂化轨道类型为_____________ 。
(4)化合物D2A的立体构型为_________________ ,中心原子的价层电子对数为_________________
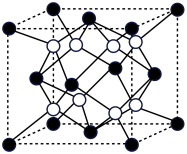
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为_____________ :晶胞中A 原子的配位数为__________ ;列式计算晶体F的密度(g.cm-3)____________ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为

您最近一年使用:0次
名校
3 . 根据价层电子对互斥理论及原子的杂化理论判断BF3分子的空间构型和中心原子的杂化方式为( )
| A.直线形 sp杂化 | B.三角形 sp2杂化 |
| C.三角锥形 sp2杂化 | D.三角锥形 sp3杂化 |
您最近一年使用:0次
2020-01-06更新
|
283次组卷
|
20卷引用:广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题
广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题(已下线)2014届四川省富顺一中高二上学期第一次月考化学试卷(已下线)2012-2013学年江苏省郑梁梅中学高二下学期期末考试化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第2章 分子结构与性质综合练习3宁夏吴忠市高二人教版选修3第2章 分子结构与性质综合练习2宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第2章 分子结构与性质综合练习1河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第2课时人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第2课时)云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题云南省西双版纳州民族中学2017-2018学年高二6月份考试化学试题贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题云南省元江哈尼族彝族傣族自治县一中2018-2019学年高二上学期12月考试化学试题河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题吉林省公主岭市范家屯镇第一中学2018-2019学年高二下学期期中考试化学试题云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题云南省普洱市景东县第二中学2019-2020学年高二上学期期末考试化学试题河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题四川省越西中学2019-2020学年高二5月月考化学试题



