1 . EDTA(乙二胺四乙酸)是一种重要的络合剂,结构简式如图所示。关于化合物[Cu(EDTA)]SO4的说法正确的是
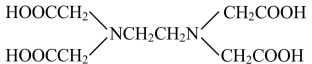
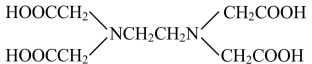
A.SO 与PO 与PO 互为等电子体,空间构型均为正四面体 互为等电子体,空间构型均为正四面体 |
| B.EDTA中碳原子的杂化轨道类型为sp、sp2、sp3 |
| C.EDTA组成元素的第一电离能顺序为O>N>C>H |
| D.[Cu(EDTA)]SO4中所含的化学键有离子键、共价键、配位键和氢键 |
您最近一年使用:0次
2021-01-24更新
|
410次组卷
|
7卷引用:山西省长治市第二中学校2020-2021学年高二上学期期末考试化学试题
山西省长治市第二中学校2020-2021学年高二上学期期末考试化学试题(已下线)2.2 分子的空间结构(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)辽宁省大连市第一中学 2021-2022学年高三上学期期中联考化学试题湖北省重点中学沃学联盟2021-2022学年高三上学期期中联考化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)湖北省蕲春县第一高级中学2022届高三5月第三次模拟考试化学试题辽宁省大连市普兰店区第一中学2022届高三上学期期中联考化学试题
2 . ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)基态氮原子的价电子排布图是___ ;基态砷原子的电子排布式为___ 。
(2)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是___ 。
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是___ 。
(4)Na3AsO4可作杀虫剂。AsO 的立体构型为
的立体构型为___ ,与其互为等电子体的一种分子为___ 。
(5)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为___ ,砷原子采取___ 杂化。
(6)GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与___ 个Ga相连。
(1)基态氮原子的价电子排布图是
(2)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是
(4)Na3AsO4可作杀虫剂。AsO
 的立体构型为
的立体构型为(5)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为

(6)GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与
您最近一年使用:0次
解题方法
3 . 氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____________ 方法区分晶体、准晶体和非晶体。
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为____________ 。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,写出一种与[H2F]+互为等电子体的阴离子是____________ 。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序____________ (填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为____________ 。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在____________ (填序号):
A.离子键 B. σ键 C.π键D.范德华力 E.配位键
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是____________ ;
②CuF的晶胞结构如图。F-填充在Cu+围成的____________ 空隙中,空隙填充率为____________ %。

(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在
A.离子键 B. σ键 C.π键D.范德华力 E.配位键
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是
②CuF的晶胞结构如图。F-填充在Cu+围成的

您最近一年使用:0次
名校
解题方法
4 . 已知P4单质的结构如下,P4在KOH溶液中的变化是:P4+3KOH+3H2O=3KH2PO2+PH3下列说法正确的是
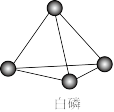

| A.产物PH3分子中所有的原子可能共平面 |
| B.31gP4含有1.5NA个P−P键 |
| C.相关元素的电负性大小顺序:P>O>H>K |
| D.P4中P原子为sp2杂化 |
您最近一年使用:0次
2020-08-21更新
|
283次组卷
|
7卷引用:山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题
解题方法
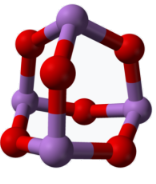
5 . 氧、钾、铬、碘的单质及其化合物在生产、生活中有广泛应用。
(1)上述四种基态原子中,未成对电子数最多的是_______ (填元素符号,下同)。最外层电子排布式相同的元素是_______ 。
(2)钾晶体的熔点______ (填“高于”或“低于”) 铬晶体的熔点。
(3)与IO 互为等电子体的分子有
互为等电子体的分子有_______ (写一种即可),IO 中碘原子的杂化轨道类型是
中碘原子的杂化轨道类型是________ 。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。氧、钾离子最近核间距为d cm,NA代表阿伏加 德罗常数的值。则KIO3晶胞的密度(ρ)为________ g•cm-3。

(1)上述四种基态原子中,未成对电子数最多的是
(2)钾晶体的熔点
(3)与IO
 互为等电子体的分子有
互为等电子体的分子有 中碘原子的杂化轨道类型是
中碘原子的杂化轨道类型是(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。氧、钾离子最近核间距为d cm,NA代表阿伏加 德罗常数的值。则KIO3晶胞的密度(ρ)为

您最近一年使用:0次
2020-08-21更新
|
79次组卷
|
2卷引用:山西省运城市2019-2020学年高二下学期期末测试化学试题
解题方法
6 . 有关雷酸(H—O—N C)和氰酸(H —O—C≡N)的说法错误的是
C)和氰酸(H —O—C≡N)的说法错误的是
 C)和氰酸(H —O—C≡N)的说法错误的是
C)和氰酸(H —O—C≡N)的说法错误的是| A.两者互为同分异构体 |
| B.元素电负性:O>N>C |
| C.物质中所含元素第一电离能:N>O>C |
| D.两种分子中的所有原子均在同一直线上 |
您最近一年使用:0次
2020-08-21更新
|
151次组卷
|
5卷引用:山西省运城市2019-2020学年高二下学期期末测试化学试题
解题方法
7 . 引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、含锌有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知交通污染是目前造成我国灰霾天气主要原因之一。
(1)Zn2+在基态时核外电子排布式为_________ 。
(2)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CH-CHO、HCOOH、CH3COOONO2(PAN)等二次污染物。
①N2O分子的立体构型为______ 。
②CH2=CH-CHO分子中碳原子的杂化方式为______
③1mol HCOOH 中含σ键数目为_____ 。
④NO 能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配体为______ ,Fe的化合价为_____ 。
(1)Zn2+在基态时核外电子排布式为
(2)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CH-CHO、HCOOH、CH3COOONO2(PAN)等二次污染物。
①N2O分子的立体构型为
②CH2=CH-CHO分子中碳原子的杂化方式为
③1mol HCOOH 中含σ键数目为
④NO 能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配体为
您最近一年使用:0次
2020-08-21更新
|
237次组卷
|
2卷引用:山西省运城市2019-2020学年高二下学期期末测试化学试题
8 . 钛很多重要的化合物。如TiO2、TiCl4、[Ti(OH)2(H2O)4]Cl2。如图为TiO2催化下,O3降解CH3CHO的示意图。回答下列问题:

(1)基态Ti原子的价层电子排布式为________ 。
(2)1molCH3CHO中含有的σ键的数目为_________ (设阿伏加 德罗常数的值为NA),碳原子的杂化方式为________ 。
(3)乙醛的沸点_________ (填“高于”或“低于”)乙醇的沸点,原因是_________ 。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

①M中非金属元素O、C的第一电离能大小顺序_________ 。
②基态Cl原子的核外电子占据的最高能级的电子云轮廓图为__________ 形。
③M中不含(填代号)________ 。
a.π键 b.离子键 c.σ键 d.配位键
(5)根据等电子原理,可推断O3的空间构型是__________ 。
(6)TiCl4的沸点为136.4℃易溶于乙醇等有机溶剂,说明TiCl4属于_________ 晶体。
(7)钛原子(Ti)一定条件下和碳原子可形成气态团簇分子;分子模型如图1所示,其中白球表示Ti原子,黑球表示碳原子,则其分子式为________ 。已知晶体TiO2的晶胞如图2所示,其晶胞边长为540.0pm,密度为_________ g•cm-3(列式表示),Ti与O之间的距离为________ pm(列式表示)。


(1)基态Ti原子的价层电子排布式为
(2)1molCH3CHO中含有的σ键的数目为
(3)乙醛的沸点
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

①M中非金属元素O、C的第一电离能大小顺序
②基态Cl原子的核外电子占据的最高能级的电子云轮廓图为
③M中不含(填代号)
a.π键 b.离子键 c.σ键 d.配位键
(5)根据等电子原理,可推断O3的空间构型是
(6)TiCl4的沸点为136.4℃易溶于乙醇等有机溶剂,说明TiCl4属于
(7)钛原子(Ti)一定条件下和碳原子可形成气态团簇分子;分子模型如图1所示,其中白球表示Ti原子,黑球表示碳原子,则其分子式为

您最近一年使用:0次
2020-08-06更新
|
91次组卷
|
2卷引用:山西省朔州市重点中学2019-2020学年高一下学期期末教学质量检测化学试题
解题方法
9 . 元素X的基态原子的2p能级有4个电子;元素Y的M层电子运动状态与X的价电子运动状态相同;元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子。下列推断正确的是
A.Y是S元素,基态原子最外层电子排布图为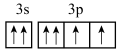 |
| B.离子晶体ZX、ZY的熔点:ZX>ZY |
| C.在Y的氢化物H2Y分子中,Y原子轨道的杂化类型是sp2 |
| D.Y与X可形成YX32-,立体构型为四面体 |
您最近一年使用:0次
2020-08-06更新
|
561次组卷
|
3卷引用:山西省朔州市重点中学2019-2020学年高一下学期期末教学质量检测化学试题
山西省朔州市重点中学2019-2020学年高一下学期期末教学质量检测化学试题山西省孝义市2019-2020学年高二下学期期末考试化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
名校
10 . 氮、磷是植物生长所需的重要元素,回答下列问题
(1)下列N原子电子排布图表示的状态中,能量由低到高的顺序是__________
A. B.
B.
C. D.
D.
(2)羟胺(NH2OH)可看成是氨分子内的一个氢原子被羟基取代的衍生物,分子中N的杂化类型是__________ ,羟胺易溶于水,其主要原因是__________ 。
(3)磷酸属于中强酸,其结构式为 ,磷酸分子之间可以通过羟基间脱水形成多磷酸,如二聚磷酸
,磷酸分子之间可以通过羟基间脱水形成多磷酸,如二聚磷酸 ,写出多磷酸的通式
,写出多磷酸的通式__________ ,含有25个磷原子的多磷酸分子中,σ键与π键的数目分别为__________ 、__________
(4)N和Cl只能形成NCl3,而P和Cl除能形成PCl3外,还能形成PCl5,原因为__________ 。
(1)下列N原子电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.
C.
 D.
D.
(2)羟胺(NH2OH)可看成是氨分子内的一个氢原子被羟基取代的衍生物,分子中N的杂化类型是
(3)磷酸属于中强酸,其结构式为
 ,磷酸分子之间可以通过羟基间脱水形成多磷酸,如二聚磷酸
,磷酸分子之间可以通过羟基间脱水形成多磷酸,如二聚磷酸 ,写出多磷酸的通式
,写出多磷酸的通式(4)N和Cl只能形成NCl3,而P和Cl除能形成PCl3外,还能形成PCl5,原因为
您最近一年使用:0次



