1 . 【化学——选修3:物质结构与性质】磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题:
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式______________ 。
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是_______ 原子。
(3)磷化硼的晶体类型是________ ,B原子的杂化方式是_______ ,每生成1molBP,共形成_______ molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P____ B(填“>”、“<”)
(5)BBr3分子中,键角为_______________ ,为__________ (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是________________ 。
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是
(3)磷化硼的晶体类型是
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P
(5)BBr3分子中,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是
您最近一年使用:0次
2 . 周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。
回答下列问题:
(1)b、c、d中第一电离能最大的是____________ (填元素符号),e的价层电子排布图为_________ 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_________ ;分子中既含有极性共价键、又含有非极性共价键的化合物是__________ (填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_________ (任写一种);酸根呈三角锥结构的酸是___________ (填化学式)。
(4)e和c形成的一种离子化合物的晶体结构如图1所示,则e离子的电荷为__________ 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中,阴离子为__________ ,阳离子中存在的化学键类型有____________ ;该化合物加热时首先失去的组分是____________ ,判断理由是___________________ 。


回答下列问题:
(1)b、c、d中第一电离能最大的是
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
(4)e和c形成的一种离子化合物的晶体结构如图1所示,则e离子的电荷为
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中,阴离子为


您最近一年使用:0次
2016-12-09更新
|
4369次组卷
|
8卷引用:2017届山西省重点中学协作体高三上期中化学试卷
3 . 【选修3物质结构与性质】
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______ ;

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_______________ ;
(3)Se原子序数为_______ ,其核外M层电子的排布式为___________________ ;
(4)H2Se的酸性比H2S_________ (填“强”或“弱”)。气态SeO3分子的立体构型
为_________________ ,SO32-离子的立体构型为___________________ ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_____________________________________________________________________________ ;
② H2SeO4比 H2SeO3酸性强的原因:________________________________________________________________________________________________________________________________
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为_____________________ 列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_______________ pm(列示表示)

VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se原子序数为
(4)H2Se的酸性比H2S
为
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
② H2SeO4比 H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为

您最近一年使用:0次
2016-12-09更新
|
4142次组卷
|
3卷引用:【全国百强校】山西省平遥中学2018-2019学年高二下学期第三次月考化学试题
2012·山西·一模
解题方法
4 . [化学—选修物质结构和性质]
下表为部分短周期元素的性质或原子结构,已知A—D的原子序数依次增大。
请结合表中信息完成下列各小题(答题时用所对应的元素符号)
A:(1)写出C原子的电子排布图___________
(2)A、B、C、D的第一电离能由大到小的顺序为___________
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因___________
B:按照共价键理论,分子中每个原子的最外电子层电子数均已饱和。已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是___________ 。向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为___________ ,分子中C的原子的杂化类型是___________ ;若无配位键则ABCD的结构式为___________ 分子中D原子的杂化类型为___________ 。
(5)BD2的电子式是___________ 将D原子换成等电子的 所得ABCD的结构式为
所得ABCD的结构式为___________ ,分子中C原子的杂化类型是___________ 。
(6)在ABCD的三种可能结构中B原子的杂化类型___________ (填“相同”或“不相同”)
下表为部分短周期元素的性质或原子结构,已知A—D的原子序数依次增大。
| 元素编号 | 元素性质或原子结构 |
| A | A原子所处的周期数、族序数、原子序数均相等 |
| B | 核外电子有6种不同运动状态 |
| C | 最简单氢化物的水溶液呈碱性 |
| D | 基态原子的S轨道电子数等于P轨道电子数 |
A:(1)写出C原子的电子排布图
(2)A、B、C、D的第一电离能由大到小的顺序为
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因
B:按照共价键理论,分子中每个原子的最外电子层电子数均已饱和。已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是
(5)BD2的电子式是
 所得ABCD的结构式为
所得ABCD的结构式为(6)在ABCD的三种可能结构中B原子的杂化类型
您最近一年使用:0次
2012·山西·一模
解题方法
5 . 原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为______ ;在熔点很高的两种常见单质中,X的杂化方式分别为______ 、______ 。
(2)14g乙的单质分子中π键的个数为______ 。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第______ 电离能。
(4)戊的基态原子有______ 种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为______ 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为______ 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=______ cm。 (用含ρ、NA的计算式表示)
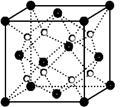
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为______
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为
(2)14g乙的单质分子中π键的个数为
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第
(4)戊的基态原子有
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为

(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
您最近一年使用:0次
10-11高二下·山西吕梁·期中
解题方法
6 . 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________ 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________ ,该化学键能够形成的原因是_______________________________________________________________ 。
(3)已知:
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是__________ 。
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________ 。
(1)砷原子核外电子排布式为
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是
您最近一年使用:0次
2016-12-09更新
|
990次组卷
|
3卷引用:2010-2011学年山西省吕梁市高二下学期期中考试化学试卷
(已下线)2010-2011学年山西省吕梁市高二下学期期中考试化学试卷吉林省吉林地区普通高中友好学校联合体第三十届基础年段2019-2020学年高二下学期期末联考化学试题吉林省长春市清蒲中学2020-2021学年高二下学期期中考试化学试题
10-11高二下·山西吕梁·阶段练习
解题方法
7 . A、B、C、D四种元素处于同一周期。在同族元素中,A的气态氢化物沸点最高,B的最高价氧化物对应水化物的酸性在同周期中最强,C的电负性介于A、B之间,D与B相邻。
(1)C原子的价电子排布式为_______
(2)A、B、C三种原子的第一电离能由大到小的顺序是(写元素符号)_______ 。
(3)B的单质分子中存在①_______ 个 键;D的最简单气态氢化物分子中的中心原子轨道采用②
键;D的最简单气态氢化物分子中的中心原子轨道采用②_______ 杂化。B和D形成一种超硬、耐磨、耐高温的化合物,该化合物属于③_______ 晶体,其硬度比金刚石④_______ (填“大”或“小”)。
(4)A的气态氢化物的沸点在同族中最高的原因_______ 。
(1)C原子的价电子排布式为
(2)A、B、C三种原子的第一电离能由大到小的顺序是(写元素符号)
(3)B的单质分子中存在①
 键;D的最简单气态氢化物分子中的中心原子轨道采用②
键;D的最简单气态氢化物分子中的中心原子轨道采用②(4)A的气态氢化物的沸点在同族中最高的原因
您最近一年使用:0次
9-10高三·山西太原·阶段练习
8 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E,其中A、B、C是同一周期的非金属元素。化合物DC中存在离子键,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24。
请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________________ 。
(2)B的氢化物的中心原子采取__________ 杂化。
(3)写出化合物AC2的电子式_________ ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为_____________
(4)E的核外电子排布式是________________________________ 。
请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的中心原子采取
(3)写出化合物AC2的电子式
(4)E的核外电子排布式是
您最近一年使用:0次



