名校
1 . Mn和Ni是构成合金钢金(即铁合金)的主要元素。请回答下列问题:
(1)Mn在元素周期表中的位置___________ ,有___________ 种能量不同的电子,电子占据的最高能层符号是___________
(2)Ni的价电子轨道表示式为___________ ,属于___________ 区的元素
(3)过硫酸盐(S2O )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,S的轨道杂化方式为___________

(1)Mn在元素周期表中的位置
(2)Ni的价电子轨道表示式为
(3)过硫酸盐(S2O
 )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,S的轨道杂化方式为
您最近一年使用:0次
名校
解题方法
2 . 一种植物生长调节剂的分子结构如图所示。下列说法不正确的是
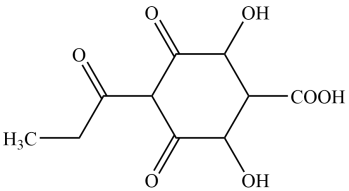

| A.该物质含有3种官能团 |
| B.该物质属于脂环烃 |
| C.该物质中碳原子采取两种杂化方式 |
| D.该物质的化学式为C10H12O7 |
您最近一年使用:0次
名校
解题方法
3 . 离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。1-乙基-3-甲基咪唑四氟硼酸盐离子液体结构如图所示,下列相关叙述错误的是
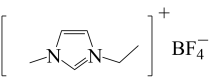

| A.该离子液体的熔沸点低于氯化钠晶体 |
| B.阴离子呈正四面体形,存在共价键和配位键 |
| C.阳离子中σ键数目是π键数目的10倍 |
| D.离子液体难挥发,可用作溶剂 |
您最近一年使用:0次
2022-03-17更新
|
446次组卷
|
3卷引用:吉林省吉林市第一中学2021-2022学年高二下学期6月月考化学试题(理科创新班)
名校
4 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
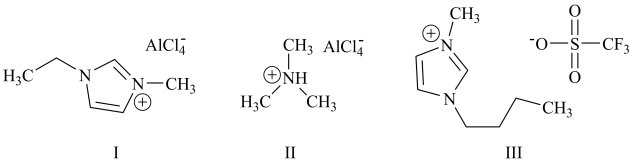
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.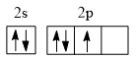 | B.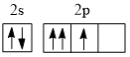 | C.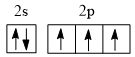 | D.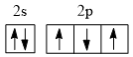 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
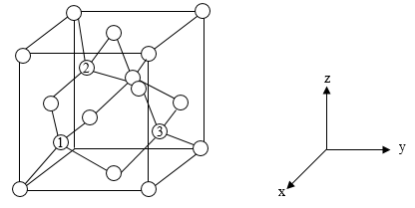
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2764次组卷
|
10卷引用:吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题
吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)江西省新余市2022届高三第二次模拟考试理综化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
5 . 砷化镓(GaAs)是优良的半导体材料,其晶体结构与单晶硅相似。
(1)基态Ga原子的价电子排布式为___________ ,其同周期元素中未成对电子数最多的是___________ (填元素符号)。
(2)GaAs可用 (常温下为无色液体)和
(常温下为无色液体)和 高温反应制得,同时生成另一种产物,写出反应方程式
高温反应制得,同时生成另一种产物,写出反应方程式___________ ,另一种产物中心原子的杂化类型为___________ 。
(3)沸点
___________  (填“>”、“<”、“=”),原因是
(填“>”、“<”、“=”),原因是___________ 。
(4)GaAs的晶胞结构如图所示,键角___________ ,若晶胞中距离最近的两个Ga原子距离为a nm,阿伏加德罗常数的值为 ,则GaAs的密度为
,则GaAs的密度为___________  。
。
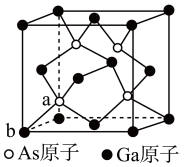
(1)基态Ga原子的价电子排布式为
(2)GaAs可用
 (常温下为无色液体)和
(常温下为无色液体)和 高温反应制得,同时生成另一种产物,写出反应方程式
高温反应制得,同时生成另一种产物,写出反应方程式(3)沸点

 (填“>”、“<”、“=”),原因是
(填“>”、“<”、“=”),原因是(4)GaAs的晶胞结构如图所示,键角
 ,则GaAs的密度为
,则GaAs的密度为 。
。
您最近一年使用:0次
2022-01-22更新
|
144次组卷
|
2卷引用:吉林省吉林市普通中学2021-2022学年高三上学期第二次调研测试化学试题
名校
解题方法
6 . 抗坏血酸分子的结构简式为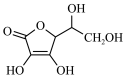 ,下列说法不正确的是
,下列说法不正确的是
 ,下列说法不正确的是
,下列说法不正确的是| A.分子中含有2个手性碳原子 |
B. 抗坏血酸分子中含有 抗坏血酸分子中含有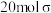 键 键 |
C.分子中碳原子的杂化方式为 和 和 |
D.所含元素的第一电离能比较: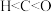 |
您最近一年使用:0次
2022-01-20更新
|
216次组卷
|
4卷引用:吉林省梅河口市第五中学等名校2021-2022学年高二上学期期末联考化学试题
名校
解题方法
7 . 钛及其化合物作用重要,尤其氧化钛、四氧化钛、钛酸钡等应用更广。回答下列问题:
(1)基态钛原子的价层电子排布式为_______ 。
(2) 二氧化钛是世界上最白的物质,1g二氧化钛可以把450多平方厘米的面积涂得雪白,是调制白油漆的最好颜料。基态Ti4+中核外电子占据的原子轨道数为_____ 个。
(3)四氯化钛是种有趣的液体,在潮湿空气中水解生成白色的二氧化钛水凝胶,军事上利用四氯化钛的这种“怪脾气”制造烟雾剂。写出四氯化钛水解的化学方程式_______ 。
(4)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。LiBH4由Li+和BH 构成,其中BH
构成,其中BH 的空间构型为
的空间构型为_______ ;B原子的杂化轨道类型为_______ 。
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下:
锰元素位于第_______ 周期_______ 族_______ 区;比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)基态钛原子的价层电子排布式为
(2) 二氧化钛是世界上最白的物质,1g二氧化钛可以把450多平方厘米的面积涂得雪白,是调制白油漆的最好颜料。基态Ti4+中核外电子占据的原子轨道数为
(3)四氯化钛是种有趣的液体,在潮湿空气中水解生成白色的二氧化钛水凝胶,军事上利用四氯化钛的这种“怪脾气”制造烟雾剂。写出四氯化钛水解的化学方程式
(4)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。LiBH4由Li+和BH
 构成,其中BH
构成,其中BH 的空间构型为
的空间构型为(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下:
元素 | Mn | Fe | |
电离能/kJ∙mol−1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
您最近一年使用:0次
2022-01-17更新
|
305次组卷
|
3卷引用:吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题
吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题湖南省怀化市2021-2022学年高二上学期期末考试化学试题(已下线)期末押题卷02-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)
21-22高二·全国·课时练习
名校
8 . 下列说法中正确的是
| A.NCl3分子呈三角锥形,这是氮原子采取sp2杂化的结果 |
| B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道 |
| C.中心原子采取sp3杂化的分子,其空间结构可能是四面体形或三角锥形或V形 |
| D.AB3型的分子空间结构必为平面三角形 |
您最近一年使用:0次
2021-12-25更新
|
643次组卷
|
4卷引用:吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题
吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题吉林省长春外国语学校2021-2022学年高二上学期期末考试化学试题(已下线)2.2.2 杂化轨道理论-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)
名校
9 . 下列说法中错误的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱与化学键强弱有关 |
B.三硫化磷(P4S3)分子结构如图 , , 分子中含有9mol共价键 分子中含有9mol共价键 |
C.丙烯腈 分子中,碳原子的杂化方式有sp3、sp2 分子中,碳原子的杂化方式有sp3、sp2 |
D.CO的结构可以表示为 ,所以CO分子中有一个π键是配位键 ,所以CO分子中有一个π键是配位键 |
您最近一年使用:0次
2021-07-26更新
|
183次组卷
|
4卷引用:吉林省四平市实验中学2021-2022学年高二下学期第一次月考化学试题
吉林省四平市实验中学2021-2022学年高二下学期第一次月考化学试题内蒙古赤峰市2020-2021学年高二下学期期末考试化学(A)试题(已下线)第五章 物质结构与性质元素周期律 第29练 化学键 分子的空间结构内蒙古自治区赤峰市2020-2021学年高一下学期期末联考化学试题
名校
解题方法
10 . A、B、C、D 4种短周期元素,原子序数依次增大。其元素相关信息如下表。
(1)元素A、B、C中,电负性最大的是_______ (填元素符号)。
(2)A与B形成共价化合物 ,其分子的空间结构呈
,其分子的空间结构呈_______ 形。
(3) 易溶于
易溶于 中的原因是
中的原因是_______ 。
(4)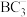 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为_______ ;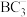 的空间结构为
的空间结构为_______ 。
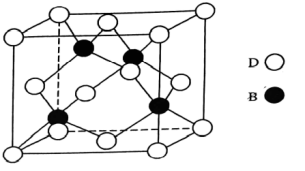
(5)B和D两种元素组成的化合物是共价晶体,其晶胞如下图所示,则表示该化合物的化学式为_______ (请用元素符号表示)。
| 元素 | 信息 |
| A | 元素原子的核外电子只有一种运动状态 |
| B | 价电子层中的未成对电子有3个 |
| C | 最外层电子数为其内层电子数的3倍 |
| D | 离子半径在同周期金属元素中最小 |
(1)元素A、B、C中,电负性最大的是
(2)A与B形成共价化合物
 ,其分子的空间结构呈
,其分子的空间结构呈(3)
 易溶于
易溶于 中的原因是
中的原因是(4)
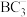 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为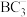 的空间结构为
的空间结构为(5)B和D两种元素组成的化合物是共价晶体,其晶胞如下图所示,则表示该化合物的化学式为

您最近一年使用:0次
2021-07-20更新
|
215次组卷
|
2卷引用:吉林省长春市第八中学2021-2022学年高二下学期线上月考化学试题



