解题方法
1 . N元素能形成多种化合物,它们之间可以发生相互转化,如:N2H4+HNO2=2H2O+HN3。请回答下列问题:
(1)N与O的电负性较小的是_____ 。
(2)N的基态原子的电子排布中,有____ 个运动状态不同的未成对电子。
(3)HNO2原子的杂化类型是____ 。
(4)NO 与钴盐通过配位键形成的[Co(NO2)6]3-能与K+结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+,写出该配合物中钴离子的电子排布式:
与钴盐通过配位键形成的[Co(NO2)6]3-能与K+结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+,写出该配合物中钴离子的电子排布式:____ 。
(1)N与O的电负性较小的是
(2)N的基态原子的电子排布中,有
(3)HNO2原子的杂化类型是
(4)NO
 与钴盐通过配位键形成的[Co(NO2)6]3-能与K+结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+,写出该配合物中钴离子的电子排布式:
与钴盐通过配位键形成的[Co(NO2)6]3-能与K+结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+,写出该配合物中钴离子的电子排布式:
您最近一年使用:0次
2 . 镍钴锰酸锂是锂电池的关键三元正极材料,化学式为LiNixCoyMn1-x-yO2。其中的锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一、回答下列问题:
(1)基态Ni原子的价电子排布式为___________ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“___________ 理论”解释。
(2)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为___________ ,ClO 的空间构型是
的空间构型是___________ , SO(CH3)2中键角∠C—S—O___________ CH3COCH3中键角∠C—C—O(填“>”、“<”或“=”),元素S、Cl、O的电负性由小到大的顺序为___________ 。
(3)已知:r(Fe2+)为61pm、r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是___________ 。
(4)La、Ni合金是较为理想的储氢材料,其晶胞结构如图所示:

①该储氢材料的化学式为___________ 。
②已知晶胞参数边长为anm,高为bnm,设阿伏加德罗常数的值为NA,一个晶胞内可以储存18个氢原子,储氢后的晶胞密度为___________ g·cm-3。
(1)基态Ni原子的价电子排布式为
(2)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为
 的空间构型是
的空间构型是(3)已知:r(Fe2+)为61pm、r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是
(4)La、Ni合金是较为理想的储氢材料,其晶胞结构如图所示:

①该储氢材料的化学式为
②已知晶胞参数边长为anm,高为bnm,设阿伏加德罗常数的值为NA,一个晶胞内可以储存18个氢原子,储氢后的晶胞密度为
您最近一年使用:0次
名校
3 . 顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(II)的简称,属于第二代铂族抗癌药物,结构如图所示,其毒副作用低于顺铂。下列说法正确的是


| A.碳铂分子中所有碳原子在同一平面上 |
| B.碳铂分子中非金属元素的电负性大小:N>O>C>H |
| C.碳铂分子中sp3杂化的碳原子与sp2杂化的碳原子数目之比为2:1 |
| D.1mol1,1-环丁二羧酸含有σ键的数目为12NA |
您最近一年使用:0次
名校
解题方法
4 . 下列粒子的中心原子形成sp3杂化轨道且该粒子的空间结构为三角锥形的是
A.SO | B.CH | C.ClO | D.[PCl4]+ |
您最近一年使用:0次
2022-06-17更新
|
209次组卷
|
4卷引用:吉林省通化市2021-2022学年高二下学期期中联考化学试题
名校
5 . NA为阿伏加德罗常数的值。下列说法正确的是


| A.46 g CH3CH2OH中采用sp3杂化的原子总数为2NA |
| B.0.1 mol SF6 (如图所示)分子中含有共价键的数目为1. 6NA |
| C.56 g铁与1 mol氯气充分反应,转移的电子数为2NA |
| D.标准状况下,11.2 L SO3溶于1 L水所形成的溶液中,含有的H+数为NA |
您最近一年使用:0次
2022-06-03更新
|
107次组卷
|
2卷引用:吉林省白山市抚松县第一中学2021-2022学年高二下学期第二次月考化学试题
名校
6 . 半导体材料是半导体⼯业的基础,由第ⅢA和第ⅤA元素所形成的化合物在半导体材料领域有⼴泛的应⽤。如砷化镓(GaAs)、砷化硼(BAs)、砷化铝(AlAs),氮化镓(GaN)等。请根据第ⅢA和第ⅤA元素核外电⼦排布的特点和形成化学键的多样性等特点回答下列问题:
(1)基态As原⼦的电⼦排布式为[Ar]___________ 。Ga、As和Se的第⼀电离能由小到大的顺序是:___________ 。
(2)实验发现,氯化铝的蒸⽓或溶于⾮极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原⼦采取___________ 杂化。
②Al2Cl6与过量NaOH溶液反应⽣成 ,
, -中存在的化学作⽤⼒类型有
-中存在的化学作⽤⼒类型有___________ (填标号)。
A.离⼦键 B.极性共价键 C.⾦属键 D.非极性共价键 E.配位键 F. 键 G.氢键
键 G.氢键
(3)N、B可以分别形成化合物NF3和BF3,试判断两种分⼦中键角的大小:NF3___________ BF3(填“>”、“<”、“=”)。
(4)⾃然界中不存在单质硼,硼的氢化物也很少,主要以含氧化合物形式存在,根据下表数据分析原因是___________ 。
(5)GaN是第三代半导体材料的研究热点,在⼲燥的NH3⽓流中焙烧磨细的GaAs可制得GaN。GaN、GaP、GaAs晶体类型与SiC相似,熔点如下表所示,其熔点差异的原因是___________ 。
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形A´C´CA是沿晶胞对⻆⾯取得的截图。

①若晶胞的边长均为apm,阿伏加德罗常数的值为NA,晶体的密度为___________ g·cm-3(列出计算表达式)。
②晶胞中各原⼦在矩形A´C´CA的位置为___________ (填标号)。
A. B.
B.
C. D.
D.
(1)基态As原⼦的电⼦排布式为[Ar]
(2)实验发现,氯化铝的蒸⽓或溶于⾮极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原⼦采取
②Al2Cl6与过量NaOH溶液反应⽣成
 ,
, -中存在的化学作⽤⼒类型有
-中存在的化学作⽤⼒类型有A.离⼦键 B.极性共价键 C.⾦属键 D.非极性共价键 E.配位键 F.
 键 G.氢键
键 G.氢键(3)N、B可以分别形成化合物NF3和BF3,试判断两种分⼦中键角的大小:NF3
(4)⾃然界中不存在单质硼,硼的氢化物也很少,主要以含氧化合物形式存在,根据下表数据分析原因是
| 化学键 | B—H | B—O | B—B |
| 键能(kJ/mol) | 389 | 561 | 293 |
| 物质 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |

①若晶胞的边长均为apm,阿伏加德罗常数的值为NA,晶体的密度为
②晶胞中各原⼦在矩形A´C´CA的位置为
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
2022-06-03更新
|
665次组卷
|
3卷引用:东北师范大学附属中学2022届高三考前模拟预测化学试题
东北师范大学附属中学2022届高三考前模拟预测化学试题(已下线)专题17 物质结构与性质综合题-备战2023年高考化学母题题源解密(全国通用)黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题
解题方法
7 . 尿素[ ]可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为
]可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为 。下列说法错误的是
。下列说法错误的是
 ]可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为
]可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为 。下列说法错误的是
。下列说法错误的是A.电负性: |
B.基态 电子排布式为 电子排布式为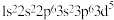 |
C. 与尿素分子中的N原子杂化方式相同 与尿素分子中的N原子杂化方式相同 |
| D.C、N原子中电子占据能量最高的轨道形状相同 |
您最近一年使用:0次
2022-05-21更新
|
296次组卷
|
4卷引用:吉林洮南市第一中学2021-2022学年高二下学期第三次考试化学试题
解题方法
8 . 我国是世界上最早制得和使用铜的国家,铜及其化合物在日常生产和生活中有着广泛的应用。回答下列问题:
(1)Cu在元素周期表中位_______ 区,基态Cu2+价层电子的电子排布图(轨道表达式)为_______ 。
(2)由Cu2+形成的配合物种类繁多,在配离子[Cu(NH3)4]2+中,其配体的立体构型为_______ , 在[Cu(CN)4] 2−中,与其配体互为等电子体的一种分子是_______ (写化学式)。
(3)Cu2+能与吡咯( )的阴离子(
)的阴离子(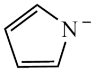 )形成双吡咯铜。
)形成双吡咯铜。
① 中C和N原子的杂化均为
中C和N原子的杂化均为_______ 。
②1mol 含有
含有_______ molσ键,分子中的大π键可用符号π 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π ,则
,则 中的大π键应表示为
中的大π键应表示为_______ 。
(4)试从原子结构角度解释在高温下CuO能分解生成Cu2O的原因_______ 。
(5)高温超导体“钇钡铜氧”广泛应用于超导输电、磁悬浮列车等,其晶胞结构如图:
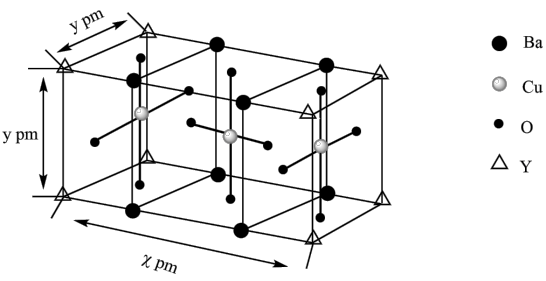
该物质以Y2O3、BaCO3和CuO为原料烧结而成,其原料物质的量之比为_______ ,若阿伏加德罗常数的值为NA,则该晶体的密度为_______ g·cm−3(列出计算表达式)。
(1)Cu在元素周期表中位
(2)由Cu2+形成的配合物种类繁多,在配离子[Cu(NH3)4]2+中,其配体的立体构型为
(3)Cu2+能与吡咯(
 )的阴离子(
)的阴离子( )形成双吡咯铜。
)形成双吡咯铜。①
 中C和N原子的杂化均为
中C和N原子的杂化均为②1mol
 含有
含有 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π ,则
,则 中的大π键应表示为
中的大π键应表示为(4)试从原子结构角度解释在高温下CuO能分解生成Cu2O的原因
(5)高温超导体“钇钡铜氧”广泛应用于超导输电、磁悬浮列车等,其晶胞结构如图:

该物质以Y2O3、BaCO3和CuO为原料烧结而成,其原料物质的量之比为
您最近一年使用:0次
名校
解题方法
9 . 完成下列问题。
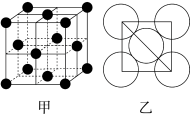
(1)金属铝的晶胞结构如图甲所示,原子之间相互位置关系的平面图如图乙所示。若已知Al的原子半径为rcm,NA代表阿伏加德罗常数的值,该晶体的密度为_______  (用含NA、r的最简式表示)。
(用含NA、r的最简式表示)。
(2)2022年北京冬季奥运会场馆建设使用了大量不锈钢材质,不锈钢属于铁碳合金,常含铬、镍等元素。
①碳的一种单质石墨是单层二维蜂窝状晶格结构的新材料(如图1),其中碳原子采取_______ 杂化,在层中每个碳原子周围等距且紧邻的碳原子个数为_______ 。

②铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图2所示。晶体中每个镁原子周围等距且紧邻的镁原子有_______ 个,该铁镁合金中原子个数比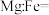
_______ ;原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),C为( ,
, ,0),B点坐标参数为
,0),B点坐标参数为_______ 。

(1)金属铝的晶胞结构如图甲所示,原子之间相互位置关系的平面图如图乙所示。若已知Al的原子半径为rcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 (用含NA、r的最简式表示)。
(用含NA、r的最简式表示)。
(2)2022年北京冬季奥运会场馆建设使用了大量不锈钢材质,不锈钢属于铁碳合金,常含铬、镍等元素。
①碳的一种单质石墨是单层二维蜂窝状晶格结构的新材料(如图1),其中碳原子采取

②铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图2所示。晶体中每个镁原子周围等距且紧邻的镁原子有
 ,
, ,0),B点坐标参数为
,0),B点坐标参数为
您最近一年使用:0次
名校
解题方法
10 . 人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素分子M的键线式如图所示,关于化合物M的说法错误的是
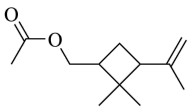

| A.M分子中所有的官能团名称为酯基和碳碳双键 |
| B.M分子中碳原子的杂化方式有sp2、sp3 |
| C.M分子中含有1个手性碳原子 |
| D.M分子具有一定的挥发性 |
您最近一年使用:0次
2022-05-15更新
|
164次组卷
|
2卷引用:吉林省长春市实验中学2021-2022学年高二下学期线上教学诊断检测(二)化学试题



