解题方法
1 . 碳元素的单质有多种形式,如图所示,依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为______ 。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为______ 、______ 。
(3)C60属于_____ 晶体,石墨属于______ 晶体。
(4)根据CsCl的晶胞结构分析,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为______ ;每个Cs+周围距离相等且次近的Cs+数目为______ ,距离为______ ;每个Cs+周围距离相等且第三近的Cs+数目为______ ,距离为______ ;每个Cs+周围紧邻且等距的Cl—数目为______ 。


回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(3)C60属于
(4)根据CsCl的晶胞结构分析,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为

您最近一年使用:0次
解题方法
2 . 回答下列问题:
(1)1mol乙醛分子中含有σ键的数目为_____ ,乙酸的沸点明显高于乙醛,其主要原因是_____ 。
(2)短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层的p能级中有3个未成对电子。
①C元素原子基态时的电子排布式为_____ ,若A元素为非金属元素,A与C形成的化合物中的共价键属于_____ (填“σ”或“π”)键。
②当n=2时,B的最简单气态氢化物的分子空间结构为_____ ,中心原子的杂化方式为_____ ,BC2属于_____ (填“极性”或“非极性”)分子。
(3)已知苯酚(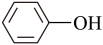 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_____ (水杨酸)Ka(苯酚)(填“>”或“<”),其原因是_____ 。
(1)1mol乙醛分子中含有σ键的数目为
(2)短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层的p能级中有3个未成对电子。
①C元素原子基态时的电子排布式为
②当n=2时,B的最简单气态氢化物的分子空间结构为
(3)已知苯酚(
 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
您最近一年使用:0次
解题方法
3 . 已知次氯酸分子的结构式为H-O-Cl,下列说法正确的是
| A.O原子发生sp杂化 | B.O原子与H、Cl都形成π键 |
| C.该分子为V形分子 | D.该分子的电子式是 |
您最近一年使用:0次
名校
解题方法
4 . 以Cu2O、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
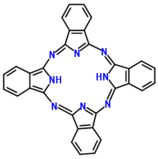
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(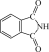 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(3)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(4)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
(5)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。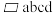 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。

(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(3)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(4)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(5)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
名校
5 . 金刚石、石墨、C60和石墨烯的结构示意图分别如图所示,下列说法不正确的是
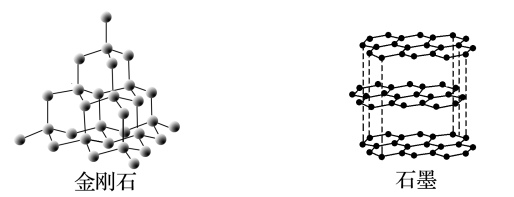
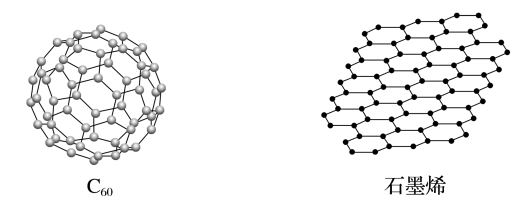
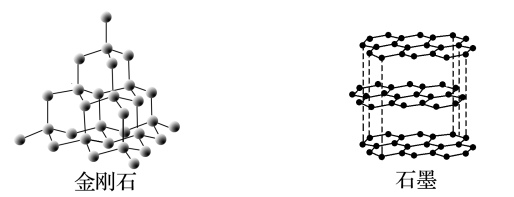

| A.金刚石和石墨烯中碳原子的杂化方式不同 |
| B.金刚石、石墨、C60和石墨烯的关系:互为同素异形体 |
| C.这四种物质完全燃烧后的产物都是CO2 |
| D.石墨与C60的晶体类型相同 |
您最近一年使用:0次
2022-08-20更新
|
131次组卷
|
2卷引用:吉林省长春外国语学校2021-2022学年高二下学期阶段测试化学试题
解题方法
6 . 氮是一种典型的非金属元素,其单质及化合物在生活和生产中具有广泛的用途。请回答下列问题:
(1)科学家目前合成了 分子,其结构如图所示。
分子,其结构如图所示。 分子中氮原子的杂化轨道类型是
分子中氮原子的杂化轨道类型是_______ ,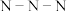 键角为
键角为_______ ; 分解后能产生
分解后能产生 并释放出大量能量,推测其用途可为
并释放出大量能量,推测其用途可为_______ 。
(2)①维生素 可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
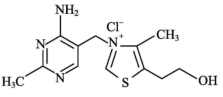
以下关于维生素 的说法正确的是
的说法正确的是_______ 。
a.只含σ键和π键
b.既有共价键又有离子键
c.既含有极性键又含有非极性键
②维生素 燃烧可生成
燃烧可生成 、
、 、
、 、
、 、
、 、
、 等物质,这些物质中属于非极性分子的化合物有
等物质,这些物质中属于非极性分子的化合物有_______ 。
(3)液氨常被用作制冷剂,若不断地升高温度,实现“液氨 氨气
氨气 氮气和氢气
氮气和氢气 氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①_______ ;②极性键;③_______ 。
(1)科学家目前合成了
 分子,其结构如图所示。
分子,其结构如图所示。 分子中氮原子的杂化轨道类型是
分子中氮原子的杂化轨道类型是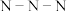 键角为
键角为 分解后能产生
分解后能产生 并释放出大量能量,推测其用途可为
并释放出大量能量,推测其用途可为
(2)①维生素
 可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
以下关于维生素
 的说法正确的是
的说法正确的是a.只含σ键和π键
b.既有共价键又有离子键
c.既含有极性键又含有非极性键
②维生素
 燃烧可生成
燃烧可生成 、
、 、
、 、
、 、
、 、
、 等物质,这些物质中属于非极性分子的化合物有
等物质,这些物质中属于非极性分子的化合物有(3)液氨常被用作制冷剂,若不断地升高温度,实现“液氨
 氨气
氨气 氮气和氢气
氮气和氢气 氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
您最近一年使用:0次
7 .  具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。
(1)以 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_______ ,N原子轨道表示式_______ 。
②实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
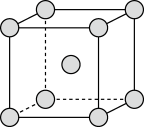
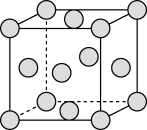
ⅰ.两种晶胞所含铁原子个数比为_______ 。
ⅱ.图1晶胞的棱长为apm ( ),则其密度
),则其密度
_______  。
。
③我国科学家开发出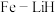 等双中心催化剂,在合成
等双中心催化剂,在合成 中显示出高催化活性。第一电离能(I1):
中显示出高催化活性。第一电离能(I1):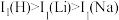 ,原因是
,原因是_______ 。
(2) 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为_______ 。
② 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是_______ 。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。(1)以
 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。①基态Fe原子的电子排布式为
②实际生产中采用铁的氧化物
 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:

ⅰ.两种晶胞所含铁原子个数比为
ⅱ.图1晶胞的棱长为apm (
 ),则其密度
),则其密度
 。
。③我国科学家开发出
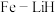 等双中心催化剂,在合成
等双中心催化剂,在合成 中显示出高催化活性。第一电离能(I1):
中显示出高催化活性。第一电离能(I1):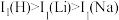 ,原因是
,原因是(2)
 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。①
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是
您最近一年使用:0次
8 . 下表为元素周期表前三周期的一部分:
(1)基态Z原子的价电子排布式为_______ 。
(2)X与Y的简单氢化物中沸点较高的是_______ (填化学式),原因是_______ 。
(3)选出X的基态原子的电子排布图_______ (填“①”或“②”),另一电子排布图不能作为基态原子的电子排布图是因为它不符合_______ (填标号)。
① ②
②
A.能量最低原理 B.泡利原理 C.洪特规则
(4)以上五种元素中,_______ (填元素符号)元素第一电离能最大,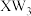 与
与 分子中键角较大的是
分子中键角较大的是_______ (填分子式)。
(5)已知Z、W可形成分子 ,且Z、W原子均满足
,且Z、W原子均满足 稳定结构,则
稳定结构,则 的结构式为
的结构式为_______ ,Z原子的杂化方式为_______ 。
| X | R | ||
| Y | Z | W |
(2)X与Y的简单氢化物中沸点较高的是
(3)选出X的基态原子的电子排布图
①
 ②
②
A.能量最低原理 B.泡利原理 C.洪特规则
(4)以上五种元素中,
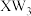 与
与 分子中键角较大的是
分子中键角较大的是(5)已知Z、W可形成分子
 ,且Z、W原子均满足
,且Z、W原子均满足 稳定结构,则
稳定结构,则 的结构式为
的结构式为
您最近一年使用:0次
2022-07-24更新
|
132次组卷
|
2卷引用:吉林省“BEST合作体” 2021-2022学年高二下学期期末考试化学试题
名校
解题方法
9 . 一种杂环有机物M的结构如图所示,下列说法正确的是
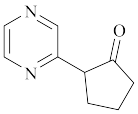

A.第一电离能: | B.电负性: |
| C.C原子的杂化方式有三种 | D.π键与σ键个数比为4:23 |
您最近一年使用:0次
2022-07-24更新
|
237次组卷
|
3卷引用:吉林省“BEST合作体” 2021-2022学年高二下学期期末考试化学试题
吉林省“BEST合作体” 2021-2022学年高二下学期期末考试化学试题广东省梅州市大埔县虎山中学2022-2023学年高三上学期第一次段考(8月)化学试题(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(1-10)
解题方法
10 . 通常状况下, 是无色透明液体,下列对
是无色透明液体,下列对 的有关叙述不正确的是
的有关叙述不正确的是
 是无色透明液体,下列对
是无色透明液体,下列对 的有关叙述不正确的是
的有关叙述不正确的是| A.分子中的所有原子均达到8电子稳定结构 |
B. 中P原子采用 中P原子采用 杂化 杂化 |
C. 分子是极性分子 分子是极性分子 |
D. 分子中四个原子共平面 分子中四个原子共平面 |
您最近一年使用:0次
2022-07-24更新
|
86次组卷
|
2卷引用:吉林省“BEST合作体” 2021-2022学年高二下学期期末考试化学试题



