解题方法
1 . 回答下列问题。
(1)N2H4是___________ (填“极性”或“非极性”)分子,N2H4中中心原子N杂化类型为___________ 。
(2)乙炔分子的碳原子采取什么杂化方式?___________ ;它的杂化轨道用于形成什么化学键?___________ ;怎样理解它存在碳碳三键?___________ 。
(3)向绿色的NiSO4溶液中滴加过量的氨水,溶液会变成深蓝色,其原因是溶液中生成了一种六配体的配离子,该配离子的化学式为___________ 。
(1)N2H4是
(2)乙炔分子的碳原子采取什么杂化方式?
(3)向绿色的NiSO4溶液中滴加过量的氨水,溶液会变成深蓝色,其原因是溶液中生成了一种六配体的配离子,该配离子的化学式为
您最近一年使用:0次
2 . 火法冶炼是以黄铜矿(CuFeS2)为主要原料,下图是一种火法制备高纯度铜的工艺。

(1)黄铜矿熔炼过程中会发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2.若2 mol CuFeS2参与反应,转移电子数目为_______ 。在上述反应中,SO2是_______ 。
A.氧化剂 B.还原剂 C.还原产物 D.氧化产物
(2)吹炼过程中,向熔融的冰铜中加入SiO2的目的是_______ 。
(3)粗铜经电解精炼可获得高纯度铜,下列说法正确的是
(4)关于SO2的说法正确的是
(5)煤中掺入一定量的生石灰,能减少煤燃烧排放的SO2,体现SO2具有
(6)冶铜烟气可以作为工业制硫酸为原料。下列的说法正确的是
(7)蔗糖遇浓硫酸会变成“黑面包”状,下列说法正确的是

(1)黄铜矿熔炼过程中会发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2.若2 mol CuFeS2参与反应,转移电子数目为
A.氧化剂 B.还原剂 C.还原产物 D.氧化产物
(2)吹炼过程中,向熔融的冰铜中加入SiO2的目的是
(3)粗铜经电解精炼可获得高纯度铜,下列说法正确的是
| A.粗铜做阴极,发生氧化反应 |
| B.电解质溶液中铜离子向阴极移动 |
| C.利用阳极泥可回收Ag、Zn、Au等金属 |
| D.当电路中通过的电子数为NA时,阳极的质量变化一定是32 g |
(4)关于SO2的说法正确的是
| A.中心原子的杂化类型为sp2 | B.电负性:O<S |
| C.属于非极性分子 | D.价层电子对的空间结构为平面三角形 |
(5)煤中掺入一定量的生石灰,能减少煤燃烧排放的SO2,体现SO2具有
| A.漂白性 | B.酸性氧化物的性质 |
| C.氧化性 | D.还原性 |
(6)冶铜烟气可以作为工业制硫酸为原料。下列的说法正确的是
| A.500℃左右,转化器中反应的平衡转化率最大 |
| B.使用以铁为主的催化剂 |
| C.冶炼烟气在进入转化器之前,必须进行除尘、干燥等净化操作,防止催化剂中毒 |
| D.压强一般采用20~50MPa |
(7)蔗糖遇浓硫酸会变成“黑面包”状,下列说法正确的是
| A.蔗糖属于多糖 |
| B.在水浴条件下,蔗糖能与银氨溶液反应产生“银镜” |
| C.浓硫酸表现出脱水性、氧化性 |
| D.产生的气体通入品红溶液,溶液会褪色 |
您最近一年使用:0次
3 . 在某温度下,5L密闭容器内发生如下反应:CH4(g)+H2O (g) CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)反应中的非极性分子为:______ 、______ 。
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式______ ,当温度升高,该平衡常数______ (填“增大”、“减小”或“不变”)。
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为______ 。
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
(5)在某一时刻,v正=v逆=v,此时反应达到平衡。若改变一条件,可使得v正<v逆<v,指出可以改变的条件______ ,并说明理由:__________________ 。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)= ______ 时,平衡时CO与H2的转化率相同。
 CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0(1)反应中的非极性分子为:
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
| A.氢元素的质量分数 | B.容器内的压强 |
| C.反应的平衡常数 | D.容器内气体的平均分子量 |
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2
 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)=
您最近一年使用:0次
名校
解题方法
4 . 化学反应中既有物质变化,也有能量变化。这些变化与化学反应的条件、限度、速率等因素有关。
(1)已知NH4F溶液呈酸性,则水解程度
___________ F-(填“>”、“<”或“=”),稀释后溶液中 的值将会
的值将会 ___________ (填“增大”、“减小”或“不变”)。
(2)某温度下,在体积为5L的密闭容器内发生如下反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①在上述反应的反应物与生成物中,非极性分子为:___________ 。
②上述反应中各物质反应速率之间的关系为:___________ 。
③若反应20min后气体总物质的量增加了10mol,则甲烷的平均反应速率为___________ 。
④下列选项中的物理量不变时,一定可以判断反应达到平衡的是___________ 。
A.容器内氢元素的质量分数
B.容器内气体的密度
C.容器内气体的压强
D.容器内气体的平均相对分子质量
⑤在某一时刻,v正=v逆=v0,反应若改变某一条件,可使得v正<v逆<v0,指出可以改变的条件___________ 。
⑥已知CO与H2合成CH3OH是可逆反应:CO+2H2⇌CH3OH,若上述反应达到平衡时CO与H2的转化率相同,则投料比n(CO):n(H2)=___________ 。
(1)已知NH4F溶液呈酸性,则水解程度

 的值将会
的值将会 (2)某温度下,在体积为5L的密闭容器内发生如下反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①在上述反应的反应物与生成物中,非极性分子为:
②上述反应中各物质反应速率之间的关系为:
③若反应20min后气体总物质的量增加了10mol,则甲烷的平均反应速率为
④下列选项中的物理量不变时,一定可以判断反应达到平衡的是
A.容器内氢元素的质量分数
B.容器内气体的密度
C.容器内气体的压强
D.容器内气体的平均相对分子质量
⑤在某一时刻,v正=v逆=v0,反应若改变某一条件,可使得v正<v逆<v0,指出可以改变的条件
⑥已知CO与H2合成CH3OH是可逆反应:CO+2H2⇌CH3OH,若上述反应达到平衡时CO与H2的转化率相同,则投料比n(CO):n(H2)=
您最近一年使用:0次
名校
解题方法
5 . 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
Ⅰ. 可用作储存氢气的材料,结构如下图所示。
可用作储存氢气的材料,结构如下图所示。
(1)继 后,科学家合成了
后,科学家合成了 、
、 ,三者结构相似。下列说法正确的是
,三者结构相似。下列说法正确的是_______ (填序号)
A. 、
、 、
、 都属于共价晶体
都属于共价晶体
B.由于N-N键能小于 ,故
,故 的稳定性弱于
的稳定性弱于
C.由于C-C键长小于Si-Si键,所以 熔沸点低于
熔沸点低于
Ⅱ.是储氢材料,已知其由 和
和 构成,释放氢气的原理为
构成,释放氢气的原理为 。
。
(2) 中不存在的作用力有
中不存在的作用力有___________ (填序号)。
A.离子键 B.共价键 C.分子间作用力
(3)氢化锂(LiH)是离子化合物,写出其电子式___________ ,LiH中离子半径较大的是___________ ,其原因是___________ 。
Ⅲ.汽车安全气囊中的填充物有 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和氮气。完成下列填空:
遇撞击时能生成金属钠和氮气。完成下列填空:
(4)写出 的电子式:
的电子式:___________ 。
(5) 和
和 是两种不同的化合物,
是两种不同的化合物, 是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。 晶体中存在的化学键类型有
晶体中存在的化学键类型有___________ , 遇
遇 会水解而产生
会水解而产生 和
和 ,
, 晶体中存在的化学键类型有
晶体中存在的化学键类型有___________ 。
(6)汽车安全气囊填充物的三种物质中属于共价化合物的是___________ (填写化学式),所涉及的5种元素中,原子半径最大的是___________ (填写元素符号)。
(7)该题中出现的极性分子有___________ 。
(8)渗氮工艺已经成为钢材处理的重要手段,已知一种磁性氮化铁晶胞如下图,该物质的化学式是___________ 。

Ⅰ.
 可用作储存氢气的材料,结构如下图所示。
可用作储存氢气的材料,结构如下图所示。
(1)继
 后,科学家合成了
后,科学家合成了 、
、 ,三者结构相似。下列说法正确的是
,三者结构相似。下列说法正确的是A.
 、
、 、
、 都属于共价晶体
都属于共价晶体B.由于N-N键能小于
 ,故
,故 的稳定性弱于
的稳定性弱于
C.由于C-C键长小于Si-Si键,所以
 熔沸点低于
熔沸点低于
Ⅱ.是储氢材料,已知其由
 和
和 构成,释放氢气的原理为
构成,释放氢气的原理为 。
。(2)
 中不存在的作用力有
中不存在的作用力有A.离子键 B.共价键 C.分子间作用力
(3)氢化锂(LiH)是离子化合物,写出其电子式
Ⅲ.汽车安全气囊中的填充物有
 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和氮气。完成下列填空:
遇撞击时能生成金属钠和氮气。完成下列填空:(4)写出
 的电子式:
的电子式:(5)
 和
和 是两种不同的化合物,
是两种不同的化合物, 是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。 晶体中存在的化学键类型有
晶体中存在的化学键类型有 遇
遇 会水解而产生
会水解而产生 和
和 ,
, 晶体中存在的化学键类型有
晶体中存在的化学键类型有(6)汽车安全气囊填充物的三种物质中属于共价化合物的是
(7)该题中出现的极性分子有
(8)渗氮工艺已经成为钢材处理的重要手段,已知一种磁性氮化铁晶胞如下图,该物质的化学式是

您最近一年使用:0次
名校
6 . 工业排放的某些烟气中含有二氧化硫等大气污染物,对其进行脱硫治理不仅可以防止有害物质排放,还可以生产其他有用的产品。
(1) 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。
(2)第一电离能: ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因___________ 。
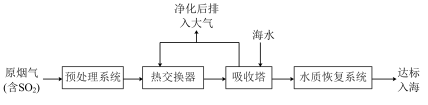
沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示: ,
, 的电离常数如下表所示:
的电离常数如下表所示:
(3)在吸收塔内,烟气应从吸收塔的___________ 通入,与塔顶喷淋的海水充分接触。
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是___________ 。(列举1条)吸收塔内 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)若煤电厂排放烟气量为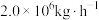 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
___________ 。( )
)
(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收 后生成
后生成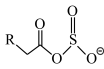 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。
工业上还可用 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
(7)为使 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
(8)使用 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在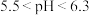 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因___________ 。
(1)
 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。| A.直线形,非极性 | B.直线形,极性 | C.角形,非极性 | D.角形,极性 |
(2)第一电离能:
 ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示:
 ,
, 的电离常数如下表所示:
的电离常数如下表所示:| 弱酸 |  |  |
 | 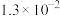 | 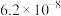 |
 | 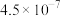 | 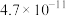 |
(3)在吸收塔内,烟气应从吸收塔的
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是
 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为(5)若煤电厂排放烟气量为
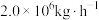 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
 )
)(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收
 后生成
后生成 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。| A.原子发射光谱 | B.红外光谱 | C.核磁共振氢谱 | D.晶体X射线衍射 |
工业上还可用
 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。(7)为使
 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。A. | B.CaO | C. | D.NaOH |
(8)使用
 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在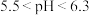 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因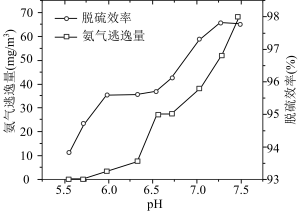
您最近一年使用:0次
2024-01-13更新
|
296次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
名校
7 . 下列化学概念与实验事实关联匹配错误的是
| A.取代基的吸电子能力—酸性: CH3CH2 CH2 COOH < CH3CH2 CHClCOOH |
| B.分子的极性—CH3OH 中正负电荷重心不重合,是极性分子 |
| C.分子间作用力—NaCl 熔点较高 |
D.分子间氢键—CH3CH2 CH2 NH2 的沸点比 高 高 |
您最近一年使用:0次
名校
8 . “天问一号”轨道飞行器近距离拍摄了火星北极,看到大量白色冰冻区域, 主要是二氧 化碳低温凝结形成的干冰,虽然看起来和地球两极很像,但实际温度却比地球两极冷多了!
(1)已知 25℃时, H2CO3 的 Ka1 = 4.2×10-7 、Ka2 = 4.8×10- 11 ,HCN 的 Ka = 4.0×10-10,若向NaCN 溶液中通入少量 CO2,发生反应的离子方程式为___________ 。
(2)下列关于二氧化碳的说法正确的是______。
(1)已知 25℃时, H2CO3 的 Ka1 = 4.2×10-7 、Ka2 = 4.8×10- 11 ,HCN 的 Ka = 4.0×10-10,若向NaCN 溶液中通入少量 CO2,发生反应的离子方程式为
(2)下列关于二氧化碳的说法正确的是______。
A.电子式为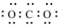 | B.空间填充模型为  |
| C.CO2 是极性分子, 能溶于水 | D.CO2 的水溶液能够导电,但 CO2是非电解质 |
您最近一年使用:0次
名校
9 . Ⅰ.自然界中的氮循环和硫循环紧密相关,它们通过各种生物地球化学过程耦合链接,在此过程中微生物发挥着至关重要的作用。
(1)生物固氮是土壤氮素的重要来源之一、生物固氮是指根瘤菌___________。
(2)动植物体内的氮除了蛋白质外,在___________ 中也大量存在。
A.纤维素 B.脂肪 C.核酸
(3)水体中的 在反硝化菌作用下与
在反硝化菌作用下与 反应生成
反应生成 ,写出发生反应的离子方程式
,写出发生反应的离子方程式___________ 。
Ⅱ.微生物分解海洋生物遗体时会向大气中释放以二甲硫醚( )为代表的有机硫化合物,是硫循环与碳循环的重要环节之一
)为代表的有机硫化合物,是硫循环与碳循环的重要环节之一
(4)关于二甲硫醚分子结构说法正确的是___________。
(5)二甲醚( )与二甲硫醚结构相似,关于两者物理性质比较及原因解释正确的是___________。
)与二甲硫醚结构相似,关于两者物理性质比较及原因解释正确的是___________。
(6)二甲硫醚在大气中经过一系列的氧化,最终生成硫酸盐气溶胶。高压电场常用于气溶胶的净化去除,该过程称为___________。
Ⅲ.脱硫木醋杆菌能将有机化合物中的硫(视作O价硫)转化为气体,此过程表示如下,该反应也是湿沼区域腐败臭味的来源之一
□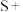 □CH₃COOH+□
□CH₃COOH+□ ___________
___________ +□
+□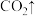
(7)完成并配平该反应(若化学计量数为1可不写)_______ 。
(8)若产生的气体在标准状况下体积为672 mL,转移电子数为___________ 。
(9)脱硫木醋杆菌利用该反应获取能量,简要分析该反应的自发性___________ 。
(1)生物固氮是土壤氮素的重要来源之一、生物固氮是指根瘤菌___________。
| A.从土壤中吸收含氮养料 | B.将氨转变为植物蛋白质 |
| C.将氨转变成硝酸 | D.将空气中的氮气转变成氨 |
A.纤维素 B.脂肪 C.核酸
(3)水体中的
 在反硝化菌作用下与
在反硝化菌作用下与 反应生成
反应生成 ,写出发生反应的离子方程式
,写出发生反应的离子方程式Ⅱ.微生物分解海洋生物遗体时会向大气中释放以二甲硫醚(
 )为代表的有机硫化合物,是硫循环与碳循环的重要环节之一
)为代表的有机硫化合物,是硫循环与碳循环的重要环节之一(4)关于二甲硫醚分子结构说法正确的是___________。
| A.只含有极性键的极性分子 | B.含有非极性键的极性分子 |
| C.只含有极性键的非极性分子 | D.含有非极性键的非极性分子 |
 )与二甲硫醚结构相似,关于两者物理性质比较及原因解释正确的是___________。
)与二甲硫醚结构相似,关于两者物理性质比较及原因解释正确的是___________。| A.二甲醚熔点相对更高,因为二甲醚分子间存在氢键,作用更强 |
| B.二甲硫醚熔点相对更高,因为二甲硫醚相对分子质量更大,范德华力更强 |
| C.二甲醚水溶性相对更好,因为二甲醚能与水形成氢键 |
| D.二甲硫醚水溶性相对更好,因为二甲硫醚能形成内盐 |
| A.电离 | B.电解 | C.电泳 | D.渗析 |
Ⅲ.脱硫木醋杆菌能将有机化合物中的硫(视作O价硫)转化为气体,此过程表示如下,该反应也是湿沼区域腐败臭味的来源之一
□
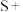 □CH₃COOH+□
□CH₃COOH+□ ___________
___________ +□
+□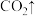
(7)完成并配平该反应(若化学计量数为1可不写)
(8)若产生的气体在标准状况下体积为672 mL,转移电子数为
(9)脱硫木醋杆菌利用该反应获取能量,简要分析该反应的自发性
您最近一年使用:0次
名校
解题方法
10 . 官能团决定着有机物的性质,官能团的转化是有机合成的主要方式之一。
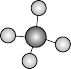
(1)甲烷是最简单的有机物。通过甲烷分子的球棍模型不能得出的信息是_______。
(2)酒精是一种常见的含氧衍生物。关于75%酒精的叙述的是_______。
(3)丙烯二聚体CH2=CHCH2CH(CH3)2是合成“人工肺”(ECMO)设备膜丝的重要原料,下列关于丙烯二聚体说法正确的是_______。
(1)甲烷是最简单的有机物。通过甲烷分子的球棍模型不能得出的信息是_______。

| A.C-H的共用电子对偏向C原子 |
| B.正四面体结构 |
| C.非极性分子 |
| D.二氯取代物只有一种 |
(2)酒精是一种常见的含氧衍生物。关于75%酒精的叙述的是_______。
| A.能够消毒、杀菌 | B.必须避光保存 |
| C.在空气中易氧化变质 | D.可直接用于制乙烯 |
(3)丙烯二聚体CH2=CHCH2CH(CH3)2是合成“人工肺”(ECMO)设备膜丝的重要原料,下列关于丙烯二聚体说法正确的是_______。
| A.加聚产物可以使溴水褪色 |
B.与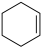 互为同分异构体 互为同分异构体 |
| C.催化加氢生成的一氯代物有4种 |
| D.完全燃烧与等质量丙烯耗氧量相同 |
您最近一年使用:0次



