名校
解题方法
1 .  为尖晶石型锰系锂离子电池材料,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。电池充电过程的总反应可表示为:
为尖晶石型锰系锂离子电池材料,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。电池充电过程的总反应可表示为: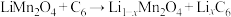 。已知:充放电前后晶体中锰的化合价只有+3、+4,分别表示为Mn(III)、Mn(IV)。
。已知:充放电前后晶体中锰的化合价只有+3、+4,分别表示为Mn(III)、Mn(IV)。
 为尖晶石型锰系锂离子电池材料,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。电池充电过程的总反应可表示为:
为尖晶石型锰系锂离子电池材料,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。电池充电过程的总反应可表示为: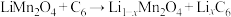 。已知:充放电前后晶体中锰的化合价只有+3、+4,分别表示为Mn(III)、Mn(IV)。
。已知:充放电前后晶体中锰的化合价只有+3、+4,分别表示为Mn(III)、Mn(IV)。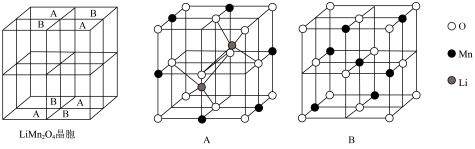
A.每个晶胞含8个 |
B.立方单元B中Mn、O原子个数比为 |
C.放电时,正极反应为 |
D.若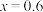 ,则充电后材料中Mn(Ⅲ)与Mn(Ⅳ)的比值为 ,则充电后材料中Mn(Ⅲ)与Mn(Ⅳ)的比值为 |
您最近一年使用:0次
2024-01-19更新
|
581次组卷
|
5卷引用:河南省郑州市宇华实验学校2023-2024学年高三下学期开学化学试题
名校
2 . 利用超分子可分离C60和C70,将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法正确的是

| A.杯酚与C60形成氢键 |
| B.C60与C70晶体类型不同 |
| C.该分离过程利用的是超分子的分子识别特征 |
| D.一个C60晶胞中含有8个C60分子 |
您最近一年使用:0次
2024-01-11更新
|
500次组卷
|
5卷引用:广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题
名校
解题方法
3 . BTCu是荧光增强型Cu2+荧光分子探针,可对环境和生物体内的微量Cu2+进行有效检测。BTCu识别Cu2+机理如下图:

回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。
(2)BTCu中所含第二周期元素的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(3)探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有配合形式的参与。1molBTCu-Cu+中,Cu+形成的配位键有___________ mol,B原子的杂化轨道类型是___________ 。
(4)某晶体的晶胞结构如下图所示。已知:a=b=0.524 nm,c-1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。(1nm=1×10-7cm)

①距离Fe最近且等距的S有___________ 个。
②该晶体的化学式是___________ 。
③该晶体的密度是___________ g/cm3 (列出计算式)。

回答下列问题:
(1)基态Cu原子的价电子排布式为
(2)BTCu中所含第二周期元素的第一电离能由小到大的顺序为
(3)探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有配合形式的参与。1molBTCu-Cu+中,Cu+形成的配位键有
(4)某晶体的晶胞结构如下图所示。已知:a=b=0.524 nm,c-1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。(1nm=1×10-7cm)

①距离Fe最近且等距的S有
②该晶体的化学式是
③该晶体的密度是
您最近一年使用:0次
名校
解题方法
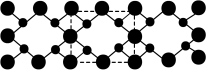
4 . 我国科学家构建了新型催化剂“纳米片” ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:
(1)基态Co原子的价层电子排布式为_______ ,N、C、Co中第一电离能最大的是_______ (填元素符号)。
(2)在空气中 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用_______ 杂化。已知氧族元素氢化物的熔沸点高低顺序为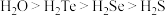 ,其原因是
,其原因是_______ 。
(3)氰 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为_______ 。
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为_______ 。
 ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中
 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用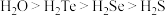 ,其原因是
,其原因是(3)氰
 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为

您最近一年使用:0次
2024-01-01更新
|
188次组卷
|
3卷引用:山东省菏泽市东明县第一中学2023-2024学年高二下学期开学化学试题
名校
解题方法
5 . 回答下列问题:
(1)金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]和Fe(CO)x等。
①基态氧原子的价电子排布式为___________ 。
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是___________ 、___________ 。
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____ 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________ (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___________ 。已知该晶胞的密度为 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=___________ cm。(用含p、NA的计算式表示)___________ 。
a.第一电离能大小:S>P>Si
b.电负性顺序:C<N<O<F
c.因为晶格能CaO比KC1高,所以KCl比CaO熔点低
d.SO2与CO2的化学性质类似,分子结构也都呈直线形,相同条件下SO2的溶解度更大
(1)金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]和Fe(CO)x等。
①基态氧原子的价电子排布式为
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为
 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
a.第一电离能大小:S>P>Si
b.电负性顺序:C<N<O<F
c.因为晶格能CaO比KC1高,所以KCl比CaO熔点低
d.SO2与CO2的化学性质类似,分子结构也都呈直线形,相同条件下SO2的溶解度更大
您最近一年使用:0次
名校
解题方法
6 . 钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。
(1)基态钛原子的电子排布式为___________
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为___________ (用元素符号表示);SO 的空间构型为
的空间构型为___________ ,其中S原子的杂化方式为___________ 。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是___________ (选填字母序号)。
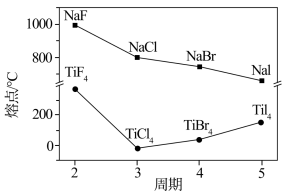
a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
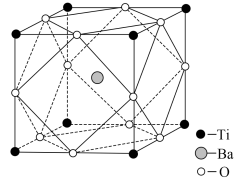
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为___________ ;晶体中每个钡离子周围与其距离最近且相等的氧离子的数量是___________ ;其晶胞参数约为a pm,钛酸钡晶体的密度ρ=___________ g·cm-3(阿伏加德罗常数的值为NA,1pm=1×10-12m)
(1)基态钛原子的电子排布式为
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为
 的空间构型为
的空间构型为(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是

a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为

您最近一年使用:0次
2023-12-28更新
|
217次组卷
|
2卷引用:北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷
名校
解题方法
7 . 碳族元素中的碳、硅、锗及其化合物在诸多领域具有重要用途。回答下列问题:
(1)锗元素位于周期表___________ 区,基态硅原子核外电子排布式为___________ ,基态碳原子核外有___________ 种不同运动状态的电子。
(2)草酸(分子式:H2C2O4,结构简式:HOOC-COOH)与NiSO4溶液反应,可制备NiC2O4∙2H2O。
①组成H2C2O4的元素中第一电离能最大的为___________ (填元素符号),该分子中σ键与π键的个数比为___________ 。
② 中的键角为
中的键角为___________ ,该离子的空间构型为___________ 。
(3)金刚石的结构及某碳硅化合物的晶胞结构如图所示,晶胞参数为anm。___________ (NA为阿伏加德罗常数的值,下同)。
②该碳硅化合物的化学式为___________ ,其晶体的密度为___________ g∙cm-3。
(1)锗元素位于周期表
(2)草酸(分子式:H2C2O4,结构简式:HOOC-COOH)与NiSO4溶液反应,可制备NiC2O4∙2H2O。
①组成H2C2O4的元素中第一电离能最大的为
②
 中的键角为
中的键角为(3)金刚石的结构及某碳硅化合物的晶胞结构如图所示,晶胞参数为anm。

②该碳硅化合物的化学式为
您最近一年使用:0次
2023-12-26更新
|
161次组卷
|
4卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高二下学期开学化学试题
8 . 某晶体的晶胞结构如图所示,黑球、白球均为 分子。下列说法正确的是
分子。下列说法正确的是
 分子。下列说法正确的是
分子。下列说法正确的是
A. 的配位数为6 的配位数为6 | B.该晶体属于共价晶体 |
| C.其硬度决定于共价键 | D.1个晶胞中含有240个碳原子 |
您最近一年使用:0次
2023-12-26更新
|
328次组卷
|
5卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高二下学期开学化学试题
名校
解题方法
9 . 铜、铁及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。
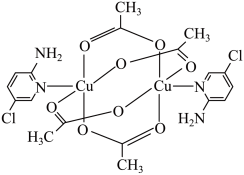
①基态氮原子的价层电子排布图为___________ ,在元素周期表中铜属于___________ (填“s”、“p”、“d”或“ds”)区。
②C.N、O元素原子的第一电离能由大到小的顺序为___________ 。
③X中 的配位数是
的配位数是___________ ,C原子的杂化轨道类型为___________ 。
(2)胆矾的简单平面结构式如图所示。
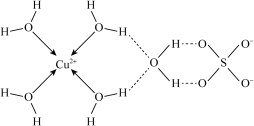
胆矾的化学式用配合物的形式可表示为___________ ;其阴离子的立体构型为___________ 。
(3)铁与硫能形成多种化合物,某种化合物的晶胞结构如下图所示。该化合物的化学式是___________ ;若该晶胞边长为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。
。

(1)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。

①基态氮原子的价层电子排布图为
②C.N、O元素原子的第一电离能由大到小的顺序为
③X中
 的配位数是
的配位数是(2)胆矾的简单平面结构式如图所示。

胆矾的化学式用配合物的形式可表示为
(3)铁与硫能形成多种化合物,某种化合物的晶胞结构如下图所示。该化合物的化学式是
 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
2023-12-19更新
|
248次组卷
|
2卷引用:四川省遂宁市射洪市四川省射洪中学校2023-2024学年高三下学期开学理综试题-高中化学
10 . 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图所示。下列说法不正确 的是
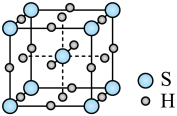

| A.该晶体属于分子晶体 |
| B.S位于元素周期表p区 |
C.该物质的化学式为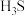 |
| D.与S等距且最近的H的个数为6 |
您最近一年使用:0次
2023-12-14更新
|
212次组卷
|
4卷引用:北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题
北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题辽宁省沈阳市同泽高级中学2023-2024学年高二上学期第二次月考化学试题(已下线)T9-物质结构与性质(已下线)选择题11-15



