名校
解题方法
1 . 硒(Se)是一种非金属元素。可用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1)基态Se原子的价层电子轨道表示式为_______ 。
(2)比较键角大小:气态SeO3分子_______ SeO 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(3)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因是_______ 。
(4)Cu2−xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。

①下列说法正确的是_______ 。
a.每个Cu2−xSe晶胞中Cu2+个数为x
b.每个Na2Se晶胞完全转化为Cu2−xSe晶胞,转移电子数为8
c.每个NaCuSe晶胞中0价Cu原子个数为1−x
d.当NayCu2−xSe转化为NaCuSe时,每转移(1−y)mol电子,产生(1−x)molCu原子
②设阿伏伽德罗常数的值为NA,Na2Se晶胞参数为anm,Na2Se晶体的密度为_______ g/cm3(用含a、NA的代数式表示,不考虑晶胞中的0价Cu原子)。
(5)电解铜的阳极泥中含有硒元素(以Se单质和Na2Se的形式存在)。称取5.000g电解铜阳极泥样品,以合适方法溶解,将硒元素转化为H2SeO3,配成250.0mL混酸溶液。移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol/LKMnO4标准溶液,将H2SeO3氧化为H2SeO4。反应完全后,用0.05000mol/L(NH4)2Fe(SO4)2标准溶液滴至终点,消耗(NH4)2Fe(SO4)2标准溶液15.00mL。则电解铜阳极泥样品中Se的质量分数为_______ 。
(1)基态Se原子的价层电子轨道表示式为
(2)比较键角大小:气态SeO3分子
 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(3)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因是
| 有机物 | 甲醇 | 甲硫醇(CH3SH) | 甲硒醇 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |
(4)Cu2−xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。

①下列说法正确的是
a.每个Cu2−xSe晶胞中Cu2+个数为x
b.每个Na2Se晶胞完全转化为Cu2−xSe晶胞,转移电子数为8
c.每个NaCuSe晶胞中0价Cu原子个数为1−x
d.当NayCu2−xSe转化为NaCuSe时,每转移(1−y)mol电子,产生(1−x)molCu原子
②设阿伏伽德罗常数的值为NA,Na2Se晶胞参数为anm,Na2Se晶体的密度为
(5)电解铜的阳极泥中含有硒元素(以Se单质和Na2Se的形式存在)。称取5.000g电解铜阳极泥样品,以合适方法溶解,将硒元素转化为H2SeO3,配成250.0mL混酸溶液。移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol/LKMnO4标准溶液,将H2SeO3氧化为H2SeO4。反应完全后,用0.05000mol/L(NH4)2Fe(SO4)2标准溶液滴至终点,消耗(NH4)2Fe(SO4)2标准溶液15.00mL。则电解铜阳极泥样品中Se的质量分数为
您最近一年使用:0次
2 . LFP是一种常见的锂离子电池正极材料,其中含有LiFePO4、炭黑、铝箔。利用废弃LFP正极材料回收金属、选择性提锂的工艺流程如下图所示。
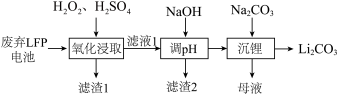
回答下列问题:
(1)Fe位于元素周期表的第___________ 周期___________ 族。
(2)若“滤渣1”中含有炭黑和FePO4,则“氧化浸取”中生成FePO4的离子方程式为___________ 。
(3)“滤渣2”的主要成分是___________ 。
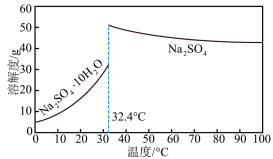
(4) 和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、___________ 、干燥。
(5)利用FePO4和Li2CO3与葡萄糖在氮气氛围中加热能制备LiFePO4和CO,则发生的化学方程式为___________ 。
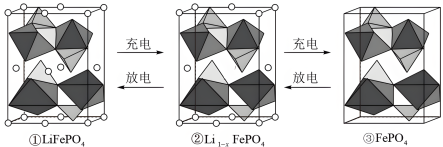
(6)LiFePO4的晶胞结构如图①所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,LiFeO4脱出部分 ,转化为
,转化为 (图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为
(图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为___________ g/cm3,LiFeO4转化 的电极反应式为
的电极反应式为___________ 。

回答下列问题:
(1)Fe位于元素周期表的第
(2)若“滤渣1”中含有炭黑和FePO4,则“氧化浸取”中生成FePO4的离子方程式为
(3)“滤渣2”的主要成分是
(4)
 和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
(5)利用FePO4和Li2CO3与葡萄糖在氮气氛围中加热能制备LiFePO4和CO,则发生的化学方程式为
(6)LiFePO4的晶胞结构如图①所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,LiFeO4脱出部分
 ,转化为
,转化为 (图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为
(图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为 的电极反应式为
的电极反应式为
您最近一年使用:0次
名校
3 . 2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯 与四氟乙烯
与四氟乙烯 的共聚物(ETFE)制成。回答下列问题:
的共聚物(ETFE)制成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_______ 。
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填标号),判断的根据是_______ ;第三电离能的变化图是_______ (填标号)。

(3)氟化氢的沸点高于氯化氢的原因是_______ 。
(4)聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______ 。
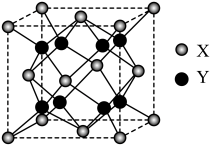
(5)萤石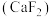 是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______ ;若该立方晶胞参数为a pm,正负离子的核间距最小为_______ pm。
 与四氟乙烯
与四氟乙烯 的共聚物(ETFE)制成。回答下列问题:
的共聚物(ETFE)制成。回答下列问题:(1)基态F原子的价电子排布图(轨道表示式)为
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(3)氟化氢的沸点高于氯化氢的原因是
(4)聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因
(5)萤石
 是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
您最近一年使用:0次
名校
解题方法
4 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1)碘元素在周期表中的位置是___________ 。
(2)漂白液的有效成分是 ,工业制备漂白液的离子方程式是
,工业制备漂白液的离子方程式是___________ 。
(3)卤族元素化合物的性质有相似性和递变性,下列说法不正确 的是___________。
(4) 的结构与
的结构与 类似,但是性质差异较大。
类似,但是性质差异较大。
① 的
的 模型名称为
模型名称为___________ 。
②沸点NF3___________ NH3(填“ ”“
”“ "或“
"或“ ”),原因是
”),原因是___________ 。
③ 具有碱性(可与
具有碱性(可与 结合)而
结合)而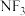 没有碱性,原因是
没有碱性,原因是___________ 。
(5)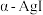 晶体,可以通过加热
晶体,可以通过加热 晶体制得。两种晶体的晶胞示意图如图所示,图中只画出了
晶体制得。两种晶体的晶胞示意图如图所示,图中只画出了 在晶胞中的位置,
在晶胞中的位置, 主要分布在由
主要分布在由 构成的四面体、八面体等空隙中。
构成的四面体、八面体等空隙中。


①在电场作用下, 不需要克服太大的阻力即可发生迁移。因此,
不需要克服太大的阻力即可发生迁移。因此,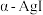 晶体在电池中可作为
晶体在电池中可作为___________ 。
② 晶胞中,距离每个
晶胞中,距离每个 最近的
最近的 的个数是
的个数是___________ 。
③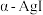 晶胞和
晶胞和 晶胞的体积比是
晶胞的体积比是___________ 。
| 元素 |  |  |  |  |  |  |
| 电负性 | 2.1 | 3.0 | 4.0 | 3.0 | 2.8 | 2.5 |
(1)碘元素在周期表中的位置是
(2)漂白液的有效成分是
 ,工业制备漂白液的离子方程式是
,工业制备漂白液的离子方程式是(3)卤族元素化合物的性质有相似性和递变性,下列说法
A. 沸点依次升高 沸点依次升高 |
B. 的稳定性依次升高 的稳定性依次升高 |
C. 熔点依次升高 熔点依次升高 |
D.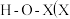 代表 代表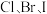 )的酸性随着 )的酸性随着 的原子序数递增逐渐增强 的原子序数递增逐渐增强 |
(4)
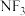 的结构与
的结构与 类似,但是性质差异较大。
类似,但是性质差异较大。①
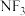 的
的 模型名称为
模型名称为②沸点NF3
 ”“
”“ "或“
"或“ ”),原因是
”),原因是③
 具有碱性(可与
具有碱性(可与 结合)而
结合)而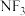 没有碱性,原因是
没有碱性,原因是(5)
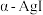 晶体,可以通过加热
晶体,可以通过加热 晶体制得。两种晶体的晶胞示意图如图所示,图中只画出了
晶体制得。两种晶体的晶胞示意图如图所示,图中只画出了 在晶胞中的位置,
在晶胞中的位置, 主要分布在由
主要分布在由 构成的四面体、八面体等空隙中。
构成的四面体、八面体等空隙中。

①在电场作用下,
 不需要克服太大的阻力即可发生迁移。因此,
不需要克服太大的阻力即可发生迁移。因此,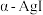 晶体在电池中可作为
晶体在电池中可作为②
 晶胞中,距离每个
晶胞中,距离每个 最近的
最近的 的个数是
的个数是③
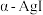 晶胞和
晶胞和 晶胞的体积比是
晶胞的体积比是
您最近一年使用:0次
名校
解题方法
5 . 美国某大学一课题组在金属有机框架(MOF)中成功构筑了含有双核镍氢中心 的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题:
的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题: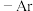 ,
, 为芳烃基,
为芳烃基, ,
,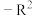 为烃基。
为烃基。
(1)基态镍原子的价层电子排布式为___________ 。
(2)甲、乙、丙、丁四种物质中,碳原子共有___________ 种杂化类型,这四种物质都含有的化学键类型为___________ (填标号)。
A.σ键和π键 B.氢键 C.极性键 D.非极性键
(3)双镍催化剂中,镍原子提供___________ (填“空轨道”或“孤电子对”,下同),氮原子提供___________ 形成配位键。
(4)上述物质所含第二周期元素中,第一电离能由大到小的顺序为___________ (填元素符号,下同),电负性由小到大的顺序为___________ 。
(5)一种镍铌合金的晶胞结构如图所示。镍、铌原子的最近距离为___________ pm。该晶体密度为___________  。已知:
。已知: 为阿伏加德罗常数的值,c>2a。
为阿伏加德罗常数的值,c>2a。
 的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题:
的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题: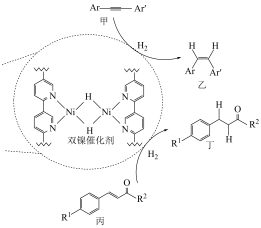
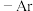 ,
, 为芳烃基,
为芳烃基, ,
,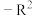 为烃基。
为烃基。(1)基态镍原子的价层电子排布式为
(2)甲、乙、丙、丁四种物质中,碳原子共有
A.σ键和π键 B.氢键 C.极性键 D.非极性键
(3)双镍催化剂中,镍原子提供
(4)上述物质所含第二周期元素中,第一电离能由大到小的顺序为
(5)一种镍铌合金的晶胞结构如图所示。镍、铌原子的最近距离为
 。已知:
。已知: 为阿伏加德罗常数的值,c>2a。
为阿伏加德罗常数的值,c>2a。
您最近一年使用:0次
2024-02-25更新
|
343次组卷
|
5卷引用:四川省雅安市雅安中学等校联考2023-2024学年高三下学期开学考试理综试题-高中化学
名校
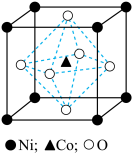
6 . 磁性形状记忆材料Cu-Mn-Al合金的晶胞如图所示,Mn、Al位于Cu形成的立方体体心。下列说法正确的是

| A.Mn和Cu均位于元素周期表d区 | B.该合金的化学式为AlMnCu2 |
| C.与Cu距离最近且相等的Cu有12个 | D.温度升高该合金电导率升高 |
您最近一年使用:0次
2024-02-25更新
|
408次组卷
|
3卷引用:湖北省新高考协作体2023-2024学年高三下学期2月收心考试化学试题
名校
解题方法
7 . 氟元素可形成多种有工业价值和科研价值的化合物,如 等。
等。
(1)基态F原子核外电子有___________ 种空间运动状态,下列为氟原子激发态的电子排布式的是___________ (填序号)。
A. B.
B. C.
C.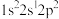 D.
D.
(2) 通入稀
通入稀 溶液中可生成
溶液中可生成 ,
, 分子的构型为
分子的构型为___________ ,其中氧原子的杂化方式为___________ 。
(3) 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的熔点(192℃),其原因是
的熔点(192℃),其原因是___________ 。
(4)石墨与 在450℃反应,石墨层间插入F得到层状结构化合物
在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 中
中 键的键长比石墨中
键的键长比石墨中 键的
键的___________ (填“长”或“短”)。 及清洗剂
及清洗剂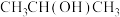 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为___________ , 氟硼酸铵(
氟硼酸铵( )中含有
)中含有___________ mol配位键。
(6)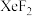 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 ,已知
,已知 键的键长为rpm,则B点原子的分数坐标为
键的键长为rpm,则B点原子的分数坐标为___________ ;晶胞中A、B间的距离
___________ pm(用含a、c、r的计算式表示)。
 等。
等。(1)基态F原子核外电子有
A.
 B.
B. C.
C.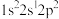 D.
D.
(2)
 通入稀
通入稀 溶液中可生成
溶液中可生成 ,
, 分子的构型为
分子的构型为(3)
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的熔点(192℃),其原因是
的熔点(192℃),其原因是(4)石墨与
 在450℃反应,石墨层间插入F得到层状结构化合物
在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 中
中 键的键长比石墨中
键的键长比石墨中 键的
键的
 及清洗剂
及清洗剂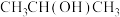 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为 氟硼酸铵(
氟硼酸铵( )中含有
)中含有(6)
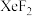 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 ,已知
,已知 键的键长为rpm,则B点原子的分数坐标为
键的键长为rpm,则B点原子的分数坐标为

您最近一年使用:0次
2024-02-25更新
|
350次组卷
|
3卷引用:四川省成都市石室中学2023-2024学年高三下学期开学考试理科综合试卷-高中化学
名校
解题方法
8 . 化学,让生活更美好。回答下列问题:
(1)乳酸亚铁 是一种常用的补铁剂。
是一种常用的补铁剂。
①基态 核外电子的空间运动状态有
核外电子的空间运动状态有__________ 种。
②乳酸分子中 键与
键与 键的数目比为
键的数目比为__________ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为__________ 。
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①该新药分子中有__________ 种不同化学环境的C原子。
②研究发现,适量硒酸钠 可减轻重金属铊引起的中毒。比较键角大小:
可减轻重金属铊引起的中毒。比较键角大小:
__________  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是__________ 。
(3) 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以 、
、 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,
。抗坏血酸的分子结构如图1所示, 晶胞如图2所示。
晶胞如图2所示。

①抗坏血酸的分子式是__________ , 的价层电子轨道表示式为
的价层电子轨道表示式为__________ 。
②下列说法中不正确 的是__________ 。
A.抗坏血酸分子中碳原子的轨道杂化类型为
B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸与足量氢气完全催化还原后的分子中有5个手性碳原子
D. 在水溶液中以
在水溶液中以 形式存在,
形式存在, 的配位原子为
的配位原子为
③ 晶胞为立方体,边长为
晶胞为立方体,边长为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度
为阿伏加德罗常数的值,则晶胞的密度
__________  。
。
(1)乳酸亚铁
 是一种常用的补铁剂。
是一种常用的补铁剂。①基态
 核外电子的空间运动状态有
核外电子的空间运动状态有②乳酸分子中
 键与
键与 键的数目比为
键的数目比为③乳酸亚铁中各元素的电负性由大到小的顺序为
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①该新药分子中有
②研究发现,适量硒酸钠
 可减轻重金属铊引起的中毒。比较键角大小:
可减轻重金属铊引起的中毒。比较键角大小:
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是(3)
 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以 、
、 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,
。抗坏血酸的分子结构如图1所示, 晶胞如图2所示。
晶胞如图2所示。
①抗坏血酸的分子式是
 的价层电子轨道表示式为
的价层电子轨道表示式为②下列说法中
A.抗坏血酸分子中碳原子的轨道杂化类型为

B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸与足量氢气完全催化还原后的分子中有5个手性碳原子
D.
 在水溶液中以
在水溶液中以 形式存在,
形式存在, 的配位原子为
的配位原子为
③
 晶胞为立方体,边长为
晶胞为立方体,边长为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度
为阿伏加德罗常数的值,则晶胞的密度
 。
。
您最近一年使用:0次
9 . 随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
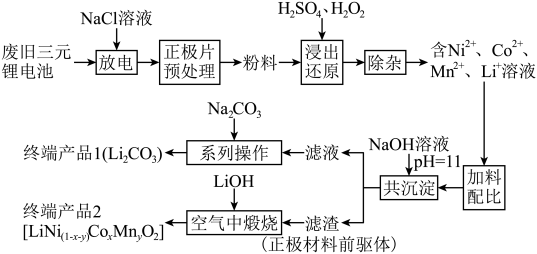
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第_______ 周期第_______ 族。
(2)写出粉料中的 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:______________________________________________ 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为_______  ,浸出时间为
,浸出时间为_______  。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:_____________________ 。

(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式_____________________ 。
(5)“共沉淀”后的滤液中含有大量 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:_______ 、_______ 、洗涤、干燥。
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为_______ ;已知晶胞参数为 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
_______  。(列出计算式)
。(列出计算式)

查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为
 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第
(2)写出粉料中的
 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为
 ,浸出时间为
,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式
(5)“共沉淀”后的滤液中含有大量
 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为
 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
名校
解题方法
10 . 氧族元素Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
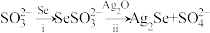
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表___________ 区。
②SeSO 的空间结构是
的空间结构是___________ 。
③过程ii中SeSO 一定断裂的化学键是
一定断裂的化学键是___________ 。
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由___________ 。
②NH 中H—N—H键角
中H—N—H键角___________ (填“>”或“<”)NH3中H—N—H键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为___________ g·cm-3。(1nm=10-7cm)
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。
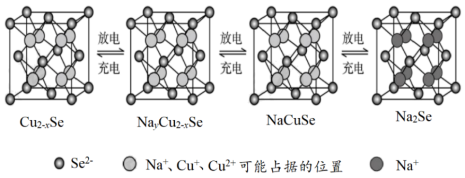
每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为___________ 。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO
 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下: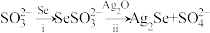
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表
②SeSO
 的空间结构是
的空间结构是③过程ii中SeSO
 一定断裂的化学键是
一定断裂的化学键是(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由
②NH
 中H—N—H键角
中H—N—H键角③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。

每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为
您最近一年使用:0次
2024-02-23更新
|
421次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三下学期开学考化学试题



