名校
解题方法
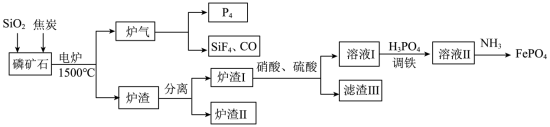
1 . “刀片电池”通过结构创新,大大提升了磷酸铁锂电池的能量密度。以下是以磷矿石(主要成分Ca5(PO4)3F,还有Fe2O3、CaCO3等杂质)为原料生产白磷(P4)同时制得刀片电池正极材料FePO4的工艺流程:
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷(P4)不溶于水但易溶于二硫化碳,说明P4是___________ (填“极性分子”或“非极性分子”)。
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:___________ 。
(3)炉渣Ⅱ的主要成分是___________ 。
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是___________ 。若此条件下Fe3+恰好完全转化为FePO4沉淀(当溶液中某离子浓度≤1×10−5mol/L时,可视为该离子沉淀完全),过滤,现往滤液中加入2mol/L的MgCl2溶液(设溶液体积增加1倍),此时溶液中___________ Mg3(PO4)2沉淀生成(填“有”或“无”或“无法确定”)【已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10−22、1.0×10−24】
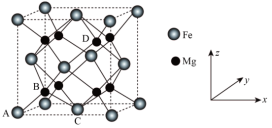
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示: ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为___________ 。此晶胞中Fe的配位数是___________ 。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷(P4)不溶于水但易溶于二硫化碳,说明P4是
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:
(3)炉渣Ⅱ的主要成分是
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示:
 ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为
您最近一年使用:0次
2024-02-03更新
|
741次组卷
|
3卷引用:重庆市荣昌中学校2023-2024学年高三下学期开学考试化学试题
名校
解题方法
2 . 碳和硫的化合物种类繁多,应用广泛。例如CS2是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。回答下列问题。
I.CCl4曾广泛用作溶剂、灭火剂。
(1)基态氯原子价层电子的空间运动状态有___________ 种。基态碳原子的价电子排布是否可以表示为 ,
,___________ (填“是”或“否”),原因为___________ 。
(2)CCl4在500℃以上时可以与水反应,产生有毒的光气(COCl2)。SiCl4常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有___________ (填标号)。
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角___________ (填“大于”、“小于”或“等于”)甲醛分子中H-C-H的键角,原因为___________ 。
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根( )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。硫代硫酸盐用于矿石提取银时形成 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为___________ (填标号),原因为___________ 。
a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=___________ 。原子b的分数坐标为(0,0,0),则原子a的分数坐标为___________ 。
I.CCl4曾广泛用作溶剂、灭火剂。
(1)基态氯原子价层电子的空间运动状态有
 ,
,(2)CCl4在500℃以上时可以与水反应,产生有毒的光气(COCl2)。SiCl4常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根(
 )中心原子的杂化方式为
)中心原子的杂化方式为 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=

您最近一年使用:0次
2024-02-02更新
|
469次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三下学期开学化学试题
名校
3 . 过渡金属的氮化物和碳化物都表现了较好的催化性能,由碳(C)、钨(W)两种元素形成的两种碳化物甲(晶胞边长为a nm)和乙(晶胞边长为b nm)的立方晶胞结构如图所示。下列说法正确的是


| A.碳化物甲的化学式为WC |
| B.晶体甲中与W原子距离最近的W原子有8个 |
C.晶胞乙中两个C原子最近距离为 nm nm |
D.甲、乙两种晶胞的密度比为 |
您最近一年使用:0次
2024-02-01更新
|
556次组卷
|
3卷引用:湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题
湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题江西省宜春市第一中学2023-2024学年高三上学期1月质量检测化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
4 .  提新型锂电池的正极材料,可由菱锰矿(主要含
提新型锂电池的正极材料,可由菱锰矿(主要含 ,含有少量Fe、Ni、Al等元素)经过如下过程制得:
,含有少量Fe、Ni、Al等元素)经过如下过程制得:

(1)“酸浸”时使用硫酸,浸出液中主要含有的金属阳离子是 ,还含有少量
,还含有少量 、
、 和
和 。“氧化”时向浸出液中滴加
。“氧化”时向浸出液中滴加 溶液除去
溶液除去 ,当
,当 溶液滴加过量后,溶液中
溶液滴加过量后,溶液中 的物质的量逐渐减小,原因是
的物质的量逐渐减小,原因是___________ 。
(2)“除杂”时先调节溶液的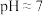 ,将
,将 和
和 沉淀完全,继续向溶液中加入BaS固体(可溶于水),可将
沉淀完全,继续向溶液中加入BaS固体(可溶于水),可将 转化为NiS沉淀。当
转化为NiS沉淀。当 沉淀完全而
沉淀完全而 不沉淀的原因是
不沉淀的原因是___________ 。[已知金属离子浓度小于 mol⋅L-1时可认为沉淀完全,除杂时溶液中
mol⋅L-1时可认为沉淀完全,除杂时溶液中 mol⋅L-1。
mol⋅L-1。 ,
, ]
]
(3)“电解”时可制得 ,同时电解液可循环使用。电解液中可循环使用的物质是
,同时电解液可循环使用。电解液中可循环使用的物质是___________ 。
(4) 的一种晶胞结构如下图甲所示,图甲中表示出晶胞的边长及坐标轴,晶胞中部分
的一种晶胞结构如下图甲所示,图甲中表示出晶胞的边长及坐标轴,晶胞中部分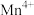 和
和 未标出,图乙为沿y轴方向晶胞投影图,图丙为沿z轴方向晶胞投影图,请在图甲上用“●”和“○”补充完整所缺的
未标出,图乙为沿y轴方向晶胞投影图,图丙为沿z轴方向晶胞投影图,请在图甲上用“●”和“○”补充完整所缺的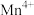 和
和 。
。_________
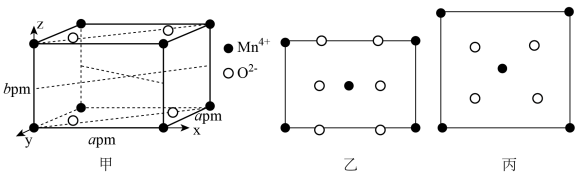
(5)将 与
与 固体混合煅烧可制得
固体混合煅烧可制得 ,为测定制得
,为测定制得 样品的纯度,现进行如下实验:称取0.800 g样品,加入足量硫酸和10.00 mL 1.000 mol⋅L-1的
样品的纯度,现进行如下实验:称取0.800 g样品,加入足量硫酸和10.00 mL 1.000 mol⋅L-1的 溶液,充分反应后,用0.100 mol⋅L-1
溶液,充分反应后,用0.100 mol⋅L-1  标准溶液滴定过量的
标准溶液滴定过量的 ,到达滴定终点时消耗
,到达滴定终点时消耗 标准溶液16.00 mL。计算
标准溶液16.00 mL。计算 样品的纯度并写出计算过程
样品的纯度并写出计算过程_________ 。实验中发生反应的离子方程式为: (未配平);
(未配平); (未配平)。
(未配平)。
 提新型锂电池的正极材料,可由菱锰矿(主要含
提新型锂电池的正极材料,可由菱锰矿(主要含 ,含有少量Fe、Ni、Al等元素)经过如下过程制得:
,含有少量Fe、Ni、Al等元素)经过如下过程制得:
(1)“酸浸”时使用硫酸,浸出液中主要含有的金属阳离子是
 ,还含有少量
,还含有少量 、
、 和
和 。“氧化”时向浸出液中滴加
。“氧化”时向浸出液中滴加 溶液除去
溶液除去 ,当
,当 溶液滴加过量后,溶液中
溶液滴加过量后,溶液中 的物质的量逐渐减小,原因是
的物质的量逐渐减小,原因是(2)“除杂”时先调节溶液的
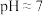 ,将
,将 和
和 沉淀完全,继续向溶液中加入BaS固体(可溶于水),可将
沉淀完全,继续向溶液中加入BaS固体(可溶于水),可将 转化为NiS沉淀。当
转化为NiS沉淀。当 沉淀完全而
沉淀完全而 不沉淀的原因是
不沉淀的原因是 mol⋅L-1时可认为沉淀完全,除杂时溶液中
mol⋅L-1时可认为沉淀完全,除杂时溶液中 mol⋅L-1。
mol⋅L-1。 ,
, ]
](3)“电解”时可制得
 ,同时电解液可循环使用。电解液中可循环使用的物质是
,同时电解液可循环使用。电解液中可循环使用的物质是(4)
 的一种晶胞结构如下图甲所示,图甲中表示出晶胞的边长及坐标轴,晶胞中部分
的一种晶胞结构如下图甲所示,图甲中表示出晶胞的边长及坐标轴,晶胞中部分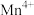 和
和 未标出,图乙为沿y轴方向晶胞投影图,图丙为沿z轴方向晶胞投影图,请在图甲上用“●”和“○”补充完整所缺的
未标出,图乙为沿y轴方向晶胞投影图,图丙为沿z轴方向晶胞投影图,请在图甲上用“●”和“○”补充完整所缺的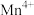 和
和 。
。
(5)将
 与
与 固体混合煅烧可制得
固体混合煅烧可制得 ,为测定制得
,为测定制得 样品的纯度,现进行如下实验:称取0.800 g样品,加入足量硫酸和10.00 mL 1.000 mol⋅L-1的
样品的纯度,现进行如下实验:称取0.800 g样品,加入足量硫酸和10.00 mL 1.000 mol⋅L-1的 溶液,充分反应后,用0.100 mol⋅L-1
溶液,充分反应后,用0.100 mol⋅L-1  标准溶液滴定过量的
标准溶液滴定过量的 ,到达滴定终点时消耗
,到达滴定终点时消耗 标准溶液16.00 mL。计算
标准溶液16.00 mL。计算 样品的纯度并写出计算过程
样品的纯度并写出计算过程 (未配平);
(未配平); (未配平)。
(未配平)。
您最近一年使用:0次
2024-01-29更新
|
301次组卷
|
2卷引用:江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷
名校
解题方法
5 . 红蓝宝石、祖母绿、金绿猫眼、钻石为举世公认的珍贵宝石。
(1)红宝石是刚玉的一种,主要成分为氧化铝( ),因含微量杂质元素铬(Cr)而呈红色。基态铬原子的简化电子排布式为
),因含微量杂质元素铬(Cr)而呈红色。基态铬原子的简化电子排布式为___________ 。
(2)祖母绿主要成分的化学式为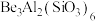 ,Be与Al的第一电离能大小关系为:I(Be)
,Be与Al的第一电离能大小关系为:I(Be)___________ I(Al)。Be和Al一样,能与NaOH溶液反应,请简单说明判断依据:___________ 。
(3)金绿猫眼主要成分的化学式为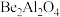 ,经碱熔酸浸可得到
,经碱熔酸浸可得到 和
和 ,
, 分子的空间构型为
分子的空间构型为___________ 。 常以二聚分子
常以二聚分子 的形式存在,分子中所有原子均达到8稳定结构,请画出
的形式存在,分子中所有原子均达到8稳定结构,请画出 的结构式:
的结构式:___________ 。 分子中铝的杂化类型
分子中铝的杂化类型___________ 。
(4)钻石是经过琢磨的金刚石,金刚石熔点高于晶体硅,原因为___________ 。金刚石晶胞结构如图所示,与晶胞面心处碳原子距离最近且等距离的碳原子数为___________ 。
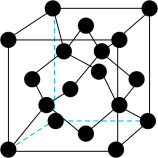
(5)该晶胞空间利用率___________ (用含的π式子表示)。
(1)红宝石是刚玉的一种,主要成分为氧化铝(
 ),因含微量杂质元素铬(Cr)而呈红色。基态铬原子的简化电子排布式为
),因含微量杂质元素铬(Cr)而呈红色。基态铬原子的简化电子排布式为(2)祖母绿主要成分的化学式为
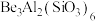 ,Be与Al的第一电离能大小关系为:I(Be)
,Be与Al的第一电离能大小关系为:I(Be)(3)金绿猫眼主要成分的化学式为
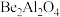 ,经碱熔酸浸可得到
,经碱熔酸浸可得到 和
和 ,
, 分子的空间构型为
分子的空间构型为 常以二聚分子
常以二聚分子 的形式存在,分子中所有原子均达到8稳定结构,请画出
的形式存在,分子中所有原子均达到8稳定结构,请画出 的结构式:
的结构式: 分子中铝的杂化类型
分子中铝的杂化类型(4)钻石是经过琢磨的金刚石,金刚石熔点高于晶体硅,原因为

(5)该晶胞空间利用率
您最近一年使用:0次
名校
6 . 有一种有超导性的硼镁化合物,晶体结构属于立方晶系。其晶体结构、晶胞沿 轴的投影图如图所示,关于其晶体下列说法正确的
轴的投影图如图所示,关于其晶体下列说法正确的
 轴的投影图如图所示,关于其晶体下列说法正确的
轴的投影图如图所示,关于其晶体下列说法正确的
A.该化合物的化学式为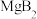 | B.一个晶胞中含有2个 |
C. 最近距离为 最近距离为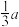 | D.与 距离最近且相等的 距离最近且相等的 有8个 有8个 |
您最近一年使用:0次
2024-01-22更新
|
741次组卷
|
4卷引用:四川省德阳外国语学校2023-2024学年高二下学期入学考试化学试题
四川省德阳外国语学校2023-2024学年高二下学期入学考试化学试题重庆市西南大学附中2023-2024学年高二上学期期末考试化学试题(已下线)微题型02 晶体结构及相关计算-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)重庆市西南大学附属中学校2023-2024学年高二上学期期末考试化学试题
7 . GaAs是5G时代不可或缺的半导体材料,其晶体结构与金刚石相似。将Mn参入GaAs晶体(图甲)可得到稀磁性半导体材料(图乙),晶体结构不变。设 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
| A.GaAs晶体的熔点比GaN晶体的高 |
| B.掺入Mn的晶体中Mn、Ga、As的原子个数比为5:27:32 |
C.图乙中a和c的原子坐标参数分别为(0,0,0)和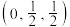 ,则b的原子坐标参数为(1,1,0) ,则b的原子坐标参数为(1,1,0) |
D.GaAs晶体的密度为 ,则该晶体中距离最近的两个镓原子的核间距为 ,则该晶体中距离最近的两个镓原子的核间距为 |
您最近一年使用:0次
2024-01-21更新
|
119次组卷
|
2卷引用:湖南省衡阳市衡阳县第二中学2023-2024学年高三下学期开学摸底考试化学试卷
名校
8 . 材料科学发展日新月异。

(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子 层上的未成对电子数为
层上的未成对电子数为_____ 。
(2)硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
① 中阴离子的立体构型是
中阴离子的立体构型是_____ 。
②在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为_____ ,提供孤电子对的成键原子是_____ 。
(3)将 应用于超导体、材料科学等领域的探索正在不断地深入。
应用于超导体、材料科学等领域的探索正在不断地深入。 的结构如图1,
的结构如图1, 分子中
分子中 键的数目为
键的数目为_____ 。 能在二硫化碳中溶解而不溶于水的原因是
能在二硫化碳中溶解而不溶于水的原因是_____ 。
(4)某金属 与
与 可制备一种超导材料,晶胞如图2所示,
可制备一种超导材料,晶胞如图2所示, 原子位于晶胞的棱上与内部。该材料的化学式为
原子位于晶胞的棱上与内部。该材料的化学式为_____ 。
(5)石墨的晶体结构如图3(甲)所示,碳原子的杂化方式为_____ ,图3(乙)虚线勾勒出的是其晶胞,则石墨晶胞含碳原子个数为_____ 个。
(6) 可形成两种配合物,已知
可形成两种配合物,已知 的配位数是6,为确定
的配位数是6,为确定 的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加
的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加 溶液时,产生白色沉淀;在第二种配合物溶液中加入
溶液时,产生白色沉淀;在第二种配合物溶液中加入 溶液时,无明显现象。第二种配合物的化学式为
溶液时,无明显现象。第二种配合物的化学式为_____ ,该配合物的配体是_____ 。

(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子
 层上的未成对电子数为
层上的未成对电子数为(2)硫酸镍溶于氨水形成
 蓝色溶液。
蓝色溶液。①
 中阴离子的立体构型是
中阴离子的立体构型是②在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为(3)将
 应用于超导体、材料科学等领域的探索正在不断地深入。
应用于超导体、材料科学等领域的探索正在不断地深入。 的结构如图1,
的结构如图1, 分子中
分子中 键的数目为
键的数目为 能在二硫化碳中溶解而不溶于水的原因是
能在二硫化碳中溶解而不溶于水的原因是(4)某金属
 与
与 可制备一种超导材料,晶胞如图2所示,
可制备一种超导材料,晶胞如图2所示, 原子位于晶胞的棱上与内部。该材料的化学式为
原子位于晶胞的棱上与内部。该材料的化学式为(5)石墨的晶体结构如图3(甲)所示,碳原子的杂化方式为
(6)
 可形成两种配合物,已知
可形成两种配合物,已知 的配位数是6,为确定
的配位数是6,为确定 的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加
的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加 溶液时,产生白色沉淀;在第二种配合物溶液中加入
溶液时,产生白色沉淀;在第二种配合物溶液中加入 溶液时,无明显现象。第二种配合物的化学式为
溶液时,无明显现象。第二种配合物的化学式为
您最近一年使用:0次
名校
解题方法
9 . 观察下列模型并结合信息,判断有关说法错误的是
| 晶体硼的结构单元 (有12个  原子) 原子) |  分子 分子 |  分子 分子 |  | |
| 结构模型 示意图 | 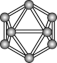 |  | 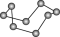 | 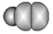 |
| A.固态硫S8中S原子为sp2杂化 |
| B.SF6中心原子的价层电子对数为6,其中S-F键的键长、键能均相等 |
| C.晶体硼的结构单元中含有30个B-B键,含20个正三角形 |
| D.HCN的结构式为H-C≡N |
您最近一年使用:0次
名校
10 . 一种从照相底片中回收单质银的方法如下:
步骤1:用 溶液浸泡照相底片,未曝光的
溶液浸泡照相底片,未曝光的 转化成
转化成 而溶解。
而溶解。
步骤2:在步骤1所得溶液中加稍过量 溶液,充分反应后过滤出黑色沉淀。
溶液,充分反应后过滤出黑色沉淀。
步骤3:将黑色沉淀在空气中灼烧,回收单质银。下列说法不正确的是
步骤1:用
 溶液浸泡照相底片,未曝光的
溶液浸泡照相底片,未曝光的 转化成
转化成 而溶解。
而溶解。步骤2:在步骤1所得溶液中加稍过量
 溶液,充分反应后过滤出黑色沉淀。
溶液,充分反应后过滤出黑色沉淀。步骤3:将黑色沉淀在空气中灼烧,回收单质银。下列说法不正确的是

A.步骤1所得 中 中 提供空轨道 提供空轨道 |
B.步骤2所得滤液中大量存在的离子: 、 、 、 、 、 、 |
C.步骤3灼烧时可用足量 溶液吸收尾气 溶液吸收尾气 |
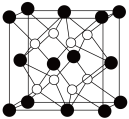
D. 晶胞如图所示,每个 晶胞如图所示,每个 周围距离最近的 周围距离最近的 有4个 有4个 |
您最近一年使用:0次
2024-01-21更新
|
221次组卷
|
2卷引用:江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷



