解题方法
1 . 钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
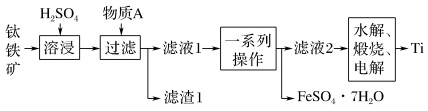
(1)溶浸过程中,为加快溶浸速率,通常可以采取的方法是___________ (写出1条即可)。物质A为___________ (填化学式)。
(2)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___________ 。“一系列操作”为蒸发浓缩、___________ 、过滤。
(3)“水解”步骤中生成TiO2·xH2O,“水解”反应为TiO2++(x+1)H2O=TiO2·xH2O↓+2H+,为提高TiO2·xH2O的产率,可采取的措施有___________ 。(写出1条即可)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO(含O2-)为电解质,阴极制得金属Ti 。阴极的电极反应式为___________ ;若阴极制得金属Ti 9.60g,则阳极产生气体___________ mol。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,同时产生一种气体,请写出反应的离子方程式___________ 。

(1)溶浸过程中,为加快溶浸速率,通常可以采取的方法是
(2)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为
(3)“水解”步骤中生成TiO2·xH2O,“水解”反应为TiO2++(x+1)H2O=TiO2·xH2O↓+2H+,为提高TiO2·xH2O的产率,可采取的措施有
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO(含O2-)为电解质,阴极制得金属Ti 。阴极的电极反应式为
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,同时产生一种气体,请写出反应的离子方程式
您最近一年使用:0次
2 . 在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所用仪器如图所示:

(1)盛放浓盐酸的仪器名称是_______ 。
(2)装置II中,盛放的试剂是_______ ;装置III中浓硫酸的作用是_______ 。
(3)装置V中反应的离子方程式为_______ 。
(4)装置I中反应的化学方程式为_______ ;该反应体现浓盐酸的_______ 性。
(5)实验室用下列方法制取氯气:
①用含 146g 氯化氢的浓盐酸与足量的二氧化锰反应;
②用 87g 二氧化锰与足量浓盐酸反应。
若不考虑氯化氢的挥发,则反应后所得氯气的质量_______ 。
A.①比②多 B. ②比①多 C. 两种方法一样多 D. 无法比较

(1)盛放浓盐酸的仪器名称是
(2)装置II中,盛放的试剂是
(3)装置V中反应的离子方程式为
(4)装置I中反应的化学方程式为
(5)实验室用下列方法制取氯气:
①用含 146g 氯化氢的浓盐酸与足量的二氧化锰反应;
②用 87g 二氧化锰与足量浓盐酸反应。
若不考虑氯化氢的挥发,则反应后所得氯气的质量
A.①比②多 B. ②比①多 C. 两种方法一样多 D. 无法比较
您最近一年使用:0次
名校
解题方法
3 . 亚硝酸钙[ ]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。

①已知: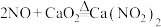 ;
;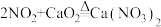 ;
;
②酸性条件下,NO能与 溶液反应生成
溶液反应生成 和
和 。
。
回答下列问题:
(1)检查装置的气密性,装入药品,实验开始前通入一段时间 ,然后关闭弹簧夹,再滴加稀硝酸,通入
,然后关闭弹簧夹,再滴加稀硝酸,通入 的作用是
的作用是___________ 。
(2)为达到实验目的,请把上述装置按气流方向进行连接:______
A→___________→B→___________→___________
(3)E装置的作用是___________ 。
(4)C装置中反应的离子方程式为___________ 。
(5)工业上可用石灰乳和硝酸工业的尾气(含 ,NO)反应,既能净化尾气,又能获得广泛的
,NO)反应,既能净化尾气,又能获得广泛的 ,反应原理为
,反应原理为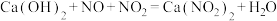 ,若
,若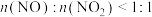 ,则会导致
,则会导致___________ 。
(6)将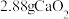 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为___________ mol。
 ]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
①已知:
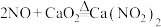 ;
;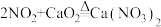 ;
;②酸性条件下,NO能与
 溶液反应生成
溶液反应生成 和
和 。
。回答下列问题:
(1)检查装置的气密性,装入药品,实验开始前通入一段时间
 ,然后关闭弹簧夹,再滴加稀硝酸,通入
,然后关闭弹簧夹,再滴加稀硝酸,通入 的作用是
的作用是(2)为达到实验目的,请把上述装置按气流方向进行连接:
A→___________→B→___________→___________
(3)E装置的作用是
(4)C装置中反应的离子方程式为
(5)工业上可用石灰乳和硝酸工业的尾气(含
 ,NO)反应,既能净化尾气,又能获得广泛的
,NO)反应,既能净化尾气,又能获得广泛的 ,反应原理为
,反应原理为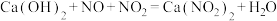 ,若
,若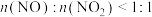 ,则会导致
,则会导致(6)将
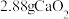 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为
您最近一年使用:0次
2024-03-15更新
|
582次组卷
|
3卷引用:陕西省西安铁一中学2023-2024学年高一上学期期末考试化学试题
名校
4 . 某研究小组利用下列装置在实验室制备氯气,并进行相关实验。请回答下列问题:
(1)写出实验室制取 的化学方程式
的化学方程式__________ 。
(2)实验室净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为__________ (用字母和“→”表示):
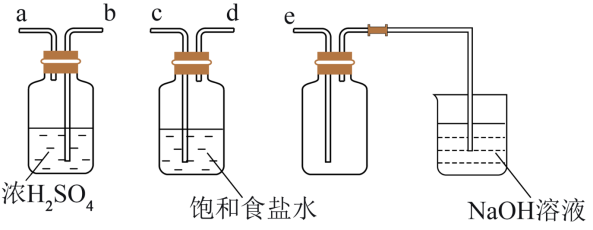
(3)某兴趣小组对“用稀盐酸和 混合加热不生成氯气”的原因进行探究,猜想如下:
混合加热不生成氯气”的原因进行探究,猜想如下:
猜想一:小明认为是 低导致;猜想二:小红认为是
低导致;猜想二:小红认为是__________ 导致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入 中,然后通入
中,然后通入 气体加热
气体加热
b.稀盐酸滴入 中,然后加入
中,然后加入 固体加热
固体加热
c.稀盐酸滴入 中,然后加入浓硫酸加热
中,然后加入浓硫酸加热
d. 与
与 的浓溶液混合加热
的浓溶液混合加热
e.浓硫酸与 固体、
固体、 固体共热
固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想__________ 成立。
(4)将氯气通入水中可得新制氯水,某学习小组拟用手持技术对广口瓶中新制饱和氯水进行检测,下列最有可能是其检测结果的图像是__________(填字母)。
(5)用 溶液吸收尾气时生成
溶液吸收尾气时生成 ,
, 是漂白液的有效成分,用离子方程式写出其漂白的原理(查资料可知生成了
是漂白液的有效成分,用离子方程式写出其漂白的原理(查资料可知生成了 :
:__________ 。
(6)已知某“84”消毒液瓶体部分标签如图所示:
①该“84”消毒液中 的物质的量浓度约为
的物质的量浓度约为__________  (结果精确至0.01)。
(结果精确至0.01)。
②欲用 固体配制
固体配制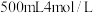 的
的 溶液。下列主要操作步骤的正确顺序是
溶液。下列主要操作步骤的正确顺序是__________ (填字母,下同)。
A.称取一定质量的 固体于烧杯中,用适量蒸馏水溶解;
固体于烧杯中,用适量蒸馏水溶解;
B.加水至液面离容量瓶刻度线下 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
C.待恢复至室温后,将溶液转移至容量瓶中;
D.盖好瓶塞,反复上下颠倒,摇匀;
E.用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液转移至容量瓶中。
③若实验遇下列情况,会导致所配溶液的物质的量浓度偏低的是__________ 。
A.容量瓶用蒸馏水洗净后,没烘干就直接使用
B.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
C.定容时俯视刻度线
D.定容后经振荡摇匀静置后,发现液面下降,再加适量的蒸馏水至刻度线
(1)写出实验室制取
 的化学方程式
的化学方程式(2)实验室净化与收集
 所需装置的接口连接顺序为
所需装置的接口连接顺序为
(3)某兴趣小组对“用稀盐酸和
 混合加热不生成氯气”的原因进行探究,猜想如下:
混合加热不生成氯气”的原因进行探究,猜想如下:猜想一:小明认为是
 低导致;猜想二:小红认为是
低导致;猜想二:小红认为是小组设计了以下实验方案进行验证:
a.稀盐酸滴入
 中,然后通入
中,然后通入 气体加热
气体加热b.稀盐酸滴入
 中,然后加入
中,然后加入 固体加热
固体加热c.稀盐酸滴入
 中,然后加入浓硫酸加热
中,然后加入浓硫酸加热d.
 与
与 的浓溶液混合加热
的浓溶液混合加热e.浓硫酸与
 固体、
固体、 固体共热
固体共热实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想
(4)将氯气通入水中可得新制氯水,某学习小组拟用手持技术对广口瓶中新制饱和氯水进行检测,下列最有可能是其检测结果的图像是__________(填字母)。
A. | B.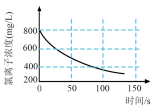 | C.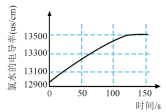 | D. |
(5)用
 溶液吸收尾气时生成
溶液吸收尾气时生成 ,
, 是漂白液的有效成分,用离子方程式写出其漂白的原理(查资料可知生成了
是漂白液的有效成分,用离子方程式写出其漂白的原理(查资料可知生成了 :
:(6)已知某“84”消毒液瓶体部分标签如图所示:
84消毒液 【有效成分】  【规格】  【质量分数】25% 【密度】 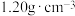 |
 的物质的量浓度约为
的物质的量浓度约为 (结果精确至0.01)。
(结果精确至0.01)。②欲用
 固体配制
固体配制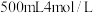 的
的 溶液。下列主要操作步骤的正确顺序是
溶液。下列主要操作步骤的正确顺序是A.称取一定质量的
 固体于烧杯中,用适量蒸馏水溶解;
固体于烧杯中,用适量蒸馏水溶解;B.加水至液面离容量瓶刻度线下
 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;C.待恢复至室温后,将溶液转移至容量瓶中;
D.盖好瓶塞,反复上下颠倒,摇匀;
E.用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液转移至容量瓶中。
③若实验遇下列情况,会导致所配溶液的物质的量浓度偏低的是
A.容量瓶用蒸馏水洗净后,没烘干就直接使用
B.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
C.定容时俯视刻度线
D.定容后经振荡摇匀静置后,发现液面下降,再加适量的蒸馏水至刻度线
您最近一年使用:0次
2024-02-02更新
|
39次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高一上学期11月期中考试化学试题
解题方法
5 . 在如图装置中,用NaOH溶液、铁粉、稀硫酸制备Fe(OH)2,下列说法错误的是
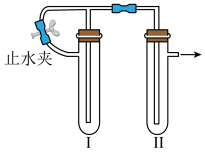

| A.Ⅱ中的试剂是NaOH溶液 |
B.Ⅰ中发生的离子反应为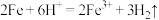 |
| C.实验过程中,应先打开止水夹 |
| D.最终在Ⅱ中产生白色沉淀Fe(OH)2 |
您最近一年使用:0次
6 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置制备 及其化合物
及其化合物 和NaClO,并探究其相关性质。回答下列问题:
和NaClO,并探究其相关性质。回答下列问题:
已知: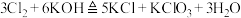
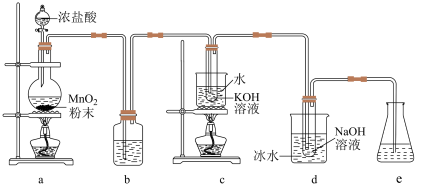
(1)写出制备氯气的化学方程式_______ 。
(2)b中的试剂为_______ ,若缺少b装置, 的产率会
的产率会_______ (填“升高”或“降低”)。
(3)d中采用冰水浴冷却的目的是_______ ,试管中发生反应的离子方程式是_______ 。
(4)e中可选用的试剂是_______(填字母)。
(5)将少量 和NaClO溶液分别滴加到1号和2号淀粉KI试纸上。1号试纸颜色不变,2号试纸变蓝色。可知该条件下
和NaClO溶液分别滴加到1号和2号淀粉KI试纸上。1号试纸颜色不变,2号试纸变蓝色。可知该条件下 的氧化能力
的氧化能力_______ (填“大于”或“小于”)NaClO。
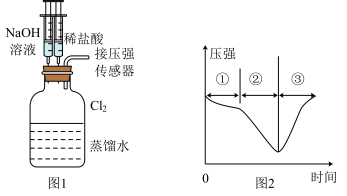
(6)若用制得的氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加NaOH溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法不正确的是_______(填字母)。
 及其化合物
及其化合物 和NaClO,并探究其相关性质。回答下列问题:
和NaClO,并探究其相关性质。回答下列问题:已知:
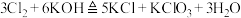

(1)写出制备氯气的化学方程式
(2)b中的试剂为
 的产率会
的产率会(3)d中采用冰水浴冷却的目的是
(4)e中可选用的试剂是_______(填字母)。
| A.稀盐酸 | B.NaCl溶液 | C.NaOH溶液 | D. 溶液 溶液 |
(5)将少量
 和NaClO溶液分别滴加到1号和2号淀粉KI试纸上。1号试纸颜色不变,2号试纸变蓝色。可知该条件下
和NaClO溶液分别滴加到1号和2号淀粉KI试纸上。1号试纸颜色不变,2号试纸变蓝色。可知该条件下 的氧化能力
的氧化能力(6)若用制得的氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加NaOH溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法不正确的是_______(填字母)。

| A.阶段①压强变小,只是因为氯气溶于水,此过程并未发生化学反应 |
| B.阶段②压强变小,该过程发生了氧化还原反应 |
C.阶段③发生反应的离子方程式为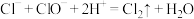 |
D.若将 换成 换成 ,所得的压强变化趋势与图2相似 ,所得的压强变化趋势与图2相似 |
您最近一年使用:0次
名校
7 . 现有一不纯的小苏打样品(含杂质 、
、 ),为测定
),为测定 的质量分数,设计如图所示的实验装置(夹持仪器未画出)。
的质量分数,设计如图所示的实验装置(夹持仪器未画出)。
说明:碱石灰为 、
、 的混合物,常用作干燥剂,也可以吸收
的混合物,常用作干燥剂,也可以吸收 气体。
气体。

实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取一定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟。
,缓缓鼓入空气数分钟。
④关闭活塞 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。
,点燃酒精灯加热至不再产生气体。
⑤打开活塞 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
回答下列问题:
(1)仪器E的名称是___________ ,其中盛放的药品是___________ ;若无该装置,则会导致测得的 的质量分数
的质量分数__________ 。(填“偏大”“偏小”或“无影响”)
(2)步骤③的目的是_____________________________________________________ 。
(3)装置B中发生反应的化学方程式为___________________ ,________________ 。
(4)若实验中称取样品的质量为50.0g,反应后C、D装置增加的质量分别为12.6g、8.8g,则混合物中 的质量分数为
的质量分数为________ ,杂质 的质量为
的质量为________ g。
 、
、 ),为测定
),为测定 的质量分数,设计如图所示的实验装置(夹持仪器未画出)。
的质量分数,设计如图所示的实验装置(夹持仪器未画出)。说明:碱石灰为
 、
、 的混合物,常用作干燥剂,也可以吸收
的混合物,常用作干燥剂,也可以吸收 气体。
气体。
实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取一定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞
 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟。
,缓缓鼓入空气数分钟。④关闭活塞
 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。
,点燃酒精灯加热至不再产生气体。⑤打开活塞
 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。回答下列问题:
(1)仪器E的名称是
 的质量分数
的质量分数(2)步骤③的目的是
(3)装置B中发生反应的化学方程式为
(4)若实验中称取样品的质量为50.0g,反应后C、D装置增加的质量分别为12.6g、8.8g,则混合物中
 的质量分数为
的质量分数为 的质量为
的质量为
您最近一年使用:0次
名校
解题方法
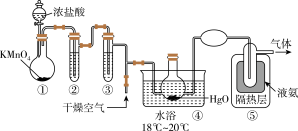
8 .  是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与还原剂接触或加热时会发生燃烧并爆炸。
是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与还原剂接触或加热时会发生燃烧并爆炸。
已知: 的熔点为-116℃,沸点为3.8℃,
的熔点为-116℃,沸点为3.8℃, 的沸点为-34.6℃;
的沸点为-34.6℃;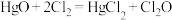 ,液氨是一种制冷剂。制取
,液氨是一种制冷剂。制取 的装置如图所示。
的装置如图所示。
回答下列问题。
(1)①中盛放浓盐酸的仪器名称为_______ ,写出①中发生的化学反应方程式_______ 。
(2)该实验可证明 的氧化性比
的氧化性比 的氧化性
的氧化性_______ (填“强”或“弱”),浓盐酸在反应中表现出的性质有_______ 。
(3)装置②中盛放的试剂为_______ ;装置③的作用_______ 。
(4)产物 在装置
在装置_______ 中收集。
(5)从装置⑤中逸出的气体主要成分为_______ 。
 是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与还原剂接触或加热时会发生燃烧并爆炸。
是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与还原剂接触或加热时会发生燃烧并爆炸。已知:
 的熔点为-116℃,沸点为3.8℃,
的熔点为-116℃,沸点为3.8℃, 的沸点为-34.6℃;
的沸点为-34.6℃;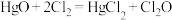 ,液氨是一种制冷剂。制取
,液氨是一种制冷剂。制取 的装置如图所示。
的装置如图所示。
回答下列问题。
(1)①中盛放浓盐酸的仪器名称为
(2)该实验可证明
 的氧化性比
的氧化性比 的氧化性
的氧化性(3)装置②中盛放的试剂为
(4)产物
 在装置
在装置(5)从装置⑤中逸出的气体主要成分为
您最近一年使用:0次
9 . 下面是制备 白色沉淀的几种方案。请回答下列问题:
白色沉淀的几种方案。请回答下列问题:
(1)用不含 的
的 溶液与不含
溶液与不含 的蒸馏水配制的NaOH溶液反应制备
的蒸馏水配制的NaOH溶液反应制备 。
。
①用硫酸亚铁晶体配制上述 溶液时还需要加入铁粉,其目的是
溶液时还需要加入铁粉,其目的是______ 。(用离子方程式表示)
②除去蒸馏水中溶解的 常采用
常采用______ 的方法。
③生成 白色沉淀的操作是用长滴管吸取不含
白色沉淀的操作是用长滴管吸取不含 的NaOH溶液,插入
的NaOH溶液,插入 溶液液面下,再挤出NaOH溶液,发生反应的离子方程式
溶液液面下,再挤出NaOH溶液,发生反应的离子方程式______ 。
(2)在如图所示的装置中,用NaOH溶液、铁粉、稀 等试剂制备。
等试剂制备。

①仪器a的名称是______ 。
②关闭 ,打开
,打开 和
和 ,向仪器c中加入适量稀硫酸,关闭
,向仪器c中加入适量稀硫酸,关闭 ,写出装置c中发生反应的离子方程式
,写出装置c中发生反应的离子方程式______ 。同时c中有气体产生,该气体的作用是______ 。
③当仪器b中产生均匀气泡后,关闭活塞 ,打开活塞
,打开活塞 ,写出此时仪器c、d中可能出现的实验现象
,写出此时仪器c、d中可能出现的实验现象______ 。
 白色沉淀的几种方案。请回答下列问题:
白色沉淀的几种方案。请回答下列问题:(1)用不含
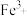 的
的 溶液与不含
溶液与不含 的蒸馏水配制的NaOH溶液反应制备
的蒸馏水配制的NaOH溶液反应制备 。
。①用硫酸亚铁晶体配制上述
 溶液时还需要加入铁粉,其目的是
溶液时还需要加入铁粉,其目的是②除去蒸馏水中溶解的
 常采用
常采用③生成
 白色沉淀的操作是用长滴管吸取不含
白色沉淀的操作是用长滴管吸取不含 的NaOH溶液,插入
的NaOH溶液,插入 溶液液面下,再挤出NaOH溶液,发生反应的离子方程式
溶液液面下,再挤出NaOH溶液,发生反应的离子方程式(2)在如图所示的装置中,用NaOH溶液、铁粉、稀
 等试剂制备。
等试剂制备。
①仪器a的名称是
②关闭
 ,打开
,打开 和
和 ,向仪器c中加入适量稀硫酸,关闭
,向仪器c中加入适量稀硫酸,关闭 ,写出装置c中发生反应的离子方程式
,写出装置c中发生反应的离子方程式③当仪器b中产生均匀气泡后,关闭活塞
 ,打开活塞
,打开活塞 ,写出此时仪器c、d中可能出现的实验现象
,写出此时仪器c、d中可能出现的实验现象
您最近一年使用:0次
名校
解题方法
10 . 某小组同学为了获取在 制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。
实验步骤:
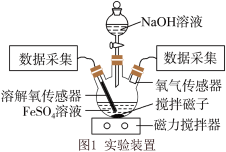
Ⅰ.向三颈瓶中加入饱和 溶液,按如图1所示装置连接;
溶液,按如图1所示装置连接;
Ⅱ.打开磁力搅拌器,立即加入 溶液;
溶液;
Ⅲ.采集瓶内空气中 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。
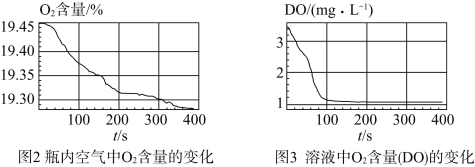
实验数据:
问题与解释:
(1)盛放 溶液的仪器名称为
溶液的仪器名称为___________ 。
(2)若溶液中 含量(DO)取值为1.6,则该溶液中
含量(DO)取值为1.6,则该溶液中 含量可以表示为
含量可以表示为___________  。生成白色沉淀的离子方程式是
。生成白色沉淀的离子方程式是___________ 。
(3)溶液中白色絮状沉淀 易被氧化,沉淀转化过程的现象是
易被氧化,沉淀转化过程的现象是___________ 。
(4)通过上述实验,可得到“在 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是___________ 。
(5)打印机使用的墨粉中含有 。将
。将 溶液和
溶液和 溶液按一定比例混合,再加入一定量的
溶液按一定比例混合,再加入一定量的 溶液,水浴加热,可制得
溶液,水浴加热,可制得 ,写出该离子方程式:
,写出该离子方程式:___________ 。
 制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。实验步骤:

Ⅰ.向三颈瓶中加入饱和
 溶液,按如图1所示装置连接;
溶液,按如图1所示装置连接;Ⅱ.打开磁力搅拌器,立即加入
 溶液;
溶液;Ⅲ.采集瓶内空气中
 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。实验数据:

问题与解释:
(1)盛放
 溶液的仪器名称为
溶液的仪器名称为(2)若溶液中
 含量(DO)取值为1.6,则该溶液中
含量(DO)取值为1.6,则该溶液中 含量可以表示为
含量可以表示为 。生成白色沉淀的离子方程式是
。生成白色沉淀的离子方程式是(3)溶液中白色絮状沉淀
 易被氧化,沉淀转化过程的现象是
易被氧化,沉淀转化过程的现象是(4)通过上述实验,可得到“在
 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是(5)打印机使用的墨粉中含有
 。将
。将 溶液和
溶液和 溶液按一定比例混合,再加入一定量的
溶液按一定比例混合,再加入一定量的 溶液,水浴加热,可制得
溶液,水浴加热,可制得 ,写出该离子方程式:
,写出该离子方程式:
您最近一年使用:0次
2023-12-24更新
|
127次组卷
|
2卷引用:陕西省西安交通大学附属中学2023-2024学年高一上学期期末考试化学试卷



