1 . 硫化氢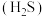 是一种没有颜色,具有具鸡蛋气味的有毒气体,其密度比空气大,且能溶于水形成氢硫酸,在空气中点燃硫化氢气体有
是一种没有颜色,具有具鸡蛋气味的有毒气体,其密度比空气大,且能溶于水形成氢硫酸,在空气中点燃硫化氢气体有 和水生成。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸混合,在常温下发生复分解反应,制得硫化氢气体,试回答:
和水生成。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸混合,在常温下发生复分解反应,制得硫化氢气体,试回答:_______ 。
(2)制取 气体的发生装置可选用
气体的发生装置可选用_______ ,若选用右面的A装置优点是_______ 。
(3)下列可干燥 的干燥剂_______。
的干燥剂_______。
(4)若用 装置收集
装置收集 气体,进气口应为
气体,进气口应为_______ 。
(5)为了验证硫化氢的水溶液呈酸性,可将气体通入装置D,D中所盛的试剂应该是_______ 其现象为_______ 。
(6)写出 和
和 反应的化学反应方程式
反应的化学反应方程式_______ 。
(7)装置 作用
作用_______ 。
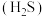 是一种没有颜色,具有具鸡蛋气味的有毒气体,其密度比空气大,且能溶于水形成氢硫酸,在空气中点燃硫化氢气体有
是一种没有颜色,具有具鸡蛋气味的有毒气体,其密度比空气大,且能溶于水形成氢硫酸,在空气中点燃硫化氢气体有 和水生成。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸混合,在常温下发生复分解反应,制得硫化氢气体,试回答:
和水生成。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸混合,在常温下发生复分解反应,制得硫化氢气体,试回答:
(2)制取
 气体的发生装置可选用
气体的发生装置可选用(3)下列可干燥
 的干燥剂_______。
的干燥剂_______。| A.五氧化二磷 | B.浓硫酸 | C.氯化钙 | D.碱石灰 |
(4)若用
 装置收集
装置收集 气体,进气口应为
气体,进气口应为(5)为了验证硫化氢的水溶液呈酸性,可将气体通入装置D,D中所盛的试剂应该是
(6)写出
 和
和 反应的化学反应方程式
反应的化学反应方程式(7)装置
 作用
作用
您最近一年使用:0次
2 . 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,浓度高时极易爆炸。某研究小组在实验室按如图所示的装置,用干燥的氯气与固体亚氯酸钠制备二氧化氯,请回答下列问题:___________ ,其作用是___________ 。
(2)仪器a的名称为___________ ,装置E的作用是___________ 。
(3)装置D中冰水的主要作用是___________ ,往D中通入氯气的同时还通入干燥的空气,其主要目的是___________ 。
(4)装置D内发生反应的化学方程式为___________ 。
(5)已知:利用NaClO2溶液制备NaClO2晶体的过程中,需使用38℃~60℃的温水洗涤,洗涤的方法为___________ 。
(6)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为
___________ 。

(2)仪器a的名称为
(3)装置D中冰水的主要作用是
(4)装置D内发生反应的化学方程式为
(5)已知:利用NaClO2溶液制备NaClO2晶体的过程中,需使用38℃~60℃的温水洗涤,洗涤的方法为
(6)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
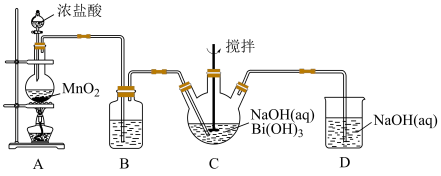
3 . 利用如图的装置制备NaBiO3(铋酸钠):
(1)A装置中反应的化学方程式:_______ 。
(2)B装置中试剂是_______ 。
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是_______ 。
(4)D装置中反应的离子方程式:_______ 。
(5)实验完毕后,为了提高产品纯度,需要的操作有_______ 、过滤、洗涤、干燥。
(6)写出装置C中发生反应的化学方程式:_______ 。
(7)探究NaBiO3的性质:
①在酸性条件下, 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是_______ 。
②结合第(3)小题C装置中的反应,分析NaBO3和Cl2氧化性强弱不一致的主要原因是_______ 。
| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水、在酸性溶液中迅速分解;浅黄色 | 难溶于水、白色 |
(2)B装置中试剂是
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是
(4)D装置中反应的离子方程式:
(5)实验完毕后,为了提高产品纯度,需要的操作有
(6)写出装置C中发生反应的化学方程式:
(7)探究NaBiO3的性质:
| 实验 | 操作 | 现象 |
| Ⅰ | 取少量NaBiO3于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝色 |
| Ⅱ | 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 | 无色溶液变紫红色溶液 |
 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是②结合第(3)小题C装置中的反应,分析NaBO3和Cl2氧化性强弱不一致的主要原因是
您最近一年使用:0次
名校
4 . 某学习小组在实验室制备氯化铁并配制其溶液,过程如下。
【制备无水FeCl3】无水FeCl3是一种常见的化工原料,易升华,在空气中极易吸水,可利用以下实验装置制备。

(1)按气流方向,连接顺序为a→_______ →j→k→f→g→b→c(填仪器连接口的字母编号)。
(2)装置B的作用是_______ 。
(3)A中发生的离子反应为_______ 。
【配制FeCl3溶液】
(4)配置100mL0.5mol/LFeCl3溶液,需用量筒量取5.0mol/LFeCl3溶液_______ mL,还需要的仪器有烧杯、玻璃棒、_______ 。
(5)下列实验操作对所配制的FeCl3溶液物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①定容时,俯视刻度线:_______ 。
②未洗涤烧杯及玻璃棒:_______ 。
【制备无水FeCl3】无水FeCl3是一种常见的化工原料,易升华,在空气中极易吸水,可利用以下实验装置制备。

(1)按气流方向,连接顺序为a→
(2)装置B的作用是
(3)A中发生的离子反应为
【配制FeCl3溶液】
(4)配置100mL0.5mol/LFeCl3溶液,需用量筒量取5.0mol/LFeCl3溶液
(5)下列实验操作对所配制的FeCl3溶液物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①定容时,俯视刻度线:
②未洗涤烧杯及玻璃棒:
您最近一年使用:0次
5 . 一氧化二氯(Cl2O)是国际公认的高效安全灭菌消毒剂,其部分性质如下:
实验室制备原理:2Na2CO3+H2O+2Cl2 2NaCl+2NaHCO3+Cl2O。
2NaCl+2NaHCO3+Cl2O。
现用如图所示装置设计实验制备少量Cl2O。
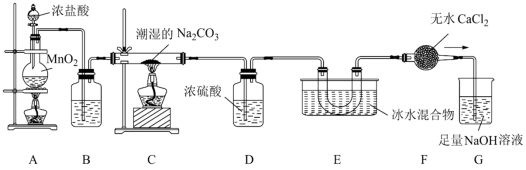
(1)盛有MnO2的仪器名称为______ 。
(2)仪器组装完成,加药品前应进行的实验操作是______ 。
(3)装置A中发生反应的离子方程式为______ 。
(4)装置F的作用是______ 。
(5)E装置中冰水混合物的作用是______ 。
(6)将Cl2O通入含NaOH的溶液中发生的化学方程式为______ 。
| 物理性质 | 化学性质 |
| 常温下,Cl2O是棕黄色、有刺激性气味的气体;熔点-120.6℃;沸点2.0℃。 | Cl2O热稳定性差,常温下即可分解;易溶于水,同时反应生成次氯酸。 |
 2NaCl+2NaHCO3+Cl2O。
2NaCl+2NaHCO3+Cl2O。现用如图所示装置设计实验制备少量Cl2O。

(1)盛有MnO2的仪器名称为
(2)仪器组装完成,加药品前应进行的实验操作是
(3)装置A中发生反应的离子方程式为
(4)装置F的作用是
(5)E装置中冰水混合物的作用是
(6)将Cl2O通入含NaOH的溶液中发生的化学方程式为
您最近一年使用:0次
6 . 利用辉锑矿(主要成分为Sb2S3,含Fe2O3、MgO,SiO2等杂质)为原料制备SbOCl的工艺流程如图所示。已知:还原性:Fe>Sb>Fe2+。
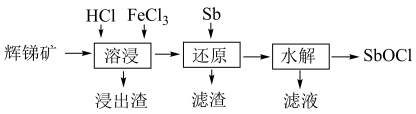
| A.“水解”时发生的主要反应为:Sb3++H2O+Cl–=SbOCl↓+2H+ |
| B.“水解”时可采用边加热边通入空气搅拌的形式促进Sb3+的水解 |
| C.“还原”加入Sb的目的是将Fe3+还原为Fe |
| D.“溶浸”中浸出渣的成分只有SiO2 |
您最近一年使用:0次
2024-02-29更新
|
148次组卷
|
3卷引用:云南省曲靖市第二中学等三校联考2023-2024学年高一下学期3月月考化学试题
7 . 如下图所示的装置中A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶。下列说法正确的是
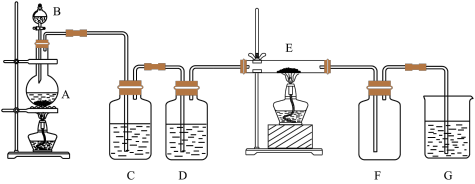
| A.C瓶的作用是收集氯气 |
| B.G中加入氢氧化钠溶液用于吸收多余的氯气 |
| C.E中发生的化学反应为Fe+Cl2=FeCl2 |
| D.用该装置制备氯气前不需要检查装置的气密性 |
您最近一年使用:0次
2024-02-10更新
|
76次组卷
|
3卷引用:云南省大理白族自治州民族中学2023-2024学年高一下学期4月月考化学试题
8 . 回答下列问题:
I.Na2CO3在轻工、建材、纺织、国防、医药等工业中有重要的应用。工业碳酸钠(纯度约为 98%)中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO 等杂质,提纯工艺线路如下:
等杂质,提纯工艺线路如下:

已知:碳酸镁微溶,氢氧化镁难溶,碳酸钠的饱和溶液在不同温度下析出的溶质如下所示:

请回答下列问题:
(1)工业上常用煅烧 NaHCO3 的方法得到碳酸钠,该反应的化学方程式为:_____ 。
(2)试剂 A 是_____ ,“母液”中除了含有 Na+、CO 、OH-外,还含有
、OH-外,还含有_____ 等离子,过滤要“趁热”的目的是_____ 。
Ⅱ.稀土是一种重要的战略资源,我国稀土出口量世界第一、饰(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为)形式存在。工业上利用氟碳铈矿制取 的一种工艺流程如图:
的一种工艺流程如图:

回答下列问题:
(3)已知 中C为+4价,F为-1价,在空气中焙烧
中C为+4价,F为-1价,在空气中焙烧 的反应中Ce元素被
的反应中Ce元素被_____ (填“氧化”或“还原”),该反应中氧化剂与还原剂物质的量之比为_____ 。
(4)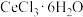 属于
属于_____ (填“纯净物”或“混合物”)。
(5)酸浸过程中用稀硫酸和 。写出稀硫酸、
。写出稀硫酸、 与
与 反应的离子方程式:
反应的离子方程式:_____ 。
(6)室温下,粒子直径为1~10nm的 分散到水中形成分散系。如何检验该分散系
分散到水中形成分散系。如何检验该分散系_____ 。(填实验操作、现象)。
(7)准确称取 样品置于锥形瓶中,加入适量过硫酸铵溶液将
样品置于锥形瓶中,加入适量过硫酸铵溶液将 氧化为
氧化为 ,然后加入
,然后加入 与之恰好反应完。(已知:
与之恰好反应完。(已知: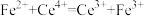 )该样品中
)该样品中 的质量分数为
的质量分数为_____ (结果保留三位有效数字)。
I.Na2CO3在轻工、建材、纺织、国防、医药等工业中有重要的应用。工业碳酸钠(纯度约为 98%)中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO
 等杂质,提纯工艺线路如下:
等杂质,提纯工艺线路如下:
已知:碳酸镁微溶,氢氧化镁难溶,碳酸钠的饱和溶液在不同温度下析出的溶质如下所示:

请回答下列问题:
(1)工业上常用煅烧 NaHCO3 的方法得到碳酸钠,该反应的化学方程式为:
(2)试剂 A 是
 、OH-外,还含有
、OH-外,还含有Ⅱ.稀土是一种重要的战略资源,我国稀土出口量世界第一、饰(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为)形式存在。工业上利用氟碳铈矿制取
 的一种工艺流程如图:
的一种工艺流程如图:
回答下列问题:
(3)已知
 中C为+4价,F为-1价,在空气中焙烧
中C为+4价,F为-1价,在空气中焙烧 的反应中Ce元素被
的反应中Ce元素被(4)
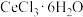 属于
属于(5)酸浸过程中用稀硫酸和
 。写出稀硫酸、
。写出稀硫酸、 与
与 反应的离子方程式:
反应的离子方程式:(6)室温下,粒子直径为1~10nm的
 分散到水中形成分散系。如何检验该分散系
分散到水中形成分散系。如何检验该分散系(7)准确称取
 样品置于锥形瓶中,加入适量过硫酸铵溶液将
样品置于锥形瓶中,加入适量过硫酸铵溶液将 氧化为
氧化为 ,然后加入
,然后加入 与之恰好反应完。(已知:
与之恰好反应完。(已知: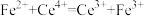 )该样品中
)该样品中 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
9 . 氯化铁是一种重要的化工产品,易升华,易溶于水并且有强烈的吸水性,会吸收空气中的水分而发生变质。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。请根据如图回答下列问答:
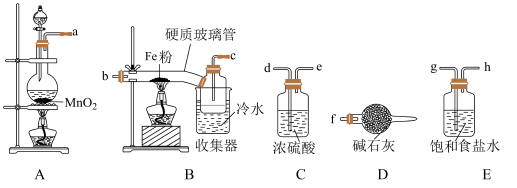
(1)盛装浓盐酸的仪器名称为___________ ;
(2)装置的连接顺序为:a→_____ →_____ →_____ →_____ →_____ →_____ →f(按气体方向填写)
(3)写出A中反应的化学方程式___________ ;
(4)B中硬质玻璃管直接连接收集器,不能使用细导管连接的原因是___________ ;
(5)实验结束后,测得装置B的质量增加克,则理论上装置B中反应转移电子的物质的量为___________  (用含m的式子回答);
(用含m的式子回答);
(6)碱石灰的作用是___________ ;
(7) 和
和 可以相互转化,用如图所示装置进行氢气还原
可以相互转化,用如图所示装置进行氢气还原 的实验,实验结束,取少量石英管内剩余固体溶于稀盐酸,固体全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
的实验,实验结束,取少量石英管内剩余固体溶于稀盐酸,固体全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
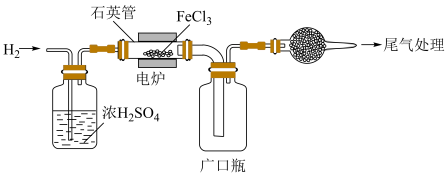
猜测1:只有
猜测2:含有 和
和
猜测3:只有
①实验方案:
已知:铁氰化钾溶液与 反应产生蓝色沉淀
反应产生蓝色沉淀
第一步加入的试剂为___________ ;
实验结论:现象一为___________ ,现象二为___________ ,则猜测1成立;
②另一个同学猜想,加热到更高温度T,,可能会还原得到其他物质。该同学在温度T下重复上述还原实验,当把石英管内剩余固体溶于稀盐酸时,发现固体溶解且有少量气泡产生,请写出温度T下石英管内发生反应的化学方程式___________ 。

(1)盛装浓盐酸的仪器名称为
(2)装置的连接顺序为:a→
(3)写出A中反应的化学方程式
(4)B中硬质玻璃管直接连接收集器,不能使用细导管连接的原因是
(5)实验结束后,测得装置B的质量增加克,则理论上装置B中反应转移电子的物质的量为
 (用含m的式子回答);
(用含m的式子回答);(6)碱石灰的作用是
(7)
 和
和 可以相互转化,用如图所示装置进行氢气还原
可以相互转化,用如图所示装置进行氢气还原 的实验,实验结束,取少量石英管内剩余固体溶于稀盐酸,固体全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
的实验,实验结束,取少量石英管内剩余固体溶于稀盐酸,固体全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
猜测1:只有

猜测2:含有
 和
和
猜测3:只有

①实验方案:
已知:铁氰化钾溶液与
 反应产生蓝色沉淀
反应产生蓝色沉淀| 实验步骤 | 操作 | 现象 |
| 第一步 | 取溶液于试管中,加入___________ | 现象一 |
| 第二步 | 另取溶液于试管中,加入铁氰化钾溶液 | 现象二 |
实验结论:现象一为
②另一个同学猜想,加热到更高温度T,,可能会还原得到其他物质。该同学在温度T下重复上述还原实验,当把石英管内剩余固体溶于稀盐酸时,发现固体溶解且有少量气泡产生,请写出温度T下石英管内发生反应的化学方程式
您最近一年使用:0次
10 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。

已知:CCl4难溶于水且密度比水大,I2在CCl4中显紫色;氯气与碱反应时温度不同产物不同。
请回答下列问题:
(1)写出装置①制取氯气的化学方程式___________________________________ 。
(2)其中盐酸的性质是__________________ ,仪器A的名称是______________ ,其中氧化剂与还原剂物质的量之比为_______________ 。
(3)装置②中的试剂为______________________ 。
(4)装置③中反应的化学方程式为____________________________ ,反应结束后,取出③中试管,经冷却结晶,过滤,少量(冷)水洗涤,干燥,得到 晶体。
晶体。
(5)装置④中反应的离子方程式为____________________________________ 。
(6)⑤中可选用试剂 (填标号)。
(7)取少量 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫色,可知该条件下
层显紫色,可知该条件下 的氧化能力比NaClO
的氧化能力比NaClO___________ (填“强”或“弱”)。

已知:CCl4难溶于水且密度比水大,I2在CCl4中显紫色;氯气与碱反应时温度不同产物不同。
请回答下列问题:
(1)写出装置①制取氯气的化学方程式
(2)其中盐酸的性质是
(3)装置②中的试剂为
(4)装置③中反应的化学方程式为
 晶体。
晶体。(5)装置④中反应的离子方程式为
(6)⑤中可选用试剂 (填标号)。
| A.Na2S | B.NaCl | C.澄清石灰水 | D.H2SO4 |
 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫色,可知该条件下
层显紫色,可知该条件下 的氧化能力比NaClO
的氧化能力比NaClO
您最近一年使用:0次



