名校
解题方法
1 . 水处理:水是身体的重要组成部分,具有重要的生理功能。河流湖泊水是人类用水的主要来源,但使用前需要经过净化处理。
(1)常见的水处理剂包括氯气、臭氧、漂白粉、活性炭等,游泳场馆常用臭氧、活性炭对游泳池进行消毒和净化。下列说法错误的是_______。
(2)明矾溶于水可以得到 胶体,明矾能用于净水的原因是胶体具有
胶体,明矾能用于净水的原因是胶体具有_______ 。现将此法制得的 胶体装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
胶体装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜:
能够透过半透膜:_______ 。
(3)亚氯酸钠( )是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出 ,
, 有类似
有类似 的性质。某兴趣小组探究亚氯酸钠的制备。
的性质。某兴趣小组探究亚氯酸钠的制备。
①关闭止水夹②,打开止水夹①,从进气口通入足量 ,充分反应。仪器a的名称为
,充分反应。仪器a的名称为_______ ,仪器b的作用是_______ 。
②装置A中生成 的化学方程式为
的化学方程式为_______ ,B中的现象为_______ 。
③若从装置A反应后的溶液中获得 晶体,则主要操作有:减压蒸发浓缩、
晶体,则主要操作有:减压蒸发浓缩、_______ 、过滤、洗涤、干燥等。
(1)常见的水处理剂包括氯气、臭氧、漂白粉、活性炭等,游泳场馆常用臭氧、活性炭对游泳池进行消毒和净化。下列说法错误的是_______。
| A.臭氧、活性炭处理水的原理不同 |
| B.用氯气消毒后的水,可用于配制各种化学试剂 |
| C.用漂白粉漂白时,向其中滴入浓盐酸或通入二氧化碳可以增强漂白效果 |
| D.漂白粉长期露置在空气中会失效 |
(2)明矾溶于水可以得到
 胶体,明矾能用于净水的原因是胶体具有
胶体,明矾能用于净水的原因是胶体具有 胶体装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
胶体装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜:
能够透过半透膜:(3)亚氯酸钠(
 )是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出 ,
, 有类似
有类似 的性质。某兴趣小组探究亚氯酸钠的制备。
的性质。某兴趣小组探究亚氯酸钠的制备。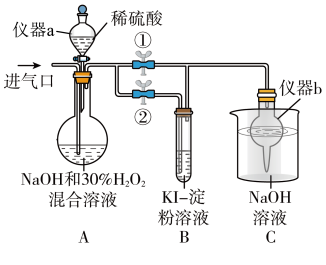
①关闭止水夹②,打开止水夹①,从进气口通入足量
 ,充分反应。仪器a的名称为
,充分反应。仪器a的名称为②装置A中生成
 的化学方程式为
的化学方程式为③若从装置A反应后的溶液中获得
 晶体,则主要操作有:减压蒸发浓缩、
晶体,则主要操作有:减压蒸发浓缩、
您最近一年使用:0次
2 . 硫代硫酸钠( )又名次亚硫酸钠、大苏打、海波,主要用于照相业作定影剂,某学习小组用如图装置制备硫代硫酸钠。
)又名次亚硫酸钠、大苏打、海波,主要用于照相业作定影剂,某学习小组用如图装置制备硫代硫酸钠。
①“绿矾”是指 ,高温受热可完全分解得红棕色固体和气体混合物;
,高温受热可完全分解得红棕色固体和气体混合物;
② 熔点-75.5℃,沸点-10℃;
熔点-75.5℃,沸点-10℃; 熔点16.8℃,沸点44.8℃
熔点16.8℃,沸点44.8℃
③硫代硫酸钠( )具有还原性,受热、遇酸易分解。
)具有还原性,受热、遇酸易分解。
请回答下列问题:
Ⅰ.制取硫代硫酸钠( )
)
(1)A装置中发生反应的化学方程式为___________________ 。
(2)检查装置气密性,加入药品。 和
和 混合溶液用煮沸过的蒸馏水配制,煮沸的目的是
混合溶液用煮沸过的蒸馏水配制,煮沸的目的是_______________ ;B装置的作用是_________________ 。
(3)从锥形瓶中得到 晶体需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是
晶体需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是_______________ 。
(4)将一定量的绿矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明:此固体产物不含二价铁:__________________ 。
Ⅱ.探究 的性质
的性质
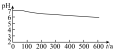
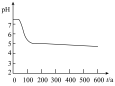
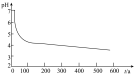
为探究 的性质,小组将装置C换成钡盐溶液,并先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入
的性质,小组将装置C换成钡盐溶液,并先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入 流速一致。四次实验分别得到如表pH—t图:
流速一致。四次实验分别得到如表pH—t图:
(5)分析pH—t图,写出②中发生反应的离子方程式___________________________ ,上述四次实验中有白色沉淀生成的是__________ (填编号)。
 )又名次亚硫酸钠、大苏打、海波,主要用于照相业作定影剂,某学习小组用如图装置制备硫代硫酸钠。
)又名次亚硫酸钠、大苏打、海波,主要用于照相业作定影剂,某学习小组用如图装置制备硫代硫酸钠。
①“绿矾”是指
 ,高温受热可完全分解得红棕色固体和气体混合物;
,高温受热可完全分解得红棕色固体和气体混合物;②
 熔点-75.5℃,沸点-10℃;
熔点-75.5℃,沸点-10℃; 熔点16.8℃,沸点44.8℃
熔点16.8℃,沸点44.8℃③硫代硫酸钠(
 )具有还原性,受热、遇酸易分解。
)具有还原性,受热、遇酸易分解。请回答下列问题:
Ⅰ.制取硫代硫酸钠(
 )
)(1)A装置中发生反应的化学方程式为
(2)检查装置气密性,加入药品。
 和
和 混合溶液用煮沸过的蒸馏水配制,煮沸的目的是
混合溶液用煮沸过的蒸馏水配制,煮沸的目的是(3)从锥形瓶中得到
 晶体需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是
晶体需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是(4)将一定量的绿矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明:此固体产物不含二价铁:
Ⅱ.探究
 的性质
的性质为探究
 的性质,小组将装置C换成钡盐溶液,并先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入
的性质,小组将装置C换成钡盐溶液,并先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入 流速一致。四次实验分别得到如表pH—t图:
流速一致。四次实验分别得到如表pH—t图: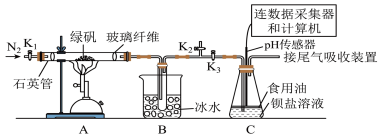
①已煮沸的 (aq) (aq) | ②未煮沸的 (aq) (aq) | ③已煮沸的 (aq) (aq) | ④未煮沸的 (aq) (aq) |
|
|
|
|
(5)分析pH—t图,写出②中发生反应的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 利用如图的装置(省略部分加热装置)制备 (铋酸钠),已知
(铋酸钠),已知 不溶于冷水且在酸性溶液中迅速分解,
不溶于冷水且在酸性溶液中迅速分解, 是一种难溶于水的白色沉淀。下列说法正确的是
是一种难溶于水的白色沉淀。下列说法正确的是
 (铋酸钠),已知
(铋酸钠),已知 不溶于冷水且在酸性溶液中迅速分解,
不溶于冷水且在酸性溶液中迅速分解, 是一种难溶于水的白色沉淀。下列说法正确的是
是一种难溶于水的白色沉淀。下列说法正确的是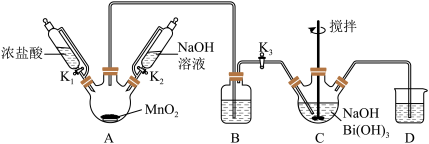
A.装置B应放入饱和 溶液,目的是吸收A中挥发的盐酸 溶液,目的是吸收A中挥发的盐酸 |
B.为使 完全转化为 完全转化为 ,反应过程中应向装置C通入过量 ,反应过程中应向装置C通入过量 |
C.拆除装置前必须进行的操作是关闭 、 、 ,打开 ,打开 |
D.上述反应中若消耗22.4L  则理论上可制得280g 则理论上可制得280g  |
您最近一年使用:0次
2024-04-26更新
|
117次组卷
|
2卷引用:广西南宁三中2023-2024学年高一下学期月考(一)化学试卷
解题方法
4 . 纳米氧化镁广泛应用于电子元器件、催化剂载体等领域,一种利用 制备纳米氧化镁的工艺流程如图所示,下列说法错误的是
制备纳米氧化镁的工艺流程如图所示,下列说法错误的是 不参与化学反应.
不参与化学反应.
 制备纳米氧化镁的工艺流程如图所示,下列说法错误的是
制备纳米氧化镁的工艺流程如图所示,下列说法错误的是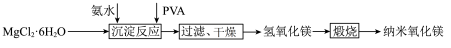
 不参与化学反应.
不参与化学反应.| A.纳米氧化镁分散在空气中能产生丁达尔效应 |
B.“煅烧”时,发生反应的化学方程式为 |
| C.“沉淀反应”时,有共价键的断裂 |
D.可以用坩埚蒸干氯化镁溶液的溶剂获得 |
您最近一年使用:0次
名校
解题方法
5 . 以含钴废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示:_____________ 。“滤渣1”的化学式为___________ 。
(2)“酸浸”时 与
与 反应的化学方程式为
反应的化学方程式为__________________ 。如果用浓盐酸代替硫酸和 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是______________________ (任答一点)。
(3)“操作2”所得副产品的一种用途为_____________ 。
(4)“沉钴”时温度不能太高,原因是_____________________________ 。
(5)“沉钴”步骤中同时还会产生 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为_________________ 。
(6)实验室模拟“操作1”,需要将 转移到
转移到________ (填仪器名称)中加热分解,得到 。
。
 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示: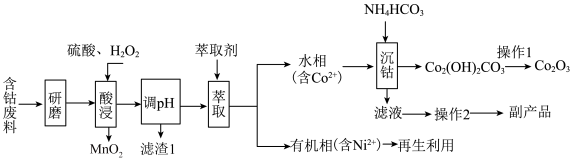
(2)“酸浸”时
 与
与 反应的化学方程式为
反应的化学方程式为 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是(3)“操作2”所得副产品的一种用途为
(4)“沉钴”时温度不能太高,原因是
(5)“沉钴”步骤中同时还会产生
 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为(6)实验室模拟“操作1”,需要将
 转移到
转移到 。
。
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.工业生产纯碱的工艺流程示意图如图:
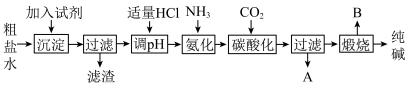
(1)为除去粗盐水中的
 、
、 、
、 等杂质离子,加入试剂顺序合理的是______。
等杂质离子,加入试剂顺序合理的是______。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是
(3)工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(4)碳酸化后过滤,滤液A最主要的成分是
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 常用的自来水消毒剂有高铁酸钾(K2FeO4)、二氧化氯等。
I.制取高铁酸钾
已知:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH=K2FeO4↓+2NaOH
(1)制取NaClO溶液的装置如图所示。装有浓盐酸的仪器名称是:___________ ;装置A中反应的化学方程式为___________ ;装置B中盛装的液体是___________ ,玻璃管a的作用是___________ 。

(2)制取高铁酸钾晶体。请补充完整由装置C中反应后的溶液制取高铁酸钾晶体的实验方案:将装置C中制得的NaClO溶液转移到大烧杯中,依次加入一定量的1mol/LNaOH溶液和FeCl3饱和溶液,搅拌,充分反应,再向反应后的溶液中加入___________ ,搅拌至___________ ,静置过滤,___________ ,干燥。(实验中须使用的试剂:KOH固体,无水乙醇)
II.制取二氧化氯
已知: 常温下为易溶于水但不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以
常温下为易溶于水但不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以 和HCl的乙醇溶液为原料制取
和HCl的乙醇溶液为原料制取 的反应为2NaClO3+4HCl=2ClO2+Cl2+2NaCl+2H2O。制取装置如图所示。
的反应为2NaClO3+4HCl=2ClO2+Cl2+2NaCl+2H2O。制取装置如图所示。

(3)该反应中氧化产物是___________ ,当反应消耗4 mol HCl时,转移___________ 电子。
(4)冰水浴的作用是___________ 。
(5)烧杯中混合液用于吸收产生的 同时生成
同时生成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
I.制取高铁酸钾
已知:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH=K2FeO4↓+2NaOH
③高铁酸钾易溶于水,微溶于浓KOH溶液,不溶于乙醇;在强碱性溶液中稳定;酸性至弱碱性条件下,与水反应生成氧气。
(1)制取NaClO溶液的装置如图所示。装有浓盐酸的仪器名称是:

(2)制取高铁酸钾晶体。请补充完整由装置C中反应后的溶液制取高铁酸钾晶体的实验方案:将装置C中制得的NaClO溶液转移到大烧杯中,依次加入一定量的1mol/LNaOH溶液和FeCl3饱和溶液,搅拌,充分反应,再向反应后的溶液中加入
II.制取二氧化氯
已知:
 常温下为易溶于水但不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以
常温下为易溶于水但不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以 和HCl的乙醇溶液为原料制取
和HCl的乙醇溶液为原料制取 的反应为2NaClO3+4HCl=2ClO2+Cl2+2NaCl+2H2O。制取装置如图所示。
的反应为2NaClO3+4HCl=2ClO2+Cl2+2NaCl+2H2O。制取装置如图所示。
(3)该反应中氧化产物是
(4)冰水浴的作用是
(5)烧杯中混合液用于吸收产生的
 同时生成
同时生成 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 四氯化锡( )是合成杀螨剂三环锡、苯丁锡和三唑锡的中间体,四氯化锡传统的实验室制法为金属锡氯化法:将金属锡熔融,通入干燥的氯气进行反应,生成四氯化锡。实验装置如图,请回答下列问题:
)是合成杀螨剂三环锡、苯丁锡和三唑锡的中间体,四氯化锡传统的实验室制法为金属锡氯化法:将金属锡熔融,通入干燥的氯气进行反应,生成四氯化锡。实验装置如图,请回答下列问题:
① 遇水强烈水解,产生大量白烟;锡可以与盐酸发生反应
遇水强烈水解,产生大量白烟;锡可以与盐酸发生反应 。
。
② 的熔点为
的熔点为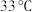 ,沸点为
,沸点为 。
。
(1)盛装浓盐酸的仪器的支管的作用是___________ ;乙、丙洗气瓶中盛装的试剂分别为___________ (填标号)。
A.浓硫酸、饱和食盐水 B.饱和食盐水、浓硫酸 C.浓硫酸、 溶液 D.
溶液 D. 溶液、浓硫酸
溶液、浓硫酸
(2)甲中生成氯气的离子方程式为___________ ;该反应中 体现出的化学性质为
体现出的化学性质为___________ 。
(3)已为装有碱石灰的球形干燥管,其作用是___________ 。
(4)某化学兴趣小组对传统方法进行改进,用易得的、价廉的 和氯化亚砜(
和氯化亚砜( )反应,制得了无水
)反应,制得了无水 ,实验装置如图(夹持、搅拌和加热装置省略)。在圆底烧瓶中加入已碾碎的
,实验装置如图(夹持、搅拌和加热装置省略)。在圆底烧瓶中加入已碾碎的 晶体,逐渐升高温度,使之熔融,持续搅拌,缓慢用分液漏斗加入
晶体,逐渐升高温度,使之熔融,持续搅拌,缓慢用分液漏斗加入 液体,
液体, 与
与 反应,过程中会产生大量的HCI和
反应,过程中会产生大量的HCI和 气体。
气体。 的结构可能为
的结构可能为___________ (填标号), 与
与 反应的化学方程式
反应的化学方程式___________ (已知:生成物中不含有 )。
)。___________ 。
 )是合成杀螨剂三环锡、苯丁锡和三唑锡的中间体,四氯化锡传统的实验室制法为金属锡氯化法:将金属锡熔融,通入干燥的氯气进行反应,生成四氯化锡。实验装置如图,请回答下列问题:
)是合成杀螨剂三环锡、苯丁锡和三唑锡的中间体,四氯化锡传统的实验室制法为金属锡氯化法:将金属锡熔融,通入干燥的氯气进行反应,生成四氯化锡。实验装置如图,请回答下列问题:
①
 遇水强烈水解,产生大量白烟;锡可以与盐酸发生反应
遇水强烈水解,产生大量白烟;锡可以与盐酸发生反应 。
。②
 的熔点为
的熔点为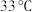 ,沸点为
,沸点为 。
。(1)盛装浓盐酸的仪器的支管的作用是
A.浓硫酸、饱和食盐水 B.饱和食盐水、浓硫酸 C.浓硫酸、
 溶液 D.
溶液 D. 溶液、浓硫酸
溶液、浓硫酸(2)甲中生成氯气的离子方程式为
 体现出的化学性质为
体现出的化学性质为(3)已为装有碱石灰的球形干燥管,其作用是
(4)某化学兴趣小组对传统方法进行改进,用易得的、价廉的
 和氯化亚砜(
和氯化亚砜( )反应,制得了无水
)反应,制得了无水 ,实验装置如图(夹持、搅拌和加热装置省略)。在圆底烧瓶中加入已碾碎的
,实验装置如图(夹持、搅拌和加热装置省略)。在圆底烧瓶中加入已碾碎的 晶体,逐渐升高温度,使之熔融,持续搅拌,缓慢用分液漏斗加入
晶体,逐渐升高温度,使之熔融,持续搅拌,缓慢用分液漏斗加入 液体,
液体, 与
与 反应,过程中会产生大量的HCI和
反应,过程中会产生大量的HCI和 气体。
气体。
 的结构可能为
的结构可能为 与
与 反应的化学方程式
反应的化学方程式 )。
)。A. B.
B. C.
C.
您最近一年使用:0次
2024-02-28更新
|
169次组卷
|
3卷引用:广西桂林市恭城瑶族自治县民族高级中学2023-2024学年高一下学期开学考试化学试题
名校
9 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置制备 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。

已知: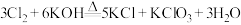
回答下列问题:
(1)盛装浓盐酸的仪器名称为________ 。 的作用
的作用________ 。
(2)b中试管内发生反应的还原剂和氧化剂的物质的量之比为________ 。 中反应的离子方程式是
中反应的离子方程式是________ 。
(3)用双线桥表示该实验制备氯气的化学方程式,并标注电子转移的方向和数目________ 。
(4)将氯气持续通入紫色石蕊试液中,溶液颜色呈如图变化:
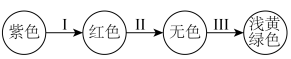
根据溶液变色情况,写出相应微粒的化学式,Ⅰ为________ 、Ⅱ为________ 、Ⅲ为________ 。
(5)某游泳池常用 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的离子方程式
,写出相应的离子方程式________ 。
 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
已知:
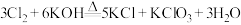
回答下列问题:
(1)盛装浓盐酸的仪器名称为
 的作用
的作用(2)b中试管内发生反应的还原剂和氧化剂的物质的量之比为
 中反应的离子方程式是
中反应的离子方程式是(3)用双线桥表示该实验制备氯气的化学方程式,并标注电子转移的方向和数目
(4)将氯气持续通入紫色石蕊试液中,溶液颜色呈如图变化:

根据溶液变色情况,写出相应微粒的化学式,Ⅰ为
(5)某游泳池常用
 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的离子方程式
,写出相应的离子方程式
您最近一年使用:0次
2024-02-22更新
|
72次组卷
|
2卷引用:广西壮族自治区百色市2023-2024学年高一上学期1月期末化学试题
名校
解题方法
10 .  是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用
是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用 与
与 反应制得
反应制得 和
和 。如图是实验室制备
。如图是实验室制备 ,并用
,并用 制取一定量纯净的
制取一定量纯净的 的装置(夹持装置已省略)。其中E中的液体用于除去
的装置(夹持装置已省略)。其中E中的液体用于除去 中未反应的
中未反应的 (已知:
(已知: 几乎不溶于饱和食盐水)。
几乎不溶于饱和食盐水)。


(1)仪器P的名称是_____ 。
(2)请写出装置A中烧瓶内发生反应的化学方程式:_____ 。
(3)装置B、C中所盛试剂分别是_____ 、_____ 。
(4)F为 收集装置,应选用图中的
收集装置,应选用图中的_____ (填序号),与装置E导管相连的导管口是_____ (填字母)。
(5)装置D中发生反应的化学方程式为:_____ 。
(6)制备漂白液的离子方程式为:_____ 。
 是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用
是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用 与
与 反应制得
反应制得 和
和 。如图是实验室制备
。如图是实验室制备 ,并用
,并用 制取一定量纯净的
制取一定量纯净的 的装置(夹持装置已省略)。其中E中的液体用于除去
的装置(夹持装置已省略)。其中E中的液体用于除去 中未反应的
中未反应的 (已知:
(已知: 几乎不溶于饱和食盐水)。
几乎不溶于饱和食盐水)。

(1)仪器P的名称是
(2)请写出装置A中烧瓶内发生反应的化学方程式:
(3)装置B、C中所盛试剂分别是
(4)F为
 收集装置,应选用图中的
收集装置,应选用图中的(5)装置D中发生反应的化学方程式为:
(6)制备漂白液的离子方程式为:
您最近一年使用:0次