1 . 利用镁与氮气反应制备氮化镁(Mg3N2),并测定其纯度。流程如下:_______ .
②装置中NaNO2与(NH4)2SO4反应生成N2的离子方程式为______ .
(2)Mg3N2的制备。在隔绝空气的条件下,将足量N2通入一定量的 粉中,充分反应,得到Mg3N2固体。
粉中,充分反应,得到Mg3N2固体。
①隔绝空气的目的是______ ;
②制备过程中,N2体现______ (填“氧化”或“还原”)性。
③Mg3N2中阴离子的化学式为______ .
(3)测定Mg3N2的纯度。取上述得到的Mg3N2样品5.42g加入水中,充分反应后,释放出标准准况下2240mLNH3。已知: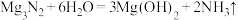 。计算Mg3N2样品的纯度
。计算Mg3N2样品的纯度______ (写成计算过程,否则不得分!)


②装置中NaNO2与(NH4)2SO4反应生成N2的离子方程式为
(2)Mg3N2的制备。在隔绝空气的条件下,将足量N2通入一定量的
 粉中,充分反应,得到Mg3N2固体。
粉中,充分反应,得到Mg3N2固体。①隔绝空气的目的是
②制备过程中,N2体现
③Mg3N2中阴离子的化学式为
(3)测定Mg3N2的纯度。取上述得到的Mg3N2样品5.42g加入水中,充分反应后,释放出标准准况下2240mLNH3。已知:
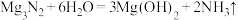 。计算Mg3N2样品的纯度
。计算Mg3N2样品的纯度
您最近一年使用:0次
2024-06-02更新
|
79次组卷
|
2卷引用:江苏省连云港市东海县2023-2024学年高一下学期期中考试化学试题
2 . 已知 晶体在加热条件下发生如下反应:
晶体在加热条件下发生如下反应: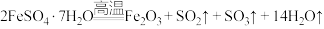 (已知:
(已知: 和
和 的熔点分别为-72.7℃、16.8℃,沸点分别为-10℃、44.8℃);利用下图装置可检验该反应的气体产物。下列说法错误的是
的熔点分别为-72.7℃、16.8℃,沸点分别为-10℃、44.8℃);利用下图装置可检验该反应的气体产物。下列说法错误的是
 晶体在加热条件下发生如下反应:
晶体在加热条件下发生如下反应: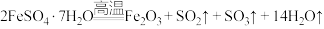 (已知:
(已知: 和
和 的熔点分别为-72.7℃、16.8℃,沸点分别为-10℃、44.8℃);利用下图装置可检验该反应的气体产物。下列说法错误的是
的熔点分别为-72.7℃、16.8℃,沸点分别为-10℃、44.8℃);利用下图装置可检验该反应的气体产物。下列说法错误的是
| A.仪器的连接顺序为a、f(或g)、g(或f)、h、i、d、e、b |
B.装置C中的X溶液为 溶液 溶液 |
| C.装置B的作用为处理尾气 |
D.反应中每生成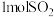 ,转移2mol电子 ,转移2mol电子 |
您最近一年使用:0次
3 . 某化学小组经查阅资料得知常温下过量的氨气和氯气反应能生成氯化铵,该实验小组对该反应进行探究,部分实验装置如下 夹持装置略去
夹持装置略去 。
。
(1)装置 是一种
是一种 的制备装置,其中盛放浓氨水的仪器名称为
的制备装置,其中盛放浓氨水的仪器名称为____ 。请再写出一种在实验室中制备 的反应原理
的反应原理_____  用化学方程式表示
用化学方程式表示 。
。
(2)装置F中发生反应的离子方程式为_____ 。
(3)装置 中盛装的试剂
中盛装的试剂 的为饱和食盐水,该装置的作用为
的为饱和食盐水,该装置的作用为______ 。
(4)装置C的设计有明显的不足之处,应该将左右的短长导管互换理由是:_____ 。
(5)利用改进后的实验装置完成实验,某同学设计如下实验证明装置C中所得固体为氯化铵:
①取少量装置C中固体产物溶于水配成溶液,取少量溶液置于两支小试管中;
②_____ ;
③向另一支试管中加入过量稀硝酸,再加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
结论:常温下过量的氨气和氯气反应可生成氯化铵。
 夹持装置略去
夹持装置略去 。
。 
(1)装置
 是一种
是一种 的制备装置,其中盛放浓氨水的仪器名称为
的制备装置,其中盛放浓氨水的仪器名称为 的反应原理
的反应原理 用化学方程式表示
用化学方程式表示 。
。(2)装置F中发生反应的离子方程式为
(3)装置
 中盛装的试剂
中盛装的试剂 的为饱和食盐水,该装置的作用为
的为饱和食盐水,该装置的作用为(4)装置C的设计有明显的不足之处,应该将左右的短长导管互换理由是:
(5)利用改进后的实验装置完成实验,某同学设计如下实验证明装置C中所得固体为氯化铵:
①取少量装置C中固体产物溶于水配成溶液,取少量溶液置于两支小试管中;
②
③向另一支试管中加入过量稀硝酸,再加入
 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。 结论:常温下过量的氨气和氯气反应可生成氯化铵。
您最近一年使用:0次
4 . 一种利用有机胺(TBA)联合生产碳酸氢钠和二氯乙烷( )的工艺流程如图所示。
)的工艺流程如图所示。
 )的工艺流程如图所示。
)的工艺流程如图所示。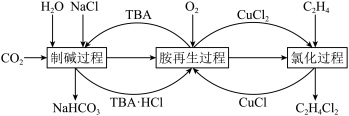
A.TBA、 在转化反应中起到催化剂作用,可以循环使用 在转化反应中起到催化剂作用,可以循环使用 |
| B.该工艺原子利用率100%,符合当前绿色化学的思想,具有一定的应用前景 |
C.“制碱过程”后通过加热蒸发结晶得到 |
D.“胺再生过程”反应为 |
您最近一年使用:0次
5 . 无水FeCl2为黄绿色晶体,在空气中易被氧化、易吸水,不溶于氯仿等有机溶剂。
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。_______ ,作用是_______ 。
(2)装置C中的试剂是_______ (填化学式)。装置D的作用是_______ 。
(3)氯苯(C6H5Cl)的球棍模型图,氯苯可由苯和氯气在催化剂条件下反应生成,其化学反应方程式为_______ ,反应类型是_______ 。
已知:Ba2+与SCN-可在溶液中大量共存;SCN-易被氧化为 。
。
(4)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的 的浓度小;
的浓度小;
假设2:氯水氧化性强,_______ 。
取实验i中浅红色溶液,_____ (填实验操作),溶液浅红色消失,从而排除假设1;向2mL水中滴加5mL0.1mol·L−1KSCN溶液,滴加0.5mL饱和氯水,加入______ ,产生白色沉淀,说明假设2正确。
(5)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是_______ (用离子方程式表示,已知SCN-中C元素为+4价)。
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl
 2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。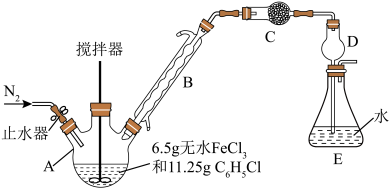
(2)装置C中的试剂是
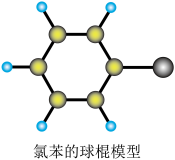
(3)氯苯(C6H5Cl)的球棍模型图,氯苯可由苯和氯气在催化剂条件下反应生成,其化学反应方程式为
| 序号 | 装置 | 试剂b | 试剂a | 实验现象 |
| 实验i |
| 5mL0.1mol·L−1KSCN溶液、1mL0.1mol·L−1FeCl2(pH=1)溶液 | 0.5mL饱和氯水 | 溶液立即变为浅红色 |
| 实验ii | 1mL15mol·L−1HNO3溶液 | 溶液变为红色,一段时间后,溶液褪为无色,且溶液中产生无色气泡,试管上方呈红棕色 |
 。
。(4)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的
 的浓度小;
的浓度小;假设2:氯水氧化性强,
取实验i中浅红色溶液,
(5)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是
您最近一年使用:0次
6 . 高纯 在光热发电领域应用广泛,部分生产方法及性质研究如下:
在光热发电领域应用广泛,部分生产方法及性质研究如下: 、NO、
、NO、 。请回答下列问题:
。请回答下列问题:
(1)方法I中,5℃时反应的离子方程式是________ 。写出溶液A中的所有离子:________ .
(2)KOH溶液吸收NO、 ,反应方程式如下:
,反应方程式如下:
i.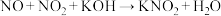 (未配平)
(未配平)
ii.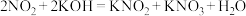
①配平并写出反应i的化学方程式:________ ;
②方法II中,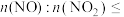
________ ,氮氧化物才能被足量的KOH溶液充分吸收。
(3)方法II中,“氧化吸收液”的目的是________ 。
(4)已知气体B是一种单质,则所得固体C为________ (填写化学式)。
(5)在某温度下, 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂 。
。
①写出 与
与 、
、 共热制取
共热制取 的化学方程式:
的化学方程式:________ 。
② 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:________ 。
 在光热发电领域应用广泛,部分生产方法及性质研究如下:
在光热发电领域应用广泛,部分生产方法及性质研究如下: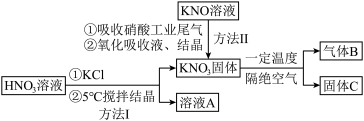
 、NO、
、NO、 。请回答下列问题:
。请回答下列问题:(1)方法I中,5℃时反应的离子方程式是
(2)KOH溶液吸收NO、
 ,反应方程式如下:
,反应方程式如下:i.
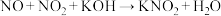 (未配平)
(未配平)ii.
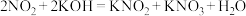
①配平并写出反应i的化学方程式:
②方法II中,
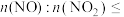
(3)方法II中,“氧化吸收液”的目的是
(4)已知气体B是一种单质,则所得固体C为
(5)在某温度下,
 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂 。
。①写出
 与
与 、
、 共热制取
共热制取 的化学方程式:
的化学方程式:②
 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
您最近一年使用:0次
7 . 纳米铁粉常用于废水处理,以草酸( )与
)与 为原料可制取纳米铁粉。
为原料可制取纳米铁粉。
(1)制取草酸
用含有适量催化剂的混酸(65% 与98%
与98% 的质量比为2:1.5)溶液氧化淀粉水解液制备草酸,其装置如图1所示。[已知:硝酸氧化淀粉水解液过程中主要反应:
的质量比为2:1.5)溶液氧化淀粉水解液制备草酸,其装置如图1所示。[已知:硝酸氧化淀粉水解液过程中主要反应:  (未配平)]
(未配平)]___________ 。
②控制反应温度不超过60℃可以防止有机物脱水炭化和___________ 。
③装置C用于尾气吸收。当尾气中 时发生反应,有能使澄清石灰水变浑浊的气体生成:写出反应方程式
时发生反应,有能使澄清石灰水变浑浊的气体生成:写出反应方程式___________ 。
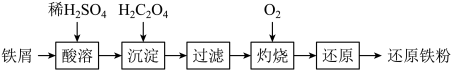
(2)制备纳米铁粉,其流程如下: 为二元弱酸。
为二元弱酸。
向酸溶后的溶液中滴加稍过量 ,过滤得
,过滤得
①沉淀反应的离子方程式为___________ 。
②过滤所得沉淀中 含量的测定:准确称取
含量的测定:准确称取 沉淀,加入适量的蒸馏水和稀硫酸溶解、酸化,并转移入
沉淀,加入适量的蒸馏水和稀硫酸溶解、酸化,并转移入 容量瓶中定容,取
容量瓶中定容,取 溶液,向其中滴加
溶液,向其中滴加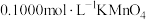 溶液,完全反应时,消耗
溶液,完全反应时,消耗 溶液
溶液 。过程中发生的反应为:
。过程中发生的反应为: (假设杂质不参与反应)。计算沉淀中
(假设杂质不参与反应)。计算沉淀中 (相对分子质量为180)的质量分数
(相对分子质量为180)的质量分数___________ (写出计算过程)。
(3)用纳米铁粉处理废水中的 ;
;
①酸性条件下,纳米铁粉与废水中 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是___________ ;
②研究发现,废水中溶解氧会对 的去除产生一定影响。在初始
的去除产生一定影响。在初始 、
、 初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条件下
初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条件下 的去除率随反应化如图所示。1~3h时,有氧条件下
的去除率随反应化如图所示。1~3h时,有氧条件下 去除率低于无氧条件下,其可能的原时间的变化如图所示。1~3h时,有氧条件下
去除率低于无氧条件下,其可能的原时间的变化如图所示。1~3h时,有氧条件下 去除率低于无氧条件下,其可能的原因是
去除率低于无氧条件下,其可能的原因是___________ 。
 )与
)与 为原料可制取纳米铁粉。
为原料可制取纳米铁粉。(1)制取草酸
用含有适量催化剂的混酸(65%
 与98%
与98% 的质量比为2:1.5)溶液氧化淀粉水解液制备草酸,其装置如图1所示。[已知:硝酸氧化淀粉水解液过程中主要反应:
的质量比为2:1.5)溶液氧化淀粉水解液制备草酸,其装置如图1所示。[已知:硝酸氧化淀粉水解液过程中主要反应:  (未配平)]
(未配平)]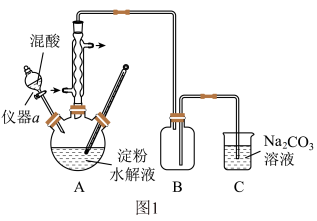
②控制反应温度不超过60℃可以防止有机物脱水炭化和
③装置C用于尾气吸收。当尾气中
 时发生反应,有能使澄清石灰水变浑浊的气体生成:写出反应方程式
时发生反应,有能使澄清石灰水变浑浊的气体生成:写出反应方程式(2)制备纳米铁粉,其流程如下:
 为二元弱酸。
为二元弱酸。向酸溶后的溶液中滴加稍过量
 ,过滤得
,过滤得
①沉淀反应的离子方程式为
②过滤所得沉淀中
 含量的测定:准确称取
含量的测定:准确称取 沉淀,加入适量的蒸馏水和稀硫酸溶解、酸化,并转移入
沉淀,加入适量的蒸馏水和稀硫酸溶解、酸化,并转移入 容量瓶中定容,取
容量瓶中定容,取 溶液,向其中滴加
溶液,向其中滴加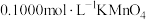 溶液,完全反应时,消耗
溶液,完全反应时,消耗 溶液
溶液 。过程中发生的反应为:
。过程中发生的反应为: (假设杂质不参与反应)。计算沉淀中
(假设杂质不参与反应)。计算沉淀中 (相对分子质量为180)的质量分数
(相对分子质量为180)的质量分数(3)用纳米铁粉处理废水中的
 ;
;①酸性条件下,纳米铁粉与废水中
 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是②研究发现,废水中溶解氧会对
 的去除产生一定影响。在初始
的去除产生一定影响。在初始 、
、 初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条件下
初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条件下 的去除率随反应化如图所示。1~3h时,有氧条件下
的去除率随反应化如图所示。1~3h时,有氧条件下 去除率低于无氧条件下,其可能的原时间的变化如图所示。1~3h时,有氧条件下
去除率低于无氧条件下,其可能的原时间的变化如图所示。1~3h时,有氧条件下 去除率低于无氧条件下,其可能的原因是
去除率低于无氧条件下,其可能的原因是
您最近一年使用:0次
名校
解题方法
8 . 实验室以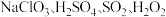 和
和 为原料,制备
为原料,制备 和无水
和无水 ,其主要流程如图所示:
,其主要流程如图所示:
②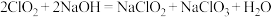
③ 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于 ,则析出
,则析出 ;温度高于
;温度高于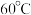 时,
时, 发生分解生成
发生分解生成 和
和 。
。
(1)反应1中 与
与 反应制得
反应制得 气体,该反应的化学方程式为
气体,该反应的化学方程式为___________ 。
(2)在图1所示装置中发生反应2生成 ,反应过程中放出大量的热。
,反应过程中放出大量的热。 与
与 的物质的量之比需要控制在0.8左右,原因可能是
的物质的量之比需要控制在0.8左右,原因可能是___________ 。
②装置Ⅱ的作用是___________ 。
(3)反应结束后,为从母液2中获得 晶体,需进行以下操作:
晶体,需进行以下操作:
①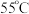 蒸发结晶;②趁热过滤;③用
蒸发结晶;②趁热过滤;③用___________  热水洗涤晶体:④低温干燥,得到成品。
热水洗涤晶体:④低温干燥,得到成品。
(4) 的溶解度曲线如图2所示。请补充完整由母液1制备无水
的溶解度曲线如图2所示。请补充完整由母液1制备无水 的实验方案:
的实验方案:___________ ,用无水乙醇洗涤,干燥得到产品。
(可选用的试剂: 溶液、氨水;除常用仪器外须使用的仪器:
溶液、氨水;除常用仪器外须使用的仪器: 计)
计)
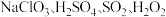 和
和 为原料,制备
为原料,制备 和无水
和无水 ,其主要流程如图所示:
,其主要流程如图所示: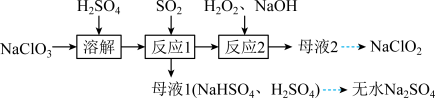

②
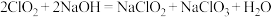
③
 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于 ,则析出
,则析出 ;温度高于
;温度高于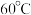 时,
时, 发生分解生成
发生分解生成 和
和 。
。(1)反应1中
 与
与 反应制得
反应制得 气体,该反应的化学方程式为
气体,该反应的化学方程式为(2)在图1所示装置中发生反应2生成
 ,反应过程中放出大量的热。
,反应过程中放出大量的热。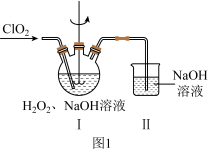
 与
与 的物质的量之比需要控制在0.8左右,原因可能是
的物质的量之比需要控制在0.8左右,原因可能是②装置Ⅱ的作用是
(3)反应结束后,为从母液2中获得
 晶体,需进行以下操作:
晶体,需进行以下操作:①
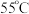 蒸发结晶;②趁热过滤;③用
蒸发结晶;②趁热过滤;③用 热水洗涤晶体:④低温干燥,得到成品。
热水洗涤晶体:④低温干燥,得到成品。(4)
 的溶解度曲线如图2所示。请补充完整由母液1制备无水
的溶解度曲线如图2所示。请补充完整由母液1制备无水 的实验方案:
的实验方案:(可选用的试剂:
 溶液、氨水;除常用仪器外须使用的仪器:
溶液、氨水;除常用仪器外须使用的仪器: 计)
计)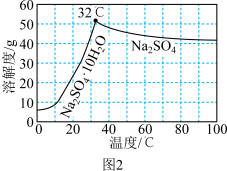
您最近一年使用:0次
名校
解题方法
9 . 实验室利用 和亚硫酰氯
和亚硫酰氯 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 沸点为
沸点为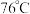 ,遇水极易反应生成两种酸性气体。
,遇水极易反应生成两种酸性气体。
(1)①实验开始先通 ,一段时间后,先加热装置
,一段时间后,先加热装置___________ (填“ ”或“
”或“ ”)。
”)。
装置 内发生反应的化学方程式为
内发生反应的化学方程式为___________ 。
装置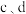 共同起到的作用是
共同起到的作用是___________ 。
②现有含少量杂质的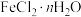 ,为测定
,为测定 值进行如下实验:
值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,滴入
样品,用足量稀硫酸溶解后,滴入 标准溶液
标准溶液 与
与 恰好完全反应(反应过程中
恰好完全反应(反应过程中 化为
化为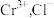 不反应)。
不反应)。
实验Ⅱ:另取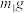 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为 。
。
则
___________ ;下列情况会导致 测量值偏小的是
测量值偏小的是___________ (填标号)。
A.样品中含少量 杂质
杂质
B.样品与 反应时失水不充分
反应时失水不充分
 实验Ⅰ中,称重后样品发生了潮解
实验Ⅰ中,称重后样品发生了潮解
(2)①用上述装置,根据反应 制备
制备 (已知:
(已知: 与
与 互溶,遇水极易反应)。写出
互溶,遇水极易反应)。写出 的电子式
的电子式___________ ,选择合适仪器并组装蒸馏装置对 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧___________ (填序号)。 在焦炭、
在焦炭、 作用下高温煅烧也可制备
作用下高温煅烧也可制备 ,在
,在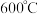 的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
该温度下, 与
与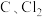 ,反应的总化学方程式为
,反应的总化学方程式为___________ ;
随着温度升高,尾气中 的含量升高,原因是
的含量升高,原因是___________ 。
 和亚硫酰氯
和亚硫酰氯 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 沸点为
沸点为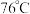 ,遇水极易反应生成两种酸性气体。
,遇水极易反应生成两种酸性气体。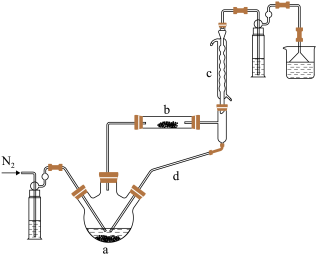
(1)①实验开始先通
 ,一段时间后,先加热装置
,一段时间后,先加热装置 ”或“
”或“ ”)。
”)。装置
 内发生反应的化学方程式为
内发生反应的化学方程式为装置
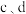 共同起到的作用是
共同起到的作用是②现有含少量杂质的
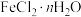 ,为测定
,为测定 值进行如下实验:
值进行如下实验:实验Ⅰ:称取
 样品,用足量稀硫酸溶解后,滴入
样品,用足量稀硫酸溶解后,滴入 标准溶液
标准溶液 与
与 恰好完全反应(反应过程中
恰好完全反应(反应过程中 化为
化为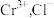 不反应)。
不反应)。实验Ⅱ:另取
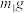 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为 。
。则

 测量值偏小的是
测量值偏小的是A.样品中含少量
 杂质
杂质B.样品与
 反应时失水不充分
反应时失水不充分 实验Ⅰ中,称重后样品发生了潮解
实验Ⅰ中,称重后样品发生了潮解(2)①用上述装置,根据反应
 制备
制备 (已知:
(已知: 与
与 互溶,遇水极易反应)。写出
互溶,遇水极易反应)。写出 的电子式
的电子式 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧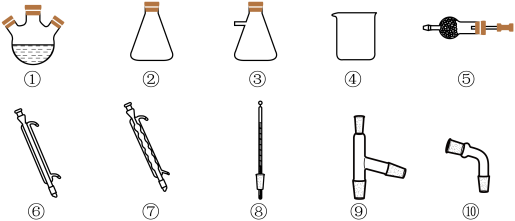
 在焦炭、
在焦炭、 作用下高温煅烧也可制备
作用下高温煅烧也可制备 ,在
,在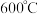 的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:| 物质 |  |  |  |  |
| 体积分数 |  | 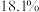 |  |  |
 与
与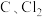 ,反应的总化学方程式为
,反应的总化学方程式为随着温度升高,尾气中
 的含量升高,原因是
的含量升高,原因是
您最近一年使用:0次
名校
解题方法
10 . 硫和氮及其化合物在生产生活中应用广泛,含氮氧化物和硫氧化物的尾气需处理后才能排放.请回答下列问题:
(1)稀硫酸、稀硝酸与铜粉反应制胆矾晶体,过程中生成一种无色气体,该气体是__________ (填化学式),制得的胆矾晶体中可能存在的杂质是__________ (填名称);
(2)(NH4)2SO3是实验室重要的常见药品,有一瓶放置了很久,某同学想设计一个实验验证这瓶药品是否变质.请你帮助他设计一个实验__________ (简述实验操作过程、现象和结论);
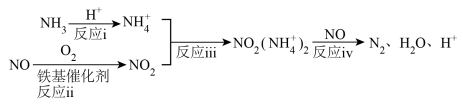
(3)应用SCR技术脱硝方法之一为:__________ ;
a.反应i体现了NH3的碱性
b.反应iv中消耗的 与NO的物质的量之比为1:1
与NO的物质的量之比为1:1
c.H+是反应的催化剂之一
②上述铁基催化剂实现SCR技术的总反应是__________ ;
(4)研究在相同时间内不同温度下经酸化 处理的Ca(ClO)2溶液对NO脱除率的影响,结果如右图所示.__________ 。
(1)稀硫酸、稀硝酸与铜粉反应制胆矾晶体,过程中生成一种无色气体,该气体是
(2)(NH4)2SO3是实验室重要的常见药品,有一瓶放置了很久,某同学想设计一个实验验证这瓶药品是否变质.请你帮助他设计一个实验
(3)应用SCR技术脱硝方法之一为:
a.反应i体现了NH3的碱性
b.反应iv中消耗的
 与NO的物质的量之比为1:1
与NO的物质的量之比为1:1c.H+是反应的催化剂之一
②上述铁基催化剂实现SCR技术的总反应是
(4)研究在相同时间内不同温度下经
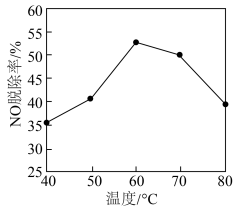
您最近一年使用:0次